篇二 :乙酸乙酯实验报告
青岛大学实验报告
20##年11月30日
姓名唐 慧 系年级08级应用化学组别 同组者
科目有机化学 题目 乙酸乙酯的制备 仪器编号
一、实验目的
1. 掌握酯化反应原理以及由乙酸和乙醇制备乙酸乙酯的方法。
2. 学会回流反应装置的搭置方法。
3. 复习蒸馏、液体的洗涤与干燥、分液漏斗的使用等基本操作。
二、实验原理
1. 本实验用冰醋酸和乙醇(过量)为原料,利用浓硫酸的吸水作用使反应顺利进行。除生成乙酸乙酯的主反应外,还有生成乙醚等的副反应。
…… …… 余下全文
篇三 :乙酸乙酯的合成实验报告
中国石油大学(华东)现代远程教育
实验报告
课程名称:有机化学
实验名称:乙酸乙酯的合成
实验形式:在线模拟+现场实践
提交形式:在线提交实验报告
学生姓名: 王博 学号: 11905380115
年级专业层次: 高起专
学习中心: 陕西黄龙县职业中学奥鹏学习中心
提交时间: 年 月 日

备注:该报告纳入考核,占总评成绩的10%。
…… …… 余下全文
篇四 :化学实验报告——乙酸乙酯的合成
乙酸乙酯的合成
一、 实验目的和要求
1、 通过乙酸乙酯的制备,加深对酯化反应的理解;
2、 了解提高可逆反应转化率的实验方法;
3、 熟练蒸馏、回流、干燥、气相色谱、液态样品折光率测定等技术。
二、 实验内容和原理
本实验用乙酸与乙醇在少量浓硫酸催化下反应生成乙酸乙酯:

副反应:

由于酯化反应为可逆反应,达到平衡时只有2/3的物料转变为酯。为了提高酯的产率,通常都让某一原料过量,或采用不断将反应产物酯或水蒸出等措施,使平衡不断向右移动。因为乙醇便宜、易得,本实验中乙醇过量。但在工业生产中一般使乙酸过量,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元共沸物给分离带来困难,而乙酸通过洗涤、分液很容易除去。
由于反应中有水生成,而水和过量的乙醇均可与乙酸乙酯形成共沸物,如表一表示。这些共沸物的沸点都很低,不超过72 ℃,较乙醇的沸点和乙酸的沸点都低,因此很容易被蒸馏出来。蒸出的粗馏液可用洗涤、分液除去溶于其中的乙酸、乙醇等,然后用干燥剂去除共沸物中的水分,再进行精馏便可以得到纯的乙酸乙酯产品。
…… …… 余下全文
篇五 :实验五 乙酸乙酯制备
乙酸乙酯制备
一、实验目的:
1、 掌握用醇和羧酸制备酯的方法。
2、 练习分液漏斗的使用及蒸馏操作
二、试剂:
乙醇 、冰醋酸、浓硫酸、饱和碳酸钠水溶液、饱和食盐水、饱和氯化钙、无水硫酸镁(或无水硫酸钠) 2~3 g (用于干燥乙酸乙酯)
三、反应原理:
主反应

副反应

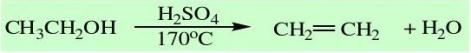
四、仪器与反应装置图:
仪器 三口圆底烧瓶、温度计、滴液漏斗、分液漏斗、锥形瓶、直形冷凝管、蒸馏头、接受弯头、加热系统。
装置图
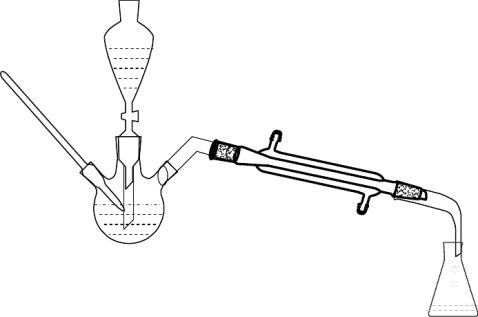
五、操作步骤:
1、粗乙酸乙酯的制备
①在干燥的100 mL三颈烧瓶中加入8 mL 95%的乙醇,在冷水冷却下,边摇边慢慢加入8 mL浓硫酸,加入沸石;在滴液漏斗中加入8 mL 95%的乙醇和8 mL乙酸,摇匀。按上述装置图组装仪器。滴液漏斗的末端和温度计的水银球必须浸到液面以下距瓶底0.5~1 cm处。
②加热,当温度计读数上升到110℃时,从滴液漏斗中滴加乙醇和乙酸混合液(速度为每分钟30滴为宜),并维持反应温度在120℃左右。滴加完毕,继续加热数分钟,直到反应液温度升到130℃,不再有馏出液为止。
2、洗涤
③向粗产物中慢慢加入饱和碳酸钠溶液,直到有机相的pH值呈中性为止。分去水相,有机相用 7 mL 饱和食盐水洗涤后,再饱和氯化钙洗涤两次,每次7mL 。弃去水层,酯层用无水硫酸钠干燥。
…… …… 余下全文
篇六 :乙酸乙酯皂化反应实验报告
乙酸乙酯皂化反应速度常相数的测定
一、实验目的
1.通过电导法测定乙酸乙酯皂化反应速度常数。
2.求反应的活化能。
3.进一步理解二级反应的特点。
4.掌握电导仪的使用方法。
二、基本原理
乙酸乙酯的皂化反应是一个典型的二级反应:
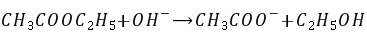 设在时间
设在时间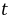 时生成浓度为
时生成浓度为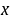 ,则该反应的动力学方程式为
,则该反应的动力学方程式为
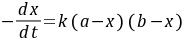 (8-1)
(8-1)
式中,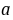 ,
,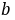 分别为乙酸乙酯和碱的起始浓度,k为反应速率常数,若a=b,则(8-1)式变为
分别为乙酸乙酯和碱的起始浓度,k为反应速率常数,若a=b,则(8-1)式变为
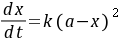 (8-2)
(8-2)
积分上式得: 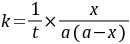 (8-3)
(8-3)
由实验测的不同t时的x值,则可根据式(8-3)计算出不同t时的k值。如果k值为常数,就可证明反应是二级的。通常是作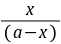 对t图,如果所的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
对t图,如果所的是直线,也可证明反应是二级反应,并可从直线的斜率求出k值。
不同时间下生成物的浓度可用化学分析法测定,也可用物理化学分析法测定。本实验用电导法测定x值,测定的根据是:
(1)溶液中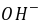 离子的电导率比离子(即
离子的电导率比离子(即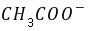 )的电导率要大很多。因此,随着反应的进行,
)的电导率要大很多。因此,随着反应的进行,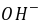 离子的浓度不断降低,溶液的电导率就随着下降。
离子的浓度不断降低,溶液的电导率就随着下降。
(2)在稀溶液中,每种强电解质的电导率与其浓度成正比,而且溶液的总电导率就等于组成溶液的电解质的电导率之和。
…… …… 余下全文
篇七 :乙酸乙酯实验报告
乙酸乙酯皂化反应速率常数测定
实验日期: 提交报告日期:
带实验的老师
一、 引言
1. 实验目的
1.学习测定化学反应动力学参数的一种物理化学分析方法——电导法。
2.了解二级反应的特点,学习反应动力学参数的求解方法,加深理解反应动力学特征。
3.进一步认识电导测定的应用,熟练掌握电导率仪的使用方法。
2. 实验原理
反应速率与反应物浓度的二次方成正比的反应为二级反应,其速率方程式可以表示为
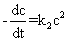 (1)
(1)
将(1)积分可得动力学方程:
 (2)
(2)
…… …… 余下全文
篇八 :乙酸乙酯的合成实验报告
中国石油大学(华东)现代远程教育
实验报告
课程名称:有机化学
实验名称:乙酸乙酯的合成
实验形式:在线模拟+现场实践
提交形式:在线提交

备注:该报告纳入考核,占总评成绩的10%。
…… …… 余下全文