篇一 :实验5 主族金属
实验5 主族金属(碱金属-碱土金属、铝、锡、铅、铋)
何 艳(只做了排版、表格重新绘制和标点替换)
(学号:012301314211 实验日期:20xx年4月2日 实验指导教师:周环波)
摘要(Abstrats):为了比较碱金属.碱土金属的活泼性,实验并比较碱土金属.铝.锡.铅.铋的氢氧化物和盐类的溶解
性,练习焰色反应并熟悉金属钠钾的安全措施。本次实验采取了一些简单合理可行的方法验证了钠钾镁的性质,以及镁.钙.钡.铝.锡.铅铋的氢氧化物的溶解性,和铅的难溶盐的性质。结果表明:钠在空气中燃烧生成Na2O2;钠.钾.镁.铝都能与水反应生成相应的碱和H2;镁.钙.钡.铝.锡.铅.铋的氢氧化物均溶于稀盐酸,部分溶于强碱;镁的氢氧化物能溶于NH4Cl(aq),而铝的氢氧化物不溶;铅的难溶盐的溶解度随着温度的升高而增大。 关键词(Key Words):碱金属;碱土金属;氢氧化物;难溶盐;化学性质
前言
元素周期表中,主族金属包括IA,IIA,p区到砹梯形连线的左下方的元素,金属元素的金属性主要表现在:其单质在能量不高时,易参加化学反应,易呈现低的正氧化态(+1,+2,+3),并形成离子键化合物; 标准电极电势是有较负的数值,氧化物的水合物显碱性,或两性偏碱性.碱金属和碱土金属属于IA和IIA族,在同一族中,金属活泼性由上到下逐渐增强,在同一周期中从左至右金属性逐渐减弱,碱土金属活泼性略差,室温下这些金属表面会缓慢氧化生成氧化膜;碱金属盐类的最大特点是绝大多数易溶于水而且能在水中完全电离.根据这些特性,可以进一步探讨验证主族金属物理化学性质。
…… …… 余下全文
篇二 :实验22 主族金属(碱金属、碱土金属、铝、锡、铅
实验22 主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋)
一、实验目的
1. 比较碱金属、碱土金属的活泼性。
2. 试验并比较碱土金属、铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性。
3. 练习焰色反应并熟悉使用金属钠、钾的安全措施。
二、实验前应思考的问题
1.实验中如何配制氯化亚锡溶液?
2.预测二氧化铅和浓盐酸反应的产物是什么?写出其反应方程式。
3.金属钠和金属钾是如何保存的?
4.在试验氢氧化铅的碱性时,应该用什么酸为宜,为什么?
三、实验用品
仪器:烧杯(250mL)、试管(10mL)、小刀、镊子、坩埚、坩埚钳、离心机
…… …… 余下全文
篇三 :无机实验习题答案
实验习题
p区非金属元素(卤素、氧、硫)
1.氯能从含碘离子的溶液中取代碘,碘又能从氯酸钾溶液中取代氯,这两个反应有无矛盾?为什么?
答:这两个反应无矛盾。因为氯的氧化性强于碘,而碘的氧化性又强于氯酸钾。
2.根据实验结果比较:
①S2O82-与MnO4-氧化性的强弱;②S2O32-与I-还原性的强弱。
答:因为S2O82-可以将Mn2+氧化为MnO4-,所以S2O82-的氧化性强于MnO4-,S2O32-能将I2还原为I-,S2O32-和还原性强于I-。
3.硫代硫酸钠溶液与硝酸银溶液反应时,为何有时为硫化银沉淀,有时又为[Ag(S2O3)2]3-配离子?
答:这与溶液的浓度和酸碱性有关,当酸性强时,会生成硫化银沉淀,而在中性条件下就会生成[Ag(S2O3)2]3-配离子。
4.如何区别:
①次氯酸钠和氯酸钠;
②三种酸性气体:氯化氢、二氧化硫、硫化氢;
③硫酸钠、亚硫酸钠、硫代硫酸钠、硫化钠。
答:①分别取少量两种固体,放入试管中,然后分别往试管中加入适量水,使固体全部溶解,再分别向两支试管中滴入两滴品红溶液,使品红溶液褪色的试管中放入的固体为次氯酸钠,剩下的一种为氯酸钠。
…… …… 余下全文
篇四 :金属活动性强弱的比较
同周期同主族元素金属性强弱的比较
一 教学目标::
知识与技能:掌握中学阶段金属元素金属性的判断依据;通过实验探究元素金属性的强弱,思考并总
结元素金属性强弱的比较方法。
过程与方法:理解金属元素金属性强弱判断标准的探究过程,进一步提升分析、比较、归纳的能力。 情感态度、价值观:培养科学兴趣、严谨求实的科学态度、勇于创新的科学精神,增强责任感,增强
协作精神。
二 教学重难点
同周期钠、镁、铝的金属性强弱比较,同主族钠、钾金属性强弱的比较
三 实验用品
试剂:金属钠、金属钾、镁条、铝片、蒸馏水、稀盐酸、氯化镁溶液、氯化铝溶液、氢氧化钠溶液、酚酞试液
仪器:试管、小烧杯、滴管、试管架、镊子、砂纸、酒精灯
四 教学过程
这节课我们就来探究讨论一下究竟从哪几个方面可以来判断金属元素的金属性强弱? 先来进行同主族金属性强弱的比较
由于实验有一定的危险性,教师进行演示实验
(1)金属元素的单质与水反应置换出H2的难易程度
【演示实验】在一盛有约50ml水的烧杯中,然后放入一小块金属钠,待反应停止后,滴入几滴酚酞,观
察。学生小组讨论用水来比较镁和铝金属性强弱的实验方案,并交流实验方案。
…… …… 余下全文
篇五 :金属有机化学国家重点实验室
金属有机化学国家重点实验室
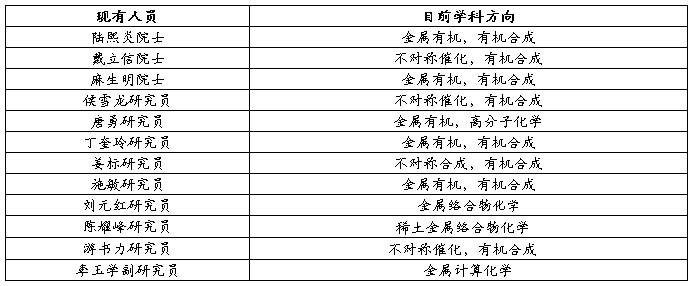
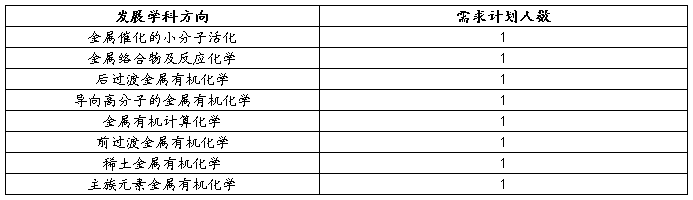
学科带头人现状与需求
2OO6年重大记事
一. 完成2006-20##年基金项目申请
共资助了30个项目,其中有机所12个,外单位18个,资助总额113.35万。
二.中科院创新团队
7月10~14日中国科学院上海有机所“均相催化研究”国际合作伙伴计划团队在成都召开了团队20##年的工作研讨会,会议邀请到了中国科学院高技术与发展局化工处白路娜同志和综合处崔丽娟同志参加。团队海外成员:美国The Pennsylvania State University的张绪穆教授、美国University of Virginia的蒲林教授、美国The Ohio State University的王鹏教授、美国Texas Tech University的李桂根教授、香港中文大学的谢作伟教授、香港科技大学的贾国成教授和团队有机所成员:麻生明、侯雪龙、唐勇、丁奎岭、施敏、刘元红全体共12位成员在会上分别作了20分钟学术报告,主要交流团队近一年来的工作进展及将来的工作打算。大家一致认为我们团队现在的合作形式非常好,交叉效果明显,无论是在基础研究方面还是面向国家需求方面都取得了一定的进展,所以一定要争取更多的支持,保证团队长久地开展合作研究,以期取得更好地结果。
…… …… 余下全文
篇六 :《无机化学实验》教学计划
《无机化学实验》教学计划
一、课程目标
无机化学实验是工业学院工业分析专业学生必修的基础课程。
通过教学,应使学生:
1、熟悉无机化学实验的基本知识,掌握无机化学基本操作技能(见后);
2、掌握常见元素的单质和化合物的性质、制备和分离提纯方法,学会某些常数的测定方法;
3、培养学生正确观察、记录、分析总结、归纳实验现象,合理处理数据,绘制仪器装置图和撰写实验报告,查阅手册,设计和改进简单实验以及处理实验室一般事故等的能力。
4、培养学生辩证唯物主义世界观,实事求是的科学态度和严谨的作风,使学生的知识、能力、素质得到全面提高,为后续实验课程打好基础,为学生终身发展奠基。
二、教材
《无机化学实验》
三、教学时数及分配
本课程共108学时,可如下分配
综合设计实验8个 24学时
考试 6学时
其中:
基本操作实验 10个 29.5 %
…… …… 余下全文
篇七 :魅力科学答案
原子的电子层结构和元素周期系已完成
1
原子核外电子排布的原则是()。
?
?
?
? A、能力最低原理 B、泡利不相容原理 C、洪特规则 D、以上均是
我的答案:D
2
原子的电子层结构与元素的周期是相对应,目前已经设立出了多少个周期?() ?
?
?
? A、7 B、8 C、9 D、10
我的答案:A
3
具有全充满,半充满,全空三种状态的电子排布,属于核外电子排布的什么原则?() ?
?
?
? A、泡利不相容原理 B、洪特规则 C、空间性原则 D、能量最低原理
我的答案:B
4
通过对原子的电子层进行分析,可以得知元素的主族和它的最高价电子数是相同的。() 我的答案:√
5
电子亲和能是元素非金属性的一种标度,元素的电子亲和能越大,非金属性越弱。() 我的答案:x
小结已完成
1
元素电负性的一般规律中,同一周期自左向右,元素的电负性递减。() 我的答案:×
2
元素电负性的一般规律中,金属元素的电负性<2.0,非金属元素的电负性>2.0。()我的答案:√
电磁感应和电磁波的发现已完成
1
1855年,是()阐明了法拉第力线的意义,使其力线观念精确化、定量化。 ? A、威廉·汤姆森
…… …… 余下全文
篇八 :河南省伊川县实验高中20xx届高三上学期第三次限时训练化学试卷

详细替换删除上移下移
1.下列离子方程式中,正确的是()
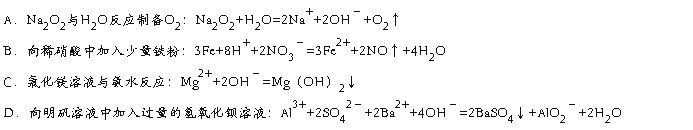
详细替换删除上移下移
2.下列各组离子在给定条件下能大量共存的是()
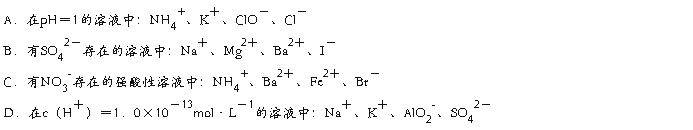
详细替换删除上移下移
3.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入一定量的稀盐酸。下列离子方程式与事实不相符的是()

详细替换删除上移下移
4.已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是()
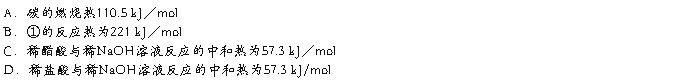
详细替换删除上移下移
5.下列有关性质的比较,不能用元素周期律解释的是()

详细替换删除上移下移
6.下列有关叙述:①非金属单质M能从N的盐溶液中置换出非金属单质N;②M原子比N原子容易得到电子;③单质M形成的气态氢化物比N形成的气态氢化物稳定; ④气态氢化物水溶液的酸性HmM>HnN;⑤氧化物对应水化物的酸性HmMOx>HnNOy;⑥熔点M>N。能说明非金属元素M比N的非金属性强的是()
…… …… 余下全文