篇一 :酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定
一.实验目的:1.培养同学们“通过实验手段用已知测未知”的实验思想。
2.学习相关仪器的使用方法,掌握酸碱滴定的原理及操作步骤.
3.实现学习与实践相结合。
二.实验仪器及药品:
仪器:滴定台一台,25mL酸(碱)滴定管各一支,10mL移液管一支,250mL锥形瓶两个。
药品:0.1mol/L NaOH溶液,0.1mol/L盐酸,0.05mol/L草酸(二水草酸),酚酞试剂,甲基橙试剂。
三.实验原理:中和滴定是酸与碱相互作用生成盐和水的反应,通过实验手段,用已知测未知。即用已知浓度的酸(碱)溶液完全中和未知浓度的碱(酸)溶液,测定出二者的体积,然后根据化学方程式中二者的化学计量数,求出未知溶液的浓度。酸碱滴定通常用盐酸溶液和氢氧化钠溶液做标准溶液,但是,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故不能直接配制成准确浓度的溶液,一般先配制成近似浓度溶液,再用基准物标定。本实验用草酸(二水草酸)作基准物。
⑴氢氧化钠溶液标定:H2C2O4+2NaOH=Na2C2O4+2H2O
…… …… 余下全文
篇二 :酸碱中和滴定实验报告
酸碱中和滴定实验报告
时间:
组别: 第 组 指导教师: 组长: 组员:
一、实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
…… …… 余下全文
篇三 :酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告
一、实验目的:测量未知溶液的浓度
二、实验原理
三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、NaOH溶液(标准液)、未知浓度的HAc
(待测液)、酚酞(变色范围8~10)
四、实验步骤
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次
3、量取:用酸式滴定管量出一定体积的未知浓度的HAc溶液,注入锥形瓶中,并往
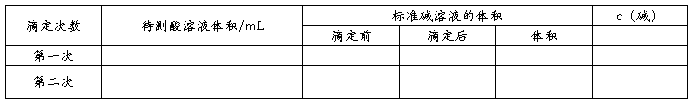
锥形瓶中滴加几滴酚酞,现象为溶液不变色。用碱式滴定管量取标准液NaOH,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位。
(二)滴定阶段
1、把锥形瓶放在碱式滴定管的下面,将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴氢氧化钠后溶液变为粉红色且半分钟内不恢复原色。此时,醋酸恰好完全被氢氧化钠中和,达到滴定终点。记录滴定后液面刻度V2。
…… …… 余下全文
篇四 :酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定
一.实验目的:
1.培养同学们“通过实验手段用已知测未知”的实验思想。
2.学习相关仪器的使用方法,掌握酸碱滴定的原理及操作步骤.
3.实现学习与实践相结合。
二.实验仪器及药品:
仪器:滴定台一台,25mL酸(碱)滴定管各一支,10mL移液管一支,250mL锥形瓶两个。
药品:0.1mol/L NaOH溶液,0.1mol/L盐酸,0.05mol/L草酸(二水草酸),酚酞试剂,甲基橙试剂。
三.实验原理:中和滴定是酸与碱相互作用生成盐和水的反应,通过实验手段,用已知测未知。即用已知浓度的酸(碱)溶液完全中和未知浓度的碱(酸)溶液,测定出二者的体积,然后根据化学方程式中二者的化学计量数,求出未知溶液的浓度。酸碱滴定通常用盐酸溶液和氢氧化钠溶液做标准溶液,但是,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故不能直接配制成准确浓度的溶液,一般先配制成近似浓度溶液,再用基准物标定。本实验用草酸(二水草酸)作基准物。
(1)氢氧化钠溶液标定:H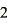 C2O4+2NaOH=Na2C2O4+2H2O
C2O4+2NaOH=Na2C2O4+2H2O
反应达到终点时,溶液呈弱碱性,用酚酞作指示剂。(平行滴定两次)
…… …… 余下全文
篇五 :中和滴定实验报告要求
中和滴定实验报告要求
本次实验作为选修4的非纸笔测试。包括:
(1) 实验预习的评价:阅读课本P48~P52、学评P93~P95;完成P51实验预习题。(与实验
报告做在同一张纸上)
(2) 实验过程的评价,观察每个同学的实验操作是否规范(星期二化学课做本实验,每组
做两次,每人一次)
(3) 实验报告的评价,每人写一份实验报告,用A4纸完成。
实验报告内容包括:
①实验目的、②实验原理、③实验用品(含试剂、仪器)、
④实验数据记录(仿照课本P51表格,规划设计好表格)。实验时,分别依次测定滴入以下体积NaOH溶液时的溶液PH: 1.00、2.00、3.00、4.00、4.50、5.00、5.08、
5.16、5.24、5.36、5.44、6.00、6.50、7.00、8.00、9.00、10.00mL)
⑤实验数据处理(用几何作图纸作滴定曲线图,贴于A4纸上)
⑥根据作图数据,计算出未知酸的浓度(已知碱为0.1320mol/L)
⑦实验误差分析。
备注:
本实验报告若认真书写,应该至少有大致2~3页A4纸的篇幅,文字量比较大。请大家认真预习、提前写好理论部分(含设计好记录数据用的表格)。等周二做完实验后,就可以马上补充数据记录、数据分析、实验中出现的问题讨论等后续部分。本实验报告在星期三要交齐。
…… …… 余下全文
篇六 :酸碱中和滴定实验预习报告
酸碱中和滴定和溶液配制实验预习报告
实验原理:
c(标)×V(标) = c(待)×V(待)
实验目的;
(1)通过中和滴定实验,掌握中和滴定实验操作方法.
(2)通过中和滴定实验,理解化学定量分析实验中有关实验数据的收集和处理,实验结果的计算,实验误差的分析等.
(3)通过酸碱中和实验,理解化学实验中测定酸或碱的浓度的基本方法.
实验要求:
a.滴定管:洗涤---检漏---润洗---注液---赶气泡---调液
润洗:用标准液或待测液分别润洗酸式滴定管和碱式滴定管.
调液:调节液面至零或零刻度线以下.如果尖嘴部分有气泡,要排出气泡.
读数:视线和凹液面最低点相切.
b.锥形瓶:洗涤
注入(用滴定管或移液管)一定体积的溶液(待测液或标准液)到锥形瓶中,并滴加
实验步骤:
(1)左手控制滴定管的活塞
(2)右手摇动锥形瓶
(3)目视锥形瓶中溶液颜色的变化
(4)终点的判断
溶液颜色发生变化且在半分钟内不再变色.
多次测定求各体积的平均值 实验注意事项:
(1)摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出。
(2)滴定时左手不能离开旋塞让液体自行流下。
…… …… 余下全文
篇七 :氧化还原滴定法和配位滴定法实验自修报告 2
氧化还原滴定法
一、概述
氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。
氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性和还原性的物质,对不具有氧化性或还原性的物质,可进行间接测定。
氧化还原反应较复杂,常伴有各种副反应,反应速度较慢,因此,氧化还原滴定法要注意选择合适条件使反应能定量、迅速、完全进行.
反应条件:
1. 滴定反应必须按一定的化学反应式定量反应,且反应完全,无副反应。
2. 反应速度必须足够快。
3. 必须有适当的方法确定化学计量点
氧化还原滴定法终点的判断
(一)自身指示剂
如 KMnO4 滴定H2C2O4时, KMnO4 既是标准溶液又是指示剂。
(二)特殊指示剂
如用于碘量法中的淀粉溶液,本身不参与氧化还原反应,但它能与氧化剂作用产生特殊的颜色,因而可指示终点。
(三)氧化还原指示剂
二、高锰酸钾法
(一)基本原理和条件
高锰酸钾法是以具有强氧化能力的高锰酸钾做标准溶液,利用其氧化还原滴定原理来测定其他物质的滴定分析方法。强酸性溶液中:
MnO4- + 8H + + 5e- → Mn2- + 4H2O
…… …… 余下全文
篇八 :酸碱中和滴定 实验报告
实验名称: 酸碱中和滴定
时间 实验(分组)桌号 合作者 指导老师
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器: 酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
…… …… 余下全文