篇一 :氧化还原反应实验报告
实验十二 氧化还原反应
一、实验目的
1. 理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。
2.加深理解氧化态或还原态物质浓度变化对电极电势的影响。
3.进一步理解原电池、电解及电化学腐蚀等基本知识。
[教学重点]
电极电势和氧化还原反应的关系。
[教学难点]
原电池、电解及电化学腐蚀等知识。
[实验用品]
仪器:低压电源、盐桥、伏特计
药品:0.5 mol·L-1Pb(NO3)2、(0.5、1 mol·L-1)CuSO4、0.5 mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·L-1FeCl3、0.1 mol.L-1KBr、0.1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 mol·L-1HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
…… …… 余下全文
篇二 :实验十 氧化还原反应
实验十 氧化还原反应
一.实验目的
1. 加深理解电极电势与氧化还原反应的关系;
2. 了解介质的酸碱性对氧化还原反应方向和产物的影响;
3. 了解反应物浓度和温度对氧化还原反应速率的影响;
4. 掌握浓度对电极电势的影响;
5. 学习用酸度计测定原电池电动势的方法.
二.实验原理
参加反应的物质间有电子转移或偏移的化学反应称为氧化还原反应.物质的还原能力的大小,可以根据相应电对电极电势的大小来判断。电极电势愈大,电对中的氧化型的氧化能力愈强。电极电势愈小,电对中的还原型的还原能力愈强。
根据电极电势大小可以判断氧化还原反应的方向.
当EMF= E(氧化剂)- E(还原剂) > 0时; 反应正向自发进行
当EMF= E(氧化剂)- E(还原剂) = 0时; 反应处于平衡状态
当EMF= E(氧化剂)- E(还原剂) < 0时; 不能进行自发反应
当氧化剂电对和还原剂电对的标准电极电势相差较大时,(如│EMF┃>0.2V时),通常可以用标准电池电动势判断反应的方向.
…… …… 余下全文
篇三 :氧化还原与电化学实验报告
氧化还原与电化学实验报告

一、实验目的
二、实验原理
三、预习思考题
1.为什么KMnO4能氧化盐酸中的Cl-,而不能氧化氯化钠溶液中的Cl-?
2. 为什么H2O2既具有氧化性,又具有还原性?试从电极电势予以说明。
3. 若用适量氯水分别与溴化钾、碘化钾溶液反应并加入CCl4,估计CCl4层的颜色。
四、实验内容

五、实验心得和建议
…… …… 余下全文
篇五 :氧化还原反应与配位平衡实验报告
氧化还原反应与配位平衡实验报告
姓名: 学号: 班级:

实验一:氧化还原反应
一、实验目的
学会装配原电池。掌握电极的本性,电对的氧化型或还原型物质的浓度、介质的酸度等因素对电极电势、氧化还原反应的方向、产物、速率的影响。通过实验了解化学电池电动势。
二、实验原理
推动氧化还原反应发生的推动力是氧化还原电对形成的电动势E,E可由正负极的电极电势求出:
E =  -
- 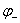
 和
和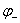 分别为正负极电对的电极电势。若E > 0,那么氧化还原反应能够发生;反之不能发生。利用这一原理可将氧化还原反应设计为原电池。
分别为正负极电对的电极电势。若E > 0,那么氧化还原反应能够发生;反之不能发生。利用这一原理可将氧化还原反应设计为原电池。
在常温下的能斯特方程为:
 =
= 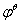 +
+ 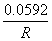 lg
lg
其中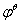 是该电对的标准电极电势,R为常数。当氧化型物质的浓度降低(如生成沉淀或形成配合物)时,会导致电极电势降低;反之,当还原性物质的浓度降低时,电极电势会升高。
是该电对的标准电极电势,R为常数。当氧化型物质的浓度降低(如生成沉淀或形成配合物)时,会导致电极电势降低;反之,当还原性物质的浓度降低时,电极电势会升高。
…… …… 余下全文
篇六 :氧化还原反应实验报告
氧化还原反应
实验目的:
通过实验掌握氧化还原反应的基本原理,熟悉几种常见的氧化还原反应。
实验原理:
· 物质的氧化还原能力的强弱与物质的本性有关, 氧化还原能力通常根据电对的电极电势的高低来判定。
· 氧化还原反应进行的方向、次序、程度, 可以根据氧化剂和还原剂所对应的电对电极电势的相对大小来判定。
?E = E氧化剂电对电势 - E还原剂电对电势 > 0 反应能自发进行
?E = E氧化剂电对电势 - E还原剂电对电势 = 0 反应处于平衡状态
?E = E氧化剂电对电势 - E还原剂电对电势 < 0 反应不能自发进行
· 氧化还原反应总是优先在电极电势差值最大的两个电对所对应的氧化剂和还原剂之间进行。
· 电极电势差值较小的两个电对所对应的氧化剂和还原剂之间能否进行氧化还原反应,应考虑浓度的影响。
…… …… 余下全文
篇七 :课题_氧化还原反应实验报告
氧化还原反应实验报告
一、实验目的
1.理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。2.加深理解氧化态或还原态物质浓度变化对电极电势的影响。3.进一步理解原电池、电解及电化学腐蚀等基本知识。
[教学重点]电极电势和氧化还原反应的关系。
[教学难点]
原电池、电解及电化学腐蚀等知识。
[实验用品]
仪器:低压电源、盐桥、伏特计
药品:0.5 mol·L-1Pb(NO3)2、(0.5、1mol·L-1)CuSO4、0.5mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·L-1FeCl3、0.1 mol.L-1KBr、0.1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 mol·L-1HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
…… …… 余下全文
篇八 :南京市雨花台中学氧化还原反应实验报告
实验十二 氧化还原反应
.一、实验目的
1. .理解电极电势与氧化还.原反应的关系和介质、浓度对氧化还原反应的影响。2.加深理解氧化态或还原态物质浓度变化对电.极电势的影响。 3.进一步理解原.电池、电解及电化学腐蚀等基本知识。
.[教学重点]
电极电势和氧化还原反应的关系。
.[教学难点]
.原电池、电.解及电化.学腐蚀等知识。
.[实验用品]
.仪器:低压电源、盐桥、伏特计
.药品:0.5 mol·L-1Pb(NO3)2、(0.5、1 mol·L-1)CuSO4、0.5 mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·.L-1FeCl3、0.1 mol.L-1KBr、0..1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 .mol·L-1HAc、(2. mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2.Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
材料:导线、砂纸、电极(铁钉、铜片、锌片、碳棒)
…… …… 余下全文
