篇一 :高中化学必修2知识点归纳总结律
高中化学必修2知识点归纳总结
第一章 物质结构 元素周期律
一、原子结构
 质子(Z个)
质子(Z个)
 原子核 注意:
原子核 注意:
中子(N个) 质量数(A)=质子数(Z)+中子数(N)
 1.原子(
A X ) 原子序数=核电荷数=质子数=原子的核外电子数
1.原子(
A X ) 原子序数=核电荷数=质子数=原子的核外电子数
核外电子(Z个)
★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
…… …… 余下全文
篇三 :人教版化学必修二第一章知识点总结
嘉祥一中高一化学 系列之知识清单
第一章 物质结构 元素周期表
第一节 元素周期表
一、周期表
原子序数 = 核电荷数 = 质子数 = 核外电子数
1、依据
横行:电子层数相同元素按原子序数递增从左到右排列
纵行:最外层电子数相同的元素按电子层数递增从上向下排列
2、结构
周期序数=核外电子层数 主族序数=最外层电子数
 短周期(第1、2、3周期)
短周期(第1、2、3周期)
 周期:7个(共七个横行)
周期:7个(共七个横行)
周期表 长周期(第4、5、6、7周期)
 主族7个:ⅠA-ⅦA
主族7个:ⅠA-ⅦA

 族:
16
个(共
18
个纵行)
副族7个:IB-
ⅦB
族:
16
个(共
18
个纵行)
副族7个:IB-
ⅦB
第Ⅷ族1个(3个纵行)
零族(1个)稀有气体元素
二.元素的性质和原子结构
(一)碱金属元素:
…… …… 余下全文
篇四 :高一化学必修二有机物知识点总结
必修二 有机物
一、有机物的概念
1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的金属化合物等除外)
2、特性
①种类多
②大多难溶于水,易溶于有机溶剂
③易分解,易燃烧
④熔点低,难导电、大多是非电解质
⑤反应慢,有副反应(故反应方程式中用“→”代替“=”)
二、甲烷
烃—碳氢化合物:仅有碳和氢两种元素组成(甲烷是分子组成最简单的烃)
1、物理性质:无色、无味的气体,极难溶于水,密度小于空气,俗名:沼气、坑气;
2、分子结构:CH4:以碳原子为中心, 四个氢原子为顶点的正四面体(键角:109度28分);
3、化学性质:
(1)、氧化性
CH4+2O2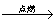 CO2+2H2O;
CO2+2H2O;
CH4不能使酸性高锰酸甲褪色;
(2)、取代反应
取代反应:有机化合物分子的某种原子(或原子团)被另一种原子(原子团)所取代的反应;
CH4+Cl2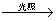 CH3Cl+HCl
CH3Cl+HCl
CH3Cl+Cl2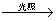 CH2Cl2+ HCl
CH2Cl2+ HCl
CH2Cl2+Cl2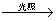 CHCl3+ HCl
CHCl3+ HCl
CHCl3+Cl2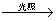 CCl4+ HCl
CCl4+ HCl
…… …… 余下全文
篇五 :化学必修2第一二章知识点总结
化学必修2第一二章知识点总结
★第一章
§第一节
1.元素周期表按照相对原子质量由大到小依次排列
2.化学性质相似的元素放在一个纵行
3.按照原子周期表中的顺序给元素编号,得到原子序数
5.原子序数=核电荷数=质子数=核外电子数2
6.元素周期表7个横行叫周期,每周期电子层数相同,左→右原子序数依次递增。周期序数=电子层数
7.第一(2)、二(8)、三(8)周期为短周期,其他周期为长周期
8.周期表有18个纵行.8、9、10叫第Ⅷ族,第ⅠA族(除H):碱金属元素,第ⅦA族:卤族元素,0族:稀有气体元素
9.碱金属元素与氧气、水的反应
4Li+O2=加热2Li2O
2Na+O2=加热Na2O2
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
10.碱金属元素除铯外,成银白色,比较柔软,有延展性,密度小(上→下↗),熔点低(上→下↘),导热、电性好
11.卤族元素由F2→I2颜色越来越深,密度逐渐增大,熔、沸点逐渐增高
12.卤族元素与氢气的反应
H2+F2=2HF
H2+Cl2=光照或点燃2HCl
H2+Br2=加热2HBr
H2+I2≈加热2HI
…… …… 余下全文
篇六 :高一化学必修2知识点总结
高一化学必修二知识点总结
一、 元素周期表
★熟记等式:原子序数=核电荷数=质子数=核外电子数
1、元素周期表的编排原则:
①按照原子序数递增的顺序从左到右排列;
②将电子层数相同的元素排成一个横行——周期;
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族
2、如何精确表示元素在周期表中的位置:
周期序数=电子层数;主族序数=最外层电子数
口诀:三短三长一不全;七主七副零八族
熟记:三个短周期,第一和第七主族和零族的元素符号和名称
3、元素金属性和非金属性判断依据:
①元素金属性强弱的判断依据:
单质跟水或酸起反应置换出氢的难易;
元素最高价氧化物的水化物——氢氧化物的碱性强弱; 置换反应。
②元素非金属性强弱的判断依据:
单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;
最高价氧化物对应的水化物的酸性强弱; 置换反应。
第ⅠA族碱金属元素:Li Na K Rb Cs Fr (Fr是金属性最强的元素,位于周期表左下方)
…… …… 余下全文
篇七 :高一化学必修2有机化合物知识点总结精编
第三章 有机化合物知识点
绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃
1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:
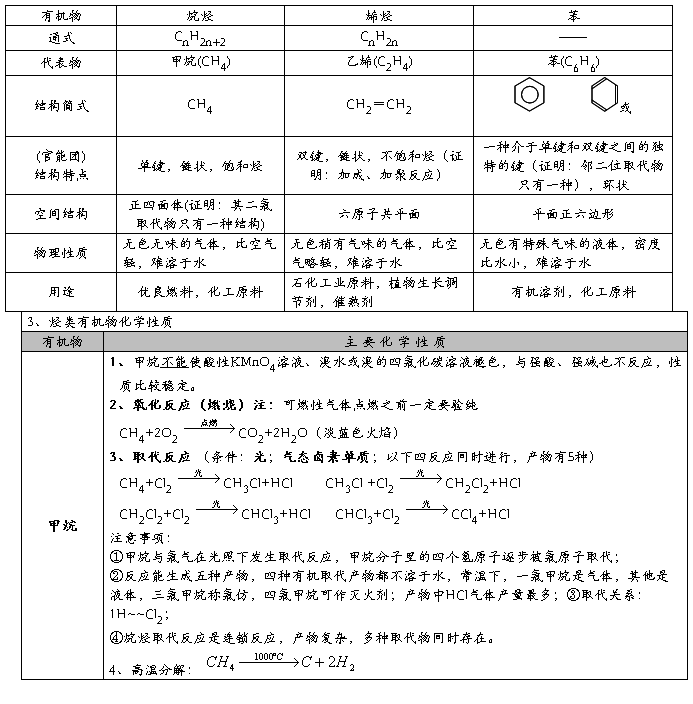
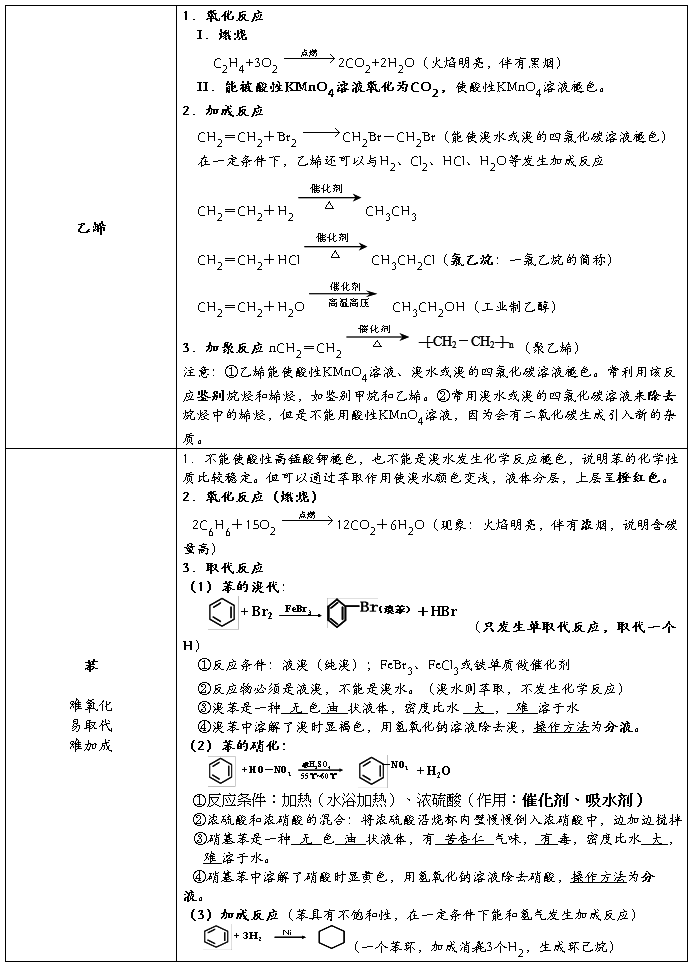
4、同系物、同分异构体、同素异形体、同位素比较。
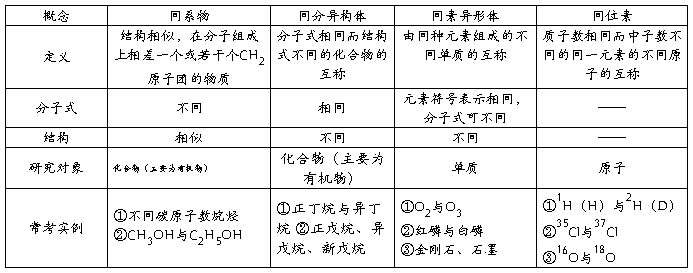
二、烃的衍生物
1、乙醇和乙酸的性质比较

三、烷烃
1、烷烃的概念:碳原子间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”的饱和链烃,或称烷烃。呈锯齿状。
2、烷烃物理性质:
状态:一般情况下,1-4个碳原子烷烃为气态,5-16个碳原子为液态,16个碳原子以上为固态。
溶解性:烷烃都难溶于水,易溶于有机溶剂。
熔沸点:随着碳原子数的递增,熔沸点逐渐逐渐升高;相同碳原子数时,支链越多,熔沸点越低。
密度:随着碳原子数的递增,密度逐渐增大,但都比水的密度小。
3、烷烃的化学性质
①一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都不反应。②氧化反应:在点燃条件下,烷烃能燃烧;③取代反应(烷烃特征反应):在光照条件下能跟卤素发生取代反应。
…… …… 余下全文
篇八 :鲁科版化学必修2知识点总结

第三章重要的有机化合物
一.认识有机化合物
绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
甲烷的性质与结构
1 .甲烷的物理化学性质

空间结构:正四面体,4个C-H键的长度和强度相同,夹角相同。
来源: 天然气、沼气 、油田气 、煤矿坑道气的主要成分都是甲烷
物性: 无色、无味的气体,密度0.717g/cm3(标准状况),比空气的密度小,可用向下排空气法收集;极难溶于水----可用排水法收集。
稳定性:通常情况,甲烷比较稳定, 不能 被H+/KMnO4、Br2等氧化剂氧化,与强酸和强碱也不反应
 甲烷的可燃性:氧化反应
甲烷的可燃性:氧化反应
CH4 + 2O2 CO2+2H2O
…… …… 余下全文