篇一 :高中化学常见题型解法归纳
化学常见题型的一般处理方法
1、有关NA的计算
(1)涉及22.4的换算应注意“标况”“气体”两个条件,不涉及22.4的气体问题的可在任意条件下进行换算,标况下有些物质不是气态(水,溴,SO3,碳4以上的有机物等);
(2)关于原子数、质子数、中子数、电子数、共价键数(共用电子对数)的求算注意对象的转化要正确,出现18O、13C之类的同位素对质量数和中子数均有影响, NaHSO4晶体中阴阳离子为1:1 ,NaHSO4溶液,Na2O2中阴阳离子为1:2,;氧化还原反应转移电子数的求算注意与涉及物质的系数对应;
(3)涉及存在可逆反应、弱电解质电离、水解、胶体微粒物质的量的计算,其数值无法求算,要比算得值小;
(4)混合物的问题,可将其作为单一物质算两次,若数值相同,则可求;若两次数值不同,则无法求算。
2、离子方程式常见错误
(1)原子不守恒或电荷不守恒;(2)该拆的没拆(例HI、浓硝酸、浓盐酸)或相反;
(3)忽略氧化还原反应的发生(氧化性离子:MnO4-、NO3-、ClO-、Fe3+等,还原性离子:S2-、SO32-、I-、Fe2+等)或漏掉多个反应中的一个(NH4HCO3与NaOH等);
…… …… 余下全文
篇二 :总结归纳高中化学典型试题及解题方法
一、关系式法
关系式法是根据化学方程式计算的巧用,其解题的核心思想是化学反应中质量守恒,各反应物与生成物之间存在着最基本的比例(数量)关系。
例题1 某种H2和CO的混合气体,其密度为相同条件下
再通入过量O2,最后容器中固体质量增加了 [ ]
A.3.2 g B.4.4 g C.5.6 g D.6.4 g
[解析]
固体增加的质量即为H2的质量。
固体增加的质量即为CO的质量。
所以,最后容器中固体质量增加了3.2g,应选A。
二、方程或方程组法
根据质量守恒和比例关系,依据题设条件设立未知数,列方程或方程组求解,是化学计算中最常用的方法,其解题技能也是最重要的计算技能。
例题2 有某碱金属M及其相应氧化物的混合物共10 g,跟足量水充分反应后,小心地将溶液蒸干,得到14 g无水晶体。该碱金属M可能是 [ ]
A.锂 B.钠 C.钾 D.铷
(锂、钠、钾、铷的原子量分别为:6.94、23、39、85.47)
设M的原子量为x
解得 42.5>x>14.5
分析所给锂、钠、钾、铷的原子量,推断符合题意的正确答案是B、C。
三、守恒法
化学方程式既然能够表示出反应物与生成物之间物质的量、质量、气体体积之间的数量关系,那么就必然能反映出化学反应前后原子个数、电荷数、得失电子数、总质量等都是守恒的。巧用守恒规律,常能简化解题步骤、准确快速将题解出,收到事半功倍的效果。
…… …… 余下全文
篇三 :打印版 期末高中化学必修一重要知识点例题详细总结
高中化学必修一重要知识点详细总结
一、俗名
纯碱、苏打:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3
石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O
石灰石、大理石:CaCO3 生石灰:CaO
熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂)
烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O
干冰:CO2 明矾:KAl (SO4)2·12H2O
…… …… 余下全文
篇四 :高中化学竞争反应题型归纳
专题讲座:竞争反应题型归纳
反应物间一对多的化学反应常有“平行反应”和“竞争反应”两类,平行反应主要指多个反应相互间没有影响可同时进行;而竞争反应是指由于反应能力不同,多个反应按一定的先后顺序逐次进行。竞争反应主要包括两种基本题型:一是一种氧化剂(还原剂)与多种还原剂(氧化剂)反应,如把Cl2通入含I-、Br-、Fe2+的溶液中,按照还原能力由强到弱的顺序,I-优先反应,其次是Fe2+,最后是Br-;二是一种酸(碱)与多种碱性(酸性)物质反应,如把盐酸逐滴加入到含有NaOH、Na2CO3、NaHCO3的混合溶液中,按照碱性由强到弱的顺序,NaOH优先反应,其次是Na2CO3,最后是NaHCO3,此类竞争反应的先后顺序即是其有效顺序。在实际问题中有部分看似平行的反应,由于物质的性质而出现了“有效”和“无效”两种可能性,准确地确定有效反应就成了解题的关键。
1.复分解反应之间的竞争
若某一溶液中同时存在几个可能的复分解反应,则生成更难溶解或更难电离的物质的反应将优先进行。
【例1】 写出在硫酸铝铵溶液中加入少量氢氧化钡溶液的离子方程式:
________________________________________________________________________。
…… …… 余下全文
篇五 :高中化学专题总结
5.(8分)工业上以铝土矿(主要成分是A12O3,含杂质Fe2O3和SiO2)为原料生产铝, 其生产流程如下:
请回答:
(1)工业上由Al2O3 冶炼金属Al所采用的方法是(填字母)。
a.电解法b.加热分解c.加入还原剂
(2)若在实验室中完成上述流程,操作①~④中属于过滤的是(填序号)。
(3)加入试剂甲后发生反应的离子方程式是。
(4)在溶液B中加入过量..烧碱溶液的目的是。
7.下列元素中,属于第ⅠA 族的是
A.钠B.镁C.硅D.硫
22.下列有关物质用途的说法中,不正确...的是
A.液氨可用作制冷剂
B.氯气可用于制漂白液
C.氧化铝可用于制造耐高温的实验仪器
D.氧化钠可用作呼吸面具中氧气的来源
24.下列反应的离子方程式正确的是
A.氯气与溴化钠溶液:Br-+ Cl2 Br2 + Cl-
B.氢氧化钡溶液与稀硫酸:OH-+ H+H2O
C.石灰石与稀盐酸:CO + 2H+CO2 ↑ + H2O 23?
D.氧化铝与氢氧化钠溶液:Al2O3 + 2OH-2AlO2-+ H2O
1.(3分)铝热反应可用于铁的冶炼:2Al + Fe2O3 2Fe + Al2O3 。在该反应中,被还原的物质是(填化学式),作为还原剂的物质是(填化学式);若反应中消耗了2 mol Al,则生成mol Fe。
…… …… 余下全文
篇六 :高中化学元素周期表和元素题型归纳
元素周期律和元素周期表习题
知识网络
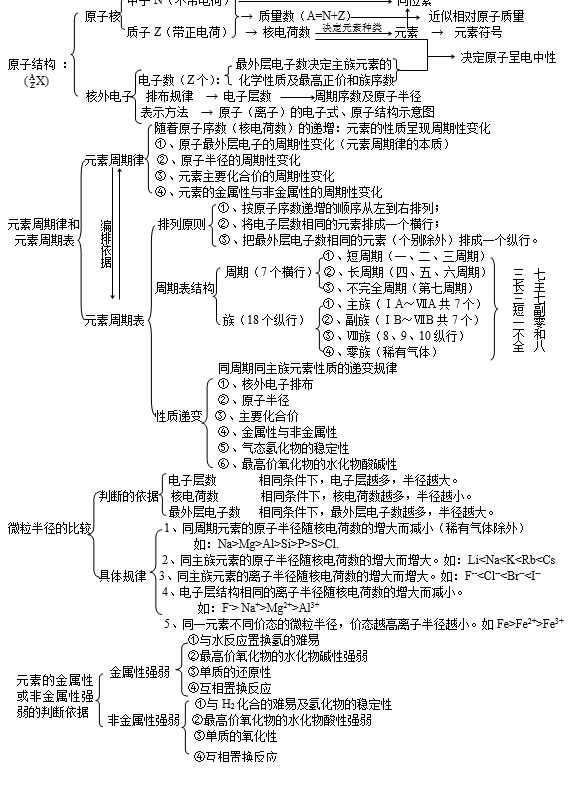
元素周期表中几个量的关系:
(1)原子序数=核电荷数=质子数=核外电子数
(2)周期序数=核外电子层数
(3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)
(4)非金属元素:|最高正价数|+|负价数|=8
巩固练习
一、原子或离子半径大小比较
1.比较下列微粒的半径大小
① 比较Na原子与Mg原子的原子半径大小
② 比较Na原子与Li原子的原子半径大小
③ 比较Na与Na+的半径大小
④ 比较Cl-与Cl的半径大小
⑤ 比较Fe、Fe2+与Fe3+的半径大小
⑥ 比较Na+与Mg2+半径大小
⑦ 比较O2-与F-半径大小
⑧ 写出下列微粒的半径由大到小的顺序:F-、O2-、Na+、Mg2+
2.下列元素的原子半径依次减小的是
A.Na、Mg、Al B.N、O、F C.P、Si、Al D.C、Si、P
…… …… 余下全文
篇七 :高中化学易错题总结
1.以下说法正确的是
A.非金属元素的原子间只形成共价键,金属元素的原子和非金属元素的原子间只形成离子键.
B.原子间必须通过电子得失或形成共用电子对而形成化学键,而与原子核无关.
C.原子是化学变化中的最小微粒,即化学变化不产生新元素.核反应产生了新元素不为化学变化.
D.金属晶体中的金属阳离子在外加电场作用下可发生定向移动,所以金属能导电.
2.在一定温度下.向饱和烧碱溶液中加入一定量的过氧化钠.充分反应后恢复到室温.下列说法正确的是( )
A.溶液中Na+浓度增大.有O2放出,
B.溶液中OH-浓度不变.有O2放出,
C.溶液中Na+数目减少.有O2放出,
D.溶液中pH增大.有O2放出.
3.将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是( )
A.x= B.0<x≤0.5 C.V=33.6n(1-x) D.11.2n<V≤22.4n
4.下列物质分子中,既含有极性键又含有非极性键的非极性分子是 ( )
…… …… 余下全文
篇八 :高中化学推断题知识点总结
高中化学推断题知识点总结
一. 基于元素周期表的推断
1. 元素的基本知识
解答这一类问题时,我们应该掌握一些有关元素的基本的特征性的常识。下面对标有红色字体的元素(单质)的基本特征性知识做一个总结。
1号元素 氢:原子半径最小,同位素没有中子,密度最小的气体。
6号元素 碳:形成化合物最多的元素,单质有三种常见的同素异形体(金刚石、石墨、富勒烯)。
7号元素 氮:空气中含量最多的气体(78%),单质有惰性,化合时价态很多,化肥中的重要元素。
8号元素氧:地壳中含量最多的元素,空气中含量第二多的气体(21%)。生物体中含量最多的元素,与生命活动关系密切的元素,有两种气态的同素异形体。
9号元素 氟:除H外原子半径最小,无正价,不存在含氧酸,氧化性最强的单质。
11号元素 钠:短周期元素中原子半径最大,焰色反应为黄色。
12号元素 镁:烟火、照明弹中的成分,植物叶绿素中的元素。
13号元素铝:地壳中含量第三多的元素、含量最多的金属,两性的单质(既能与酸又能与碱反应),常温下遇强酸会钝化。
14号元素 硅:地壳中含量第二多的元素,半导体工业的支柱。
15号元素磷:有两种常见的同素异形体(白磷、红磷),制造火柴的原料(红磷)、化肥中的重要元素。 16号元素 硫:单质为淡黄色固体,能在火山口发现,制造黑火药的原料。
…… …… 余下全文