篇一 :硝酸钾的制备与提纯实验报告
大学化学实验 报告本 (一)
姓名: 实验室: 周次: 周一 实验柜台: 61 指导老师: 章文伟
硫酸亚铁铵的制备
一.实验目的
1. 学会利用溶解度的差异制备硫酸亚铁铵。
2. 从实验中掌握硫酸亚铁、硫酸亚铁铵复盐的性质
3. 掌握水浴、减压过滤等基本操作
4. 学习pH试纸、吸管、比色管的使用
5. 学习用目测比色法检验产品质量。
二.原理
铁屑溶于稀硫酸生成硫酸铁。硫酸铁与硫酸铵作用生成溶解度较小的硫酸亚铁铵。
三.仪器及药品
洗瓶、250ml烧杯、10ml量筒、50ml量筒、吸滤瓶、比色管、铁粉、盐酸2mol/L、3mol/L硫酸、
四.实验步骤
1. 硫酸亚铁制备

2.
3. 硫酸亚铁铵的制备


Fe3+的限量分析








五.记录
1. 实验现象:
① 小火加热硝酸钠和氯化钾混合溶液过程中,烧杯内会有氯化钠晶体析出。
② 热过滤后,漏斗滤纸上出现氯化钠白色晶体。
③ 滤瓶内液温降低后,出现白色针状的硝酸钾晶体。
④ 硝酸钾溶液加热浓缩后静置,降至室温出现较多的硝酸钾晶体。
…… …… 余下全文
篇二 :无机化学实验十七 硝酸钾的制备
实验十七 硝酸钾的制备
【预习内容】
转化法
一、实验目的
1.利用温度对物质溶解度的影响不同,用复分解法制备盐类;
2.练习重结晶法提纯物质,进一步巩固溶解、过滤、结晶等操作。
二、实验原理
NaNO3 + KCl = KNO3+ NaCl
NaCl的溶解度随T变化不大,而KCl,NaNO3,KNO3在T增大时有较大的溶解度,随T减小S减小。
温度(℃)
NaCl
NaNO3
KCl
KNO3
【实验用品】
仪器:烧杯、量筒、表面皿、布氏漏斗、吸滤瓶、台秤
试剂:NaNO3(s)、KCl(s)、0.1mol·L-1AgNO3
三、实验内容及步骤
1.KNO3的制备
8.5g NaNO3+7.5g KCl+15mLH2O水浴加热,待全部溶解后,加热蒸发至原体积的2/3,有晶体析出(NaCl),趁热吸滤(布氏漏斗先预热),滤液用冰—水浴降温或自然冷却至室温,有KNO3析出,吸滤(不能用水洗,因为KNO3溶于水)称量,计算产量和产率。
2.用重结晶法提纯KNO3
粗产品加计算量的水(粗产品∶水= 2∶1),加热溶解,冷却到室温后吸滤,滤纸吸干,称量。
…… …… 余下全文
篇三 :实验十 转化法制备硝酸钾
实验十 转化法制备硝酸钾
[课时安排] 4学时
[实验目的]
1、学习用转化法制备硝酸钾晶体;
2、学习溶解、过滤、间接热浴和重结晶操作。
[实验原理介绍]
本实验是采用转化法由NaNO3和KCl来制备硝酸钾,其反应如下:
NaNO3+ KCl?NaCl + KNO3
该反应是可逆的。根据氯化钠的溶解度随温度变化不大,而氯化钾、硝酸钠和硝酸钾在高温时具有较大或很大的溶解度而温度降低时溶解度明显减小(如氯化钾、硝酸钠) 或急剧下降(如硝酸钾)的这种差别,将一定浓度的硝酸钠和氯化钾混合加热浓缩,当温度达118~120℃时,由于硝酸钾溶解度增加很多,达不到饱和,不析出;而氯化钠的溶解度增加很少,随浓缩、溶剂的减少,氯化钠析出。通过热过滤滤除氯化钠,将此溶液冷却至室温,即有大量硝酸钾析出,氯化钠仅有少量析出,从而得到硝酸钾粗产品。再经过重结晶提纯,可得到纯品。
[基本操作与仪器介绍]
1、布氏漏斗及吸滤瓶的使用方法
布氏漏斗和吸滤瓶配套使用于减压过滤。布氏漏斗上有许多小孔,漏斗颈插入单孔橡皮塞,与吸滤瓶相接。橡皮塞插入吸滤瓶内的部分不得超过塞子高度的2/3,漏斗管下方的斜口要对着吸滤瓶的支管口。
…… …… 余下全文
篇四 :实验9 转化法制备硝酸钾
实验七转化法制备硫酸钾——溶解、蒸发、结晶和固液分离[实验目的] 学习用转化法制备硫酸钾晶体。学习溶解、过滤、间接热浴和重结晶体操作。[实验用品] 仪器:量筒、烧杯、台秤、石棉网、三角架、铁架台、热滤漏斗、布氏漏斗、吸滤瓶、水泵(水流唧筒) 、瓷坩埚、坩 埚钳、温度计(200 C) 、比色管(25ml) 、硬质试管、烧杯(500ml) 固体药品:硫酸钠(工业级) 、氯化钾(工业级) 液体药品:AgNO3(0.1mol·L )、硝酸(5mol·L ) 、氯化钠标准溶液、甘油 材料:滤纸 [基本操作] 1.固体的溶解、过滤、重结晶参见第六章中一。 2.间接热浴操作参见第三章中三。 工业上常采用转化法制备硫酸钾晶体,其反应如下: NaNO3+KCl=NaCl+NaCl+KNO3 反应是可逆的。根据氯化钠的溶解度随温度变化不大,而氯化钾、硝酸钠和硝酸钾在高温时具有较大或很大的溶解度而 温度降低时溶解度明显减小(如氯化钾、硝酸钠)或急剧下降(如硝酸钾)的这种差别。将一定浓度的硝酸钠和氯化钾 混合液加热浓缩,当温度达 118~120 C 时,由于硝酸钾溶解度增加很多,达不到饱和,不析出;而氯化钠的溶解度增 加甚少,随浓缩、溶剂的减少,氯化钠析出。通过热过滤除氯化钠,将此溶液冷却至室温,即有大量硝酸钾析出,氯化 钠仅有少量析出,从而得到硝酸钾粗产品。再经过重结晶提纯,可得到纯品。 表 6-1 盐 KNO3 KCl NaNO3 NaCl [实验内容] 1.溶解蒸发 称取 22gNaNO3 和 15gKCl,放入一只硬质试管,加 35mlH2O。将试管置于甘油浴中加热(试管用铁夹垂直地固定在 铁架台上, 用一只 500ml 烧杯盛甘油至大约烧杯容积的 3/4 作为甘油浴,试管中溶液的液面要在甘油浴的液面之下,并在烧 杯外对准试管内液面高度处做一标记) 。甘油浴温度可达 140~180℃,注意控制温度,不要使其热分解,产生刺激性的 丙烯醛。 待盐全部溶解后,继续加热,使溶液蒸发至原有体积的 2/3。这时试管中有晶体析出, (是什么?)趁热用热滤漏 斗过滤。滤液盛于小烧杯中自然冷却。随着温度的下降,即有结晶析出。 (是什么?)注意,不要骤冷,以防结晶过于 细小。用减压法过滤,尽量抽干。KNO3 晶体水浴烤干后称重。计算理论产量和产率。 2.粗产品的重结晶 (1)除保留少量(0.1~0.2g)粗产品供纯度检验外,按粗产品:水=2:1(质量比)的比例,将粗产品溶于蒸馏 水中。 (2)加热、搅拌、待晶体全部溶解后停止加热。若溶液沸腾时,晶体还未全部溶解,可再加极少量蒸馏水使其溶 解。 (3)待溶液冷却至室温后抽滤,水浴烘干,得到纯度较高的硝酸钾晶体,称量。 3.纯度检验 (1)
…… …… 余下全文
篇五 :实验三草酸合铁(III)酸钾的制备和组成测定2齐齐哈尔大学化学专业 实验报告无机部分
齐 齐 哈 尔 大 学
实 验 报 告
题 目:三草酸合铁(III)酸钾的制备和组成测定
学 校:_齐齐哈尔大学__
专业班级:_化学101__ _
学生姓名: ____叶梦_____
同组者姓名:___苟登红____
成 绩:___________
2013 年 10 月 9 日
…… …… 余下全文
篇六 :己二酸的制备实验报告
实验八 己二酸的制备
一、实验目的
1、学习环己醇氧化制备己二酸的原理和方法;
2、掌握浓缩、过滤及重结晶等操作技能
二、实验原理
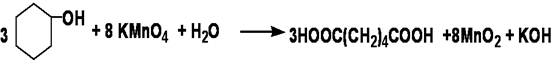
三、实验药品及其物理常数
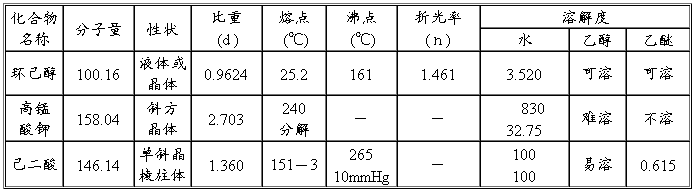
环己醇:2g 2.1ml (0.02mol);高锰酸钾 6g (0.038mol);0.3N氢氧化钠溶液 50ml;亚硫酸氢钠;浓盐酸
四、主要仪器和材料
水浴锅 三口烧瓶(100 mL、19#×3) 恒压滴液漏斗 空心塞(14#) 球形冷凝管(19#) 螺帽接头(19#,2只) 温度计(100℃) 布氏漏斗 吸滤瓶 烧杯 冰 滤纸 水泵等.
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。本实验采用碱性高锰酸钾作氧化剂
五、实验装置

六、操作步骤
(1)向250ml烧杯内加入50ml 0.3N氢氧化钠溶液,置于磁力搅拌上;
(2)边搅拌边将6g 高锰酸钾溶解到氢氧化钠溶液中;
(3)用滴管滴加2.1ml 环己醇到上述溶液中,维持反应物温度为43~47 ℃。
(4)当醇滴加完毕且反应混合物温度降低至43 ℃左右时,沸水浴将混合物加热,使二氧化锰凝聚。
…… …… 余下全文
篇七 :齐齐哈尔大学化学专业实验三草酸合铁(III)酸钾的制备和组成测定
齐 齐 哈 尔 大 学
实 验 报 告
题 目:三草酸合铁(III)酸钾的制备和组成测定 学 校:_齐齐哈尔大学___
专业班级:___化学072____
学生姓名:_____ _____
同组者姓名:__________
成 绩:___________
齐齐哈尔大学化学专业实验
[实验目的]
1 掌握合成K3[Fe(C2O4)3]?3H2O的基本原理和操作技术; 2 加深对铁(III)和铁(II)化合物性质的了解; 3 掌握容量分析等基本操作。
[实验原理]
三草酸合铁(III)酸钾(含三个结晶水)为翠绿色单斜晶体,易溶于水且难溶于乙醇,受光易分解。
本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(III)草酸配合物。主要反应为
(NH4)2Fe(SO4)2?H2C2O4?2H2O??FeC2O4?2H2O??(NH4)2SO4?H2SO4
2FeC2O4?2H2O?H2O2?3K2C2O4?H2C2O4??2K3[Fe(C2O4)3]?3H2O
改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁(III)酸钾,通过化学分析确定配离子的组成。用高锰酸钾标准溶液在酸性介质中滴定测得草酸根的含量。Fe3?含量可先用过量镁粉将其还原为Fe2?,然后再用高锰酸钾标准溶液滴定而测得,其反应式为
…… …… 余下全文
篇八 :己二酸的制备实验报告
己二酸的制备
一、实验目的
1、学习环己醇氧化制备己二酸的原理和方法;
2、掌握浓缩、过滤及重结晶等操作技能
二、实验原理
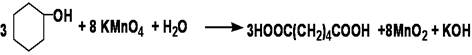
三、实验药品及其物理常数

环己醇:2g 2.1ml (0.02mol);高锰酸钾 6g (0.038mol);0.3N氢氧化钠溶液 50ml;亚硫酸氢钠;浓盐酸
四、主要仪器和材料
水浴锅 三口烧瓶(100 mL、19#×3) 恒压滴液漏斗 空心塞(14#) 球形冷凝管(19#) 螺帽接头(19#,2只) 温度计(100℃) 布氏漏斗 吸滤瓶 烧杯 冰 滤纸 水泵等.
氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。本实验采用碱性高锰酸钾作氧化剂
操作步骤
(1)向250ml烧杯内加入50ml 0.3N氢氧化钠溶液,置于磁力搅拌上;
(2)边搅拌边将6g 高锰酸钾溶解到氢氧化钠溶液中;
(3)用滴管滴加2.1ml 环己醇到上述溶液中,维持反应物温度为43~47 ℃。
(4)当醇滴加完毕且反应混合物温度降低至43 ℃左右时,沸水浴将混合物加热,使二氧化锰凝聚。
(5)在一张平整的滤纸上点一小滴混合物以试验反应是否完成,如果观察到试液的紫色存在,那么可以用少量固体亚硫酸氢钠来除掉过量的高锰酸钾。
…… …… 余下全文