篇一 :化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定
(实验报告及数据处理)
实验目的
1.了解浓度、温度及催化剂对化学反应速率的影响。
2.测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
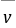 = -
= - 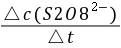 =
= 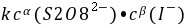 式中:
式中: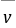 ── 反应的平均反应速率;
── 反应的平均反应速率;
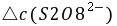 ──
── 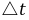 时间内
时间内 的浓度变化;
的浓度变化;
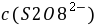 ,
,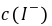 ──
──  ,
,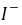 的起始浓度;
的起始浓度;
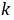 ── 该反应的速率系数;
── 该反应的速率系数;
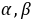 ──反应物
──反应物 ,
,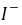 的反应级数,
的反应级数,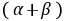 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(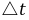 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq) ══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
…… …… 余下全文
篇二 :化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告
1.概述
化学反应速率用符号J或ξ表示,其定义为:
J=dξ/dt (3-1)
ξ为反应进度,单位是mol,t为时间,单位是s。所以单位时间的反应进度即为反应速率。
dξ=v-1BdnB (3-2)
将式(3-2)代入式(3-1)得:
J=v-1BdnB/dt
式中nB为物质B的物质的量,dnB/dt是物质B的物质的量对时间的变化率,vB为物质B的化学计量数(对反应物vB取负值,产物vB取正值)。反应速率J总为正值。J的单位是mol·s-1。

根据质量作用定律,若A与B按下式反应:
aA+bB→cC+dD
其反应速率方程为:
J=kca(A)cb(B)
k为反应速率常数。
a+b=n
n为反应级数。n=1称为一级反应,n=2为二级反应,三级反应较少。反应级数有时不能从方程式判定,如:
2HI→I2+H2
看起来是二级反应。实际上是一级反应,因为
HI→H+I(慢)
HI+H→H2+I(快)
I+I→I2(快)
反应决定于第一步慢反应,是一级反应。从上述可知,反应级数应由实验测定。
…… …… 余下全文
篇三 :酸碱中和滴定、化学反应速率和化学平衡实验报告
酸碱中和滴定实验报告(一)
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器:酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
实验药品: 0.1000mol/L盐酸(标准溶液)、未知浓度的NaOH溶液(待测溶液)、
酸碱指示剂:酚酞(变色范围8~10)或者甲基橙(3.1~4.4)
三:实验原理: c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
【本实验具体为:c(H+)×V(酸) = c(OH-)×V(碱)】
四:实验过程:
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水(具体方法: 酸式滴定管,将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。有漏必须在活塞上涂抹凡士林,注意不要涂太多,以免堵住活塞口。 碱式滴定管检漏方法是将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。如果有漏,必须更换橡皮管。)
…… …… 余下全文
篇四 :2-实验-化学反应速率和化学平衡
化学20(杭州学军中学陈进前编制)
实验 化学反应速率和化学平衡
[教学目标]
1.知识目标
(1)巩固浓度、温度和催化剂对化学反应速率的影响等基本知识,加深浓度、温度对化学平衡影响等基础知识的理解。
(2)通过实验,体会用定量方法研究化学反应速率、化学平衡规律基本程序,掌握相关的实验操作规范。
(3)掌握“Na2S2O3+H2SO4=Na2SO4+S+H2O、FeCl3+3KSCN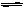 Fe(SCN)3+3KCl”等反应,体会用化学实验研究某个化学反应的一般程序。
Fe(SCN)3+3KCl”等反应,体会用化学实验研究某个化学反应的一般程序。
2.能力和方法目标
(1)定量实验中数据采集、记录和处理方法。
(2)通过从实验现象、实验数据推测理论规律,提高推理分析能力。
3.情感和价值观目标
本实验中的实验现象生动有趣、实验操作简便、推理和分析过程引人入胜,所以可以通过本实验来提高学生学习化学的兴趣,引发学生探究规律、研究自然现象的乐趣。
[实验内容和实验要点]
本学生实验共包含浓度对化学反应速率的影响、温度对化学反应速率的影响、催化剂对化学反应速率的影响、浓度对化学平衡的影响、温度对化学平衡的影响等5个内容,实验过程中既有定性研究要求、又有定量研究要求,要求学生用定性和定量两方面的综合思维来分析和研究。实验中应要求带着研究的观点、在探究的层面上去思考。本实验的各个内容中所涉及的实验技能、实验注意事项等列表如下:
…… …… 余下全文
篇五 :化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告
姓名 班级 试验时间
第 室 号位 指导教师
实验目的
1. 了解浓度、温度及催化剂对化学反应速率的影响。
2. 测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
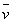 = -
= - 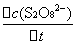 =
= 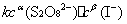
式中: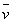 ── 反应的平均反应速率;
── 反应的平均反应速率;
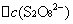 ──
── 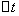 时间内
时间内 的浓度变化;
的浓度变化;
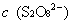 ,
,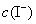 ──
──  ,
,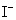 的起始浓度;
的起始浓度;
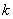 ── 该反应的速率系数;
── 该反应的速率系数;
…… …… 余下全文
篇六 :大学实验化学 化学反应速率

难题解析 [TOP]
例7-1 HNO2分解反应机理如下,求总反应的速率方程表示式。

分析 复合反应的每一步都是元反应,反应的速率方程由速率控制步骤决定。
解 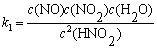 ,
, 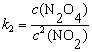
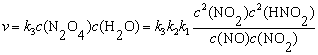
=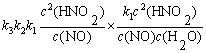
v =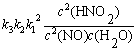
例 7-2 证明一级反应完成99.9%所需要的时间近似为半衰期的10倍。
解 t1/2 = 0.693/ k
…… …… 余下全文
篇七 :乙酸乙酯皂化反应速率常数的测定实验报告
学号:201114120222

基础物理化学实验报告
实验名称:乙酸乙酯皂化反应速率常数的测定
应用化学二班 班级 03 组号
实验人姓名: xx
同组人姓名:xxxx
指导老师: 李旭老师
实验日期: 20##-10-29
湘南学院化学与生命科学系
一、实验目的:
1、了解测定化学反应速率常数的一种物理方法——电导法。
2、了解二级反应的特点,学会用图解法求二级反应的速率常数。
3、掌握DDS-11A型数字电导率仪和控温仪使用方法。
二、实验原理:
1、对于二级反应:A+B→产物,如果A,B两物质起始浓度相同,均为a,则反应速率的表示式为
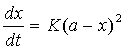 (1)
(1)
…… …… 余下全文
篇八 :利用传感器测定化学反应速率 ---实验报告---参赛选手用
《利用传感器测定 说明:1.实验用时为20分钟,超过5分钟以内扣5分。2.统一使用提供的传感器与计算机软件进行实验。
选手姓名(序号): 桌号:
一、实验目的
利用传感器采集相关数据,根据绘制的图表来测定 。
二、实验仪器与软件
计算机、朗威软件、传感器(压强、温度、PH、CO2、电导率等)、数据采集器。
三、实验药品与用品
四、实验原理与分析
五、实验步骤与操作
六、数据收集与处理
七、实验结论与解释
…… …… 余下全文