篇一 :苯甲酸重结晶实验报告
苯甲酸的重结晶
实验目的:了解重结晶提纯粗苯甲酸的原理和方法。
实验原理:苯甲酸在水中的溶解度随温度的变化较大,通过重结晶可以使它与杂质分离,从而达到分离提纯的目的。
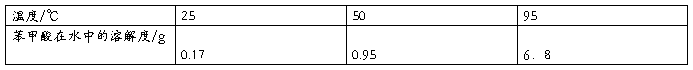
实验试剂:粗苯甲酸(本实验中的药品混有氯化钠和少量泥沙)、AgNO3溶液、蒸馏水
实验仪器、用品:烧杯、铁架台(带铁圈)、酒精灯、普通漏斗、玻璃棒、坩埚钳、滤纸、石棉网、药匙、三脚架、试管、胶头滴管、火柴。
实验步骤:
一、热溶解
①取约0.5g粗苯甲酸晶体置于100mL烧杯中,加入50mL蒸馏水。
②在三脚架上垫一石棉网,将烧杯放在石棉网上,点燃酒精灯加热,不时用玻璃棒搅拌(注意:搅拌时玻璃棒不要触及烧杯内壁)。
③待粗苯甲酸全部溶解,停止加热。
二、热过滤
①将准备好的过滤器放在铁架台的铁圈上,过滤器下放一小烧杯。
②将烧杯中的混合液趁热过滤。(过滤时可用坩埚钳夹住烧杯,避免烫手),使滤液沿玻璃棒缓缓注入过滤器中。
三、冷却结晶
将滤液静置冷却,观察烧杯中晶体的析出。(在静置冷却的同时,再准备好一个过滤器)。
四、过滤洗涤
①将析出苯甲酸晶体的混合液过滤,滤纸上为苯甲酸晶体。
②取2mL滤液于一支试管中,检验其中的氯离子。
…… …… 余下全文
篇二 :苯甲酸重结晶实验报告作业
实验二 苯甲酸的重结晶及测熔点
——10级 班 1
一、实验目的:
1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;
2、 掌握热过滤和抽滤操作。
二、基本原理:
1、重结晶的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
注意——重结晶只适宜杂质含量在5%以下的固体有机混合物的提纯。从反应粗产物直接重结晶是不适宜的,必须先采取其他方法初步提纯,然后再重结晶提纯。
2、溶剂的选择:
1)被提纯物质,高温下溶解度大,低温下溶解度小。
2)与被提纯的物质不发生化学反应。
3)杂质溶解度要么非常大要么非常小。
…… …… 余下全文
篇三 :有机化学实验报告 苯甲酸的重结晶
苯甲酸的重结晶
一、实验目的:
1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;
2、 掌握热过滤和抽滤操作。
二、基本原理:
1、重结晶的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
注意:重结晶只适宜杂质含量在5%以下的固体有机混合物的提纯。从反应粗产物直接重结晶是不适宜的,必须先采取其他方法初步提纯,然后再重结晶提纯。
2、溶剂的选择:
1)被提纯物质,高温下溶解度大,低温下溶解度小。
2)与被提纯的物质不发生化学反应。
3)杂质溶解度要么非常大要么非常小。
4)溶剂易挥发。(相对被提纯物质)
5)能形成较好的晶体。
6)无毒无害,价廉易得。
三、实验试剂与仪器:
药品:苯甲酸、活性炭。
仪器:烧杯、玻璃棒、吸滤瓶、布氏漏斗、滤纸、加热器。
四、实验步骤:
…… …… 余下全文
篇四 :实验1 苯甲酸的重结晶
实验一 苯甲酸的重结晶
一、实验目的
1、熟悉重结晶法提纯有机化合物的原理、方法和溶剂的选择。
2、掌握溶解、饱和溶液配制、抽滤、脱色、热过滤、结晶等实验基本操作技术。
二、基本原理(略,详见实验指导中的相关内容。P61-64; P46-51)
三、实验仪器
真空循环水泵、三角锥瓶150ml、布氏漏斗、抽滤瓶、滤纸、烧杯100ml、表面皿、剪刀、水浴锅、电炉、红外灯。
四、实验操作步骤
(1) 溶解:称取需提纯的苯甲酸1.0g、放入150ml的三角烧瓶中并加入50ml水,电炉加热,
并不断摇动使之溶解。
(2) 脱色:三角烧瓶脱离电炉,微冷却后加入半药勺活性炭。用电炉加热至沸腾3-5分钟。
(3) 热过滤:将有色溶液用沟型滤纸热过滤,得到脱色滤液。
(4) 结晶:热过滤得到的滤液,自然冷却至结晶析出后,可用冰水冷却至结晶完全析出。
(5) 抽滤:用减压抽滤装置除去母液,使晶体完全转移,并用玻璃盖压紧结晶滤饼。
(6)洗涤:用 5ml蒸馏水均匀润洒洗涤滤饼、减压抽干。重复洗涤一次,再减压抽干。然后
用不锈钢勺将结晶转移至一块表面皿上。
(7)干燥:将结晶移至红外灯下干燥,干燥后称重,计算转化率。
…… …… 余下全文
篇五 :实验四、苯甲酸的重结晶
实验四、苯甲酸的重结晶
一、实验目的
1、了解有机物重结晶提纯的原理和应用。
2、掌握加热、回流、冷却、减压过滤和恒重干燥等操作。
3、掌握折叠滤纸的作用与折叠方法。
3、掌握有机物重结晶提纯的基本步骤和操作方法。
4、掌握固体有机物干燥与否的恒重法判断方法。
二、试验原理
1、基本原理
将欲提纯的物质在较高温度下溶于合适的溶剂中制成饱和溶液,趁热将不溶物滤去,在较低温度下结晶析出,而可溶性杂质留在母液中,这一过程称为重结晶。
原理就是利用物质中各组分在同一溶剂中的溶解性能不同而将杂质除去。
2、一般过程
选择溶剂;制饱和溶液;趁热过滤(如溶液的颜色深,则应先脱色,再趁热过滤);冷却析晶;抽气过滤;洗涤干燥。
活性炭的用量应视杂质的多少而定。一般为干燥粗产品重量的1-5%。
3、重结晶所用溶剂要求
与要提纯的物质不起化学反应;对被提纯的有机物质必须具备溶解度在热时较大,而在较低温度时则较小的特性;对杂质的溶解度非常大或非常小,溶解度大者使杂质留在母液中,不与被提纯物一道析出结晶;溶解度小者使杂质在热过滤时被除去;对要提纯的物质能生成较整齐的晶体;溶剂的沸点,不宜太低,也不宜太高。当过低时,溶解度改变不大,操作又不易,过高时,附着于晶体表面的溶剂不易除去,等等。
…… …… 余下全文
篇六 :第十三周化学实验报告苯甲酸的提纯和测定
华南农业大学实验报告
专业班次 11农学一班 组别* *
题目 苯甲酸的提纯和测定
姓 名 **
日期
【实验目的】
1、 了解固体有机物的分离和提纯方法;
2、 掌握回流,重结晶,测熔点的操作。
【实验原理】
重结晶:固体物质在溶剂中的溶解度随温度升高而增大,如果把固体物质溶解在热的溶剂中制成饱和或接近饱和的溶液,然后冷却至室温或室温以下,则溶解度下降,溶液过饱和,这时就会有晶体析出;
熔点测定原理:熔点是晶体物质的固相和液相在正常大气压下成平衡的温度,纯净的固态有机化合物都有固定的熔点,而且一般不高,用简单的一起就可以测定,有机化合物的熔点通常用毛细管发测定,纯净的有机化合物固液两相之间的变化非常敏锐,熔点范围很少,当含有杂质的时候,会使熔点变小,并且熔点范围增大。
【实验步骤】
1、 将粗苯甲酸用热水进行重结晶,烘干产品得到纯苯甲酸,
2、 测定产率,
3、 测定苯甲酸的熔点: 去一直径为1-2mm,长度7-8cm的毛细管,将其一端放在火焰上烧融,使之封闭,将少许的苯甲酸放在洁净的表面皿上,用玻璃棒研成粉末并束成一堆,然后将熔点管的开口端插入到试样中,装取试样后,将端口向上,把熔点管竖起来,在台面上轻顿几下,再取30~40cm的干燥玻璃管,垂直于台面上,让熔点管自由下落,重复几次,使试样落到管的底部,并且结实均匀,
去一直径为1-2mm,长度7-8cm的毛细管,将其一端放在火焰上烧融,使之封闭,将少许的苯甲酸放在洁净的表面皿上,用玻璃棒研成粉末并束成一堆,然后将熔点管的开口端插入到试样中,装取试样后,将端口向上,把熔点管竖起来,在台面上轻顿几下,再取30~40cm的干燥玻璃管,垂直于台面上,让熔点管自由下落,重复几次,使试样落到管的底部,并且结实均匀,
…… …… 余下全文
篇七 :苯甲酸和萘的分离实验报告
苯甲酸和萘的分离实验报告
一、实验目的
1.了解苯甲酸和萘的基本性质
2.掌握固体有机混合物的分离原理及方法
3.复习萃取、蒸馏及重结晶等纯化技术
二、实验基本原理
苯甲酸和萘在常温下均为白色固体有机物,并且均不溶于水而易溶于醇、醚
等有机溶剂。所以不能根据两物质在不同溶剂中溶解度不同来达到分离的目的。
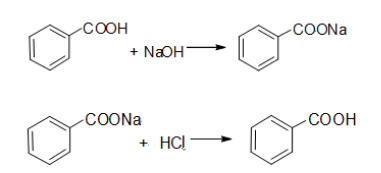
但是,苯甲酸可以和氢氧化钠作用得到苯甲酸钠,而苯甲酸钠易溶于水。可
将混合物溶于乙醚后加入氢氧化钠水溶液萃取并洗涤,乙醚层经洗涤、干燥、蒸
馏得到萘;水层经酸化、减压过滤得到苯甲酸。从而达到分离的目的。
反应方程式:
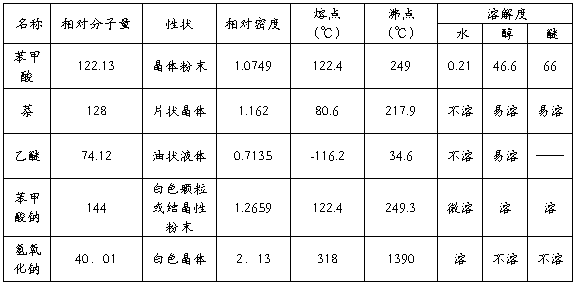
三、主要试剂及主、副产物的物理常数
四、主要试剂规格及用量
五、实验装置图

六、实验操作步骤
1、称取2g苯甲酸和萘的混合物于100mL锥形瓶中,加入20mL乙醚使之
充分溶解。
2、把混合物的乙醚溶液倒入分液漏斗中,然后量取20ml 10%氢氧化钠溶
…… …… 余下全文
篇八 :实验三 重结晶及熔点测定(苯甲酸重结晶)
实验三重结晶及熔点测定
─苯甲酸重结晶
一、 目的要求
1、理解重结晶提纯法的原理,学习并掌握重结晶法提纯固体有机化合物;
2、掌握热过滤和吸滤操作;
3、了解数字熔点仪的操作方法。
二、基本原理
1、晶体可以通过两种方法得到:
(1)由加热的固体冷却得到,即升华;
(2)由饱和的溶液得到。
后一种则是化学实验室最常用的方法,也是本次实验所采用的方法。
重结晶法是提纯固体有机化合物常用的方法。
2、重结晶法原理:
利用混合物中各组分在某种溶剂中的溶解度不同,或在同一溶剂中不同温度时的溶解度不同,而将它们相互分离。
解释:固体有机物在溶剂中的溶解度与温度有密切关系。当温度升高时溶解度增大,温度降低时溶解度变小。当固体有机物溶解在热的溶剂中形成饱和溶液后冷却,由于溶解度降低,变成过饱和溶液而析出结晶。利用溶剂对被提纯物质及杂质的溶解度不同,可以使不溶的杂质在被提纯物质的饱和溶液中过滤除去,而后被提纯物质从过饱和溶液中析出,溶解的杂质仍留在溶液中,从而达到提纯的目的。
…… …… 余下全文