篇一 :实验一 药用氯化钠的制备
实验一 药用氯化钠的制备 (学时)
一、实验目的
1.通过沉淀反应,了解提纯氯化钠的原理;
2.练习和巩固称量、溶解、沉淀、过滤、蒸发浓缩等基本操作。
二、实验原理
粗食盐中含有不溶性杂质(如泥沙等)和可溶性杂质(主要是Ca2+、Mg2+、K- 和SO42-)。不溶性杂质,可用溶解和过滤的方法除去。可溶性杂质,可用下列方法除去,在粗食盐中加入稍微过量的BaCl2溶液时,即可将SO42- 转化为难溶解的BaSO4沉淀而除去。
Ba2+ + SO42- = BaSO4↓
将溶液过滤,除去BaSO4沉淀,再加入NaOH和Na2CO3溶液,由于发生下列反应:
Mg2+ + 2OH - = Mg(OH)2↓
Ca2+- + CO32- = CaCO3↓
Ba2+ + CO32- = BaCO3↓
食盐溶液中杂质Mg2+-、Ca2+ 以及沉淀SO42- 时加入的过量Ba2+ 便相应转化为难溶的Mg(OH)2、CaCO3、BaCO3沉淀而通过过滤的方法除去。
过量的NaOH和Na2CO3可以用盐酸中和除去。
少量可溶性杂质(如KCl)由于含量很少,在蒸发浓缩和结晶过程中仍留在溶液中,不会和NaCl同时结晶出来。
…… …… 余下全文
篇二 :氯化钠溶液的配置实验报告
实验4:配制100mL1.00 mol/L的NaCl溶液
班级: 姓名:
【实验目的】
1、练习配制一定物质的量浓度的溶液;
2、加深对物质的量浓度概念的理解;
3、练习容量瓶的使用方法
【实验仪器药品】
托盘天平、小烧杯、药匙、100ml容量瓶、胶头滴管、玻璃棒、量筒
【实验药品】
NaCl固体、蒸馏水
【实验步骤】
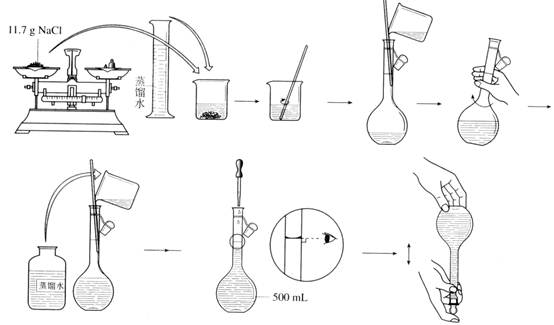
【交流与思考】
1、 容量瓶使用时应注意的事项:
2、 为什么要用蒸馏水来配置溶液而不能用自来水配置呢?
3、 为什么要洗涤玻璃棒和烧杯?如何洗涤?
4、 能否将溶解的NaCl溶液立即注入容量瓶中?为什么?
5、 为什么要将配好的溶液,从容量瓶里倒入试剂瓶?
6、 定容时不慎滴加液体超过刻度线,则该怎么做?
7、 下列实验操作会使所配制的溶液浓度偏高,偏低,还是不变?为什么?
①把溶液向容量瓶中转移,有少量溶液溅出;( ) 原因: ;
…… …… 余下全文
篇三 :粗盐制备分析纯氯化钠实验报告
粗盐制备分析纯氯化钠
一、实验题目:粗盐制备分析纯氯化钠
二、实验目的:1.巩固减压过滤,蒸发、浓缩等基本操作;
2.了解沉淀溶解平衡原理的应用;
3.学习在分离提纯物质过程中,定性检验Ca2+、Mg2+、SO42-等离子是否除尽。
三、实验原理:粗盐中,除含一些不溶性杂志,还含有Ca2+、Mg2+、SO42-和Fe3+等可溶性杂质,不溶性杂质可用过滤法出去,可溶性杂质中Ca2+、Mg2+、SO42-和Fe3+通过过滤的方法除去,然后蒸发水分得到较纯净的精盐。
1.BaCl2—NaOH,Na2CO3法
(1)除SO42-,加入BaCl2溶液
Ba2++SO42-=BaSO4
(2)除Ca2+、Mg2+、和Fe3+和过量的Ba2+,加入NaOH—Na2CO3
Ca2++CO32-=CaCO3 Ba2++CO32-=BaCO3 4Mg2++4CO32-+H2O=Mg(OH)2·3MgCO3
…… …… 余下全文
篇四 :氯化钠的提纯实验报告
山东师范大学化学化工与材料科学学院
实 验 报 告
实验题目 氯化钠的提纯 实验时间 指导教师 成绩
年级__ _专业 班 姓名 学号
[目的要求]
[实验原理]
[主要仪器设备]
[实验步骤]












…… …… 余下全文
篇五 :氯化钠溶液的配置实验报告
实验4:配制100mL1.00 mol/L的NaCl溶液
班级: 姓名:
【实验目的】
1、练习配制一定物质的量浓度的溶液;
2、加深对物质的量浓度概念的理解;
3、练习容量瓶的使用方法
【实验仪器药品】
药匙、小烧杯、 、 、 、玻璃棒、量筒
【实验药品】
NaCl固体、
【实验步骤】
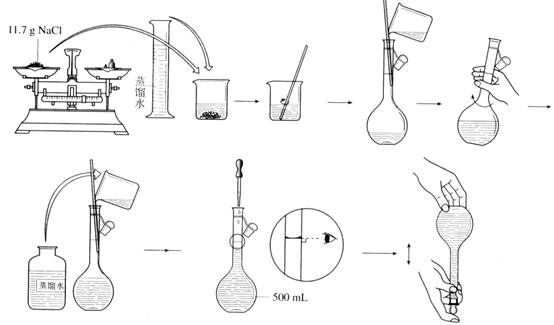
【交流与思考】
1、 容量瓶使用时应注意的事项:
2、 为什么要用蒸馏水来配置溶液而不能用自来水配置呢?
…… …… 余下全文
篇六 :氯化钠溶液的配置实验报告
实验4:配制一定体积1.00 mol/L的NaCl溶液
班级: 姓名:
【实验目的】
1、练习配制一定物质的量浓度的溶液;
2、加深对物质的量浓度概念的理解;
3、练习容量瓶的使用方法
【实验仪器药品】
药匙、小烧杯、 、 、 、玻璃棒、量筒
【实验药品】
NaCl固体、
【实验步骤】
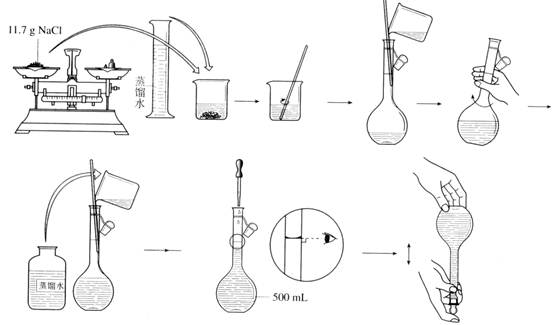
【交流与思考】
1、 为什么要用蒸馏水来配置溶液而不能用自来水配置呢?
2、 能否将溶解的NaCl溶液立即注入容量瓶中?为什么?
…… …… 余下全文
篇七 :实验活动5_一定溶质质量分数的氯化钠溶液的配制实验报告
班级 授课教师 日期 实 验 报 告
一、【实验目的】 二、【实验仪器与药品】
三、【实验步骤】
1、配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠_______g;水__________g。
(2)称量:用_________称量所需的氯化钠,放入____________中。
(3)量取:用___量取所需的水(水的密度可近似看做1g/cm),倒入盛有氯化钠的___中。 3
(4)溶解:用_____搅拌,使氯化钠溶解。
(5)装瓶贴标签:
2、配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.041g/cm),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水分别为:6%的氯化钠溶液____________g(体积__________ml);水__________g。
…… …… 余下全文
