篇一 :氧化还原反应实验报告
实验十二 氧化还原反应
一、实验目的
1. 理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。
2.加深理解氧化态或还原态物质浓度变化对电极电势的影响。
3.进一步理解原电池、电解及电化学腐蚀等基本知识。
[教学重点]
电极电势和氧化还原反应的关系。
[教学难点]
原电池、电解及电化学腐蚀等知识。
[实验用品]
仪器:低压电源、盐桥、伏特计
药品:0.5 mol·L-1Pb(NO3)2、(0.5、1 mol·L-1)CuSO4、0.5 mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·L-1FeCl3、0.1 mol.L-1KBr、0.1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 mol·L-1HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
…… …… 余下全文
篇二 :实验九 氧化还原与电化学
无机实验报告
实验九 氧化还原与电化学
一、电极电势与氧化还原反应方向

结论: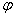 (MnO4/ Mn2+)
(MnO4/ Mn2+) 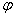 (Fe3/Fe2+)
(Fe3/Fe2+) 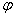 (I2/I-)
(I2/I-) 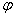 (Sn4+/ Sn2+)
(Sn4+/ Sn2+)
查表:
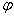 °(MnO4/Mn2+)= ,
°(MnO4/Mn2+)= ,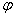 °(Fe3+/Fe2+)= ,
°(Fe3+/Fe2+)= ,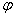 °(I2/I-) ,
°(I2/I-) ,
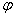 °(Sn4+/Sn2+)= 。与上述实验所得 ,所以氧还方向为 。
°(Sn4+/Sn2+)= 。与上述实验所得 ,所以氧还方向为 。
…… …… 余下全文
篇三 :氧化还原反应和电化学的实验步骤
步骤
1.原电池的组成和电动势的粗略测定:
在一只井穴皿的1.2.3.位置分别倒入约1/2容积的0.1Mol*L-1 CuSO4、ZnSO4、(NH4)2Fe(SO4)2,再分别插入相应的金属片组成电极,若在1.2间插入盐桥则组成铜---锌原电池;在2.3间插入盐桥则组成锌----铁原电池;在1.3间插入盐桥则组成铜----铁原电池。分别用PH计的mv部分去测定其近似的电动势,并与计算值相比较
2.浓度、介质对电动势的影响
(1)浓度对电极电势的影响
在上述实验基础上先往1中滴加2Mol*L-1NH3水至生成沉淀又溶解,在测铜---锌原电池的电动势,并与未加氨水前进行比较有什么变化?为什么?然后往2中滴加2 Mol*L-1氨水至沉淀又溶解,并测定其电势,又有什么变化?为什么?
(2)介质对电极电势的影响
往井穴皿的1孔中加入适量的0.1Mol*L-1Cr2(SO4)3和0.1 Mol*L-1K2Cr2O7溶液至孔穴容积的一半左右,往2孔穴中加入质量分数3%的H2O2溶液至约孔穴容积的1/2左右,再分别插入石墨和盐桥使组成原电池用PH计的mv部分测其电动势并记录.再往Cr2O72-/Cr3+电对中加入几滴3 Mol*L-1H2SO4,并测其电动势,再往Cr2O72-/Cr3+电对中滴入6 Mol*L-1NaOH至生成沉淀又溶解,并测定电动势.试简单解释电动势的变化.
…… …… 余下全文
篇四 :实验17 氧化还原反应和电化学
实验17 氧化还原反应和电化学
一、实验目的
1.了解电极电势与氧化还原反应的关系;
2.试验并掌握浓度和酸度对电极电势的影响。
二、实验原理
原电池是将化学能转变为电能的装置。原电池的电动势可以表示为正极和负极电极电势之差:
ε= E (+)-E (-)
电动势可以用万用电表测量。
氧化剂和还原剂的强弱,可用电对电极电势的大小来衡量。一个电对的标准电极电势Eo值越大,其氧化型的氧化能力就越强,而还原型的还原能力就越弱;若Eo值越小,其氧化型氧化能力越弱,而还原型还原能力越强。根据标准电极电势值可以判断反应进行的方向。在标准状态下反应能够进行的条件是:
εo = Eo(+)-Eo(-) > 0
例如,Eo(Fe3+/ Fe2+) = 0.771 V,Eo(I2/ I-) = 0.535 V,Eo(Br2/ Br -) = 1.08 V
则在标准状态下,电对Fe3+/ Fe2+的氧化型Fe3+可以氧化电对I2/ I-的还原型I-,反应式如下:
2Fe3+ + 2I- ══ 2Fe2+ + I2
而反应电对Fe3+/ Fe2+的氧化型Fe3+可以氧化电对Br2/Br -的还原型Br -,相反的反应则可以进行:
…… …… 余下全文
篇五 :课题_氧化还原反应实验报告
氧化还原反应实验报告
一、实验目的
1.理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。2.加深理解氧化态或还原态物质浓度变化对电极电势的影响。3.进一步理解原电池、电解及电化学腐蚀等基本知识。
[教学重点]电极电势和氧化还原反应的关系。
[教学难点]
原电池、电解及电化学腐蚀等知识。
[实验用品]
仪器:低压电源、盐桥、伏特计
药品:0.5 mol·L-1Pb(NO3)2、(0.5、1mol·L-1)CuSO4、0.5mol·L-1 ZnSO4、
0.1 mol·L-1KI、0.1 mol·L-1FeCl3、0.1 mol.L-1KBr、0.1 mol·L-1FeSO4、(1、3 mol·L-1) H2SO4、6 mol·L-1HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1)KMnO4、6 mol·L-1NaOH、0.1 mol·L-1K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸
…… …… 余下全文
篇六 :氧化还原反应与电化学
氧化还原反应与电化学
一、 实验目的
1. 掌握电极电势对氧化还原反应的影响
2. 了解氧化型或还原型物质浓度、溶液酸度改变对电极电势的影响。
3. 进一步理解氧化还原反应的可逆性
4. 熟练掌握能斯特方程的应用
二、 实验原理
氧化还原过程也就是电子的转移过程。能斯特(Nernst)方程式
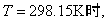
…… …… 余下全文
篇七 :实验九 氧化还原与电化学
氧化还原与电化学
三(一)、电极电势与氧化还原反应方向

结论: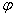 (MnO4/ Mn2+)
(MnO4/ Mn2+) 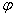 (Fe3/Fe2+)
(Fe3/Fe2+) 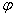 (I2/I-)
(I2/I-) 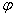 (Sn4+/ Sn2+)
(Sn4+/ Sn2+)
查表:
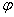 °(MnO4/Mn2+)= ,
°(MnO4/Mn2+)= ,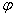 °(Fe3+/Fe2+)= ,
°(Fe3+/Fe2+)= ,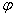 °(I2/I-) ,
°(I2/I-) ,
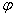 °(Sn4+/Sn2+)= 。与上述实验所得 ,所以氧还方向为 。
°(Sn4+/Sn2+)= 。与上述实验所得 ,所以氧还方向为 。
二酸度对氧化还原反应的影响
…… …… 余下全文
篇八 :公共基础(数理化)_3.4 氧化还原反应与电化学_20xx年版
1、对于化学反应 ,关于
,关于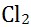 在化学反应中起的作用,下列说话正确的是( )
在化学反应中起的作用,下列说话正确的是( )
A:氧化剂
B:还原剂
C:既是氧化剂有是还原剂
D:催化剂
答案:C
解析:此反应是歧化反应,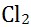 由0价变为-1价和+1价。
由0价变为-1价和+1价。
2、已知下列电对电极电势的大小顺序为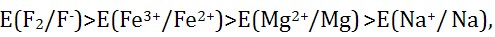 :则下列离子中最强的氧化剂是:
:则下列离子中最强的氧化剂是:
A: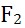
B:
C: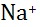
D: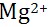
答案:A
解析:电极电势越大,氧化电对中氧化剂氧化性越强。
3、化学反应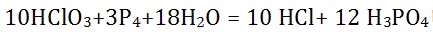 电子转移数是()
电子转移数是()
A:5
B:60
C:30
D:120
答案:B
解析:化学配平如下:
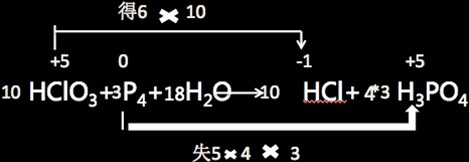
4、氯元素的电极电势图 求
求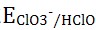 是()
是()
A:1.41v
B:2.82v
C:1.21v
D:1.61v
答案:A
解析:
5、化合物 中Cr元素的氧化数( )
中Cr元素的氧化数( )
A:7
B:6
C:-6
D:3
答案:B
解析:根据化合物各元素化合价的代数和为0,K为正1,O为-2,故 1+2X-2*7=0 X=6
6、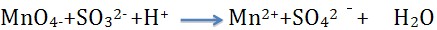 上述方程式配平中,
上述方程式配平中,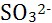 的化学计量数为( )
的化学计量数为( )
A:3
B:5
C:6
D:10
答案:B
解析:方程式配平如下
7、已知电池反应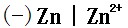
 电动势伏
电动势伏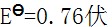 ,则
,则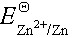 为多少()
为多少()
…… …… 余下全文