篇一 :实验名称 碱性磷酸酶的分离纯化实验报告
实验名称 碱性磷酸酶的分离纯化、比活性测定与动力学分析
实验日期 20##年10月25号 实验地点 生化实验室
合作者 指导老师
总分 教师签名 批改日期
碱性磷酸酶(AKP或ALP)是一种底物特异性较低,在碱性条件下能水解多重磷酸单脂化合物的酶,需要镁和锰离子为激活剂。AKP具有磷酸基团转移活性,能将底物中的磷酸基团转移到另一个含有羟基的接受体上,如磷酸基团的接受体是水,则其作用就是水解。AKP最适PH范围为8.6-10,动物中AKP主要存在于小肠粘膜、肾、骨骼、肝脏和胎盘等组织的细胞膜上。血清AKP主要来自肝,小部分来自骨骼。
…… …… 余下全文
篇二 :实验报告朱正荣
关于碱性磷酸酶的分离纯化与性质研究
生物技术1101班 朱正荣 201131301024
摘要: 为了掌握酶分离纯化的一般步骤及相关原理,熟悉碱性磷酸酶的分离纯化的方法步骤。学会碱性磷酸酶动力学——Km测定方法,掌握碱性磷酸酶最适pH值及酸碱稳定性范围的测定方法。掌握碱性磷酸酶的最适温度及热稳定性范围的测定方法。了解碱性磷酸酶的抑制剂类型。
关键词:碱性磷酸酶;分离纯化;酶工程学
碱性磷酸酶( ALP 或 AKP )是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶。这种酶能催化核酸分子脱掉5’磷酸基团,从而使DNA或RNA片段的5’-P末端转换成5’-OH末端。但它不是单一的酶,而是一组同功酶。目前已发现有 AKP1 、 AKP2 、 AKP3 、 AKP4 、 AKP5 与 AKP6 六种同功酶。其中第 1 、 2 、 6 种均来自肝脏。 碱性磷酸酶是一种底物专一性较低的磷酸单酯酶,广泛存在于人体、动物、植物与微生物中,在生物体内发挥了重要作用[1]。它在脊椎动物的骨化过程中发挥了重要作用[1]。提纯的碱性磷酸酶可用于核酸研究、毒物学研究及医学研究[2]。由于有益于皮肤细胞的再生和新陈代谢,该酶还可添加到药用化妆品中[3]。本文在前人工作的基础上尝试了猪肝碱性磷酸酶的分离纯化,并对其性质进行了探讨。本实验采用有机溶剂沉淀法从肝匀浆中分离纯化碱性磷酸酶。分离纯化碱性磷酸酶后,控制温度和PH及酶浓度恒定的条件下。用Km测定方法测定酶促反应的速度。酶的生物学特征之一就是它们对酸碱度的敏感性,这表现在酶的活性和稳定性易受环境PH的影响。PH对对酶的活性影响极为显著,通常各种酶只有在一定的范围内才表现出活性,同一种酶在不同的PH条件下所表现的活性不同,其表现活性最高的PH值称为酶的最适PH。PH除了对酶的解离状态产生影响外,还可能影响底物的解离和影响反应系统中其他组成成分的解离。PH不仅对酶的活性有很大的影响,而且对酶的稳定性也有很大的影响。因为该酶的化学本质是蛋白质,统蛋白质变性一样,酶在过酸或过碱的条件下也很容易变性失活。对温度的敏感性是酶的又一个重要特性。温度对酶的作用具有双重的影响,一方面与一般的化学反应一样,温度加速酶的反应速度,另一方面该酶是蛋白质,温度加速酶蛋白的变性速度。因此,在较低的温度范围内,酶反应的速度随温度的升高而增大,但超过一定温度后,反应速度反而下降。酶反应速度达到最大值是时的温度的温度称为酶反应的最适温度。由于酶受热后易变性失活,因此各种酶对热都有一个稳定的范围。酶的种类和来源不同,对热的稳定性也不同,就需要通过热稳定性实验测出热稳定范围。抑制剂是引起酶促反应速度降低的一类物质的统称,它与酶的活性部位结合,改变了没活性部位的结构或性质,从而引起酶活力的下降,这里不包括酶蛋白的水解或变性等情况。
…… …… 余下全文
篇三 :碱性磷酸酶米氏常数的测定
碱性磷酸酶米氏常数的测定
【实验目的】通过碱性磷酸酶(alkaline phosphatase,AKP)米氏常数的测定,了解其测定方法和意义。学会运用标准曲线测定酶的活性及观察抑制剂对酶促反应动力学的影响,加深对酶促反应动力学的理解。
【实验原理】本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。 酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。根据吸光值的大小可以计算出酶的活性,也可以从标准曲线上查知酚的含量,进而算出酶活性的大小。
【实验步骤】1. 底物浓度对酶促反应速度的影响
(1) 取6支试管,作好标记。按下表操作:(未加抑制剂组)
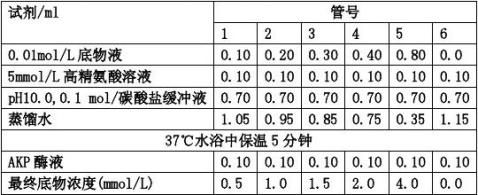
(2) 加入酶液(0.05μg/ml)后,各管混匀并立即记录时间,将上述各管置37℃水浴中准确保
温
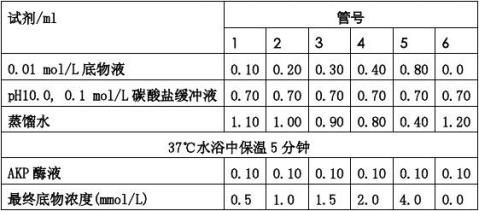
15分钟。
(3) 保温结束,立即加碱性溶液1.1 ml终止反应。
(4) 各管分别加入0.3% 4-氨基安替比林1.0 ml,0.5%铁氰化钾2.0 ml,充分混匀,放置
10分钟,以6号空白管作对照,于510 nm波长处比色,根据酚标准曲线计算酶活性。
…… …… 余下全文
篇四 :碱性磷酸酶测定
碱性磷酸酶测定
一、 试剂配制
1、 甲苯
2、 pH9.8氯化铵-氢氧化铵缓冲液:称取20g纯氯化铵,溶于
少量水(我配200ml,用一百多毫升水溶40g氯化铵),然后加入浓氨水润洗烧杯和定容至100ml,用pH试纸测pH,pH为10即可,不用刻意调pH。(氨水很臭,需要带口罩在通风橱配)
3、 8%铁氰化钾溶液(只能用一周,放冰箱保存):取8g铁氰
化钾,用水定容至100ml。
4、 2%4-氨基安替比林(只能用一周,放冰箱保存):取2g4-
氨基安替比林,用水定容至100ml。
5、 0.5%磷酸苯二钠溶液(用pH9.4硼酸缓冲液配)
(1)先配制pH9.4硼酸盐缓冲液:称取4.768g硼砂(十水合四硼酸钠)和0.44g纯氢氧化钠,用蒸馏水定容至1000ml。(硼砂需要用电炉加热配制,硼砂用称量纸称量,氢氧化钠需要用烧杯称量,基本不用配pH,pH试纸测为9)
(2)称取5.05g磷酸苯二钠,用pH9.4硼酸缓冲液定容至1000ml。
6、 酚标准溶液:
酚溶液:称取1g苯酚用水溶至1L,保存于暗色瓶中。(苯酚还是需要水浴加热,详细配法看脲酶测定,但由于1g很难准确称量,
…… …… 余下全文
篇五 :碱性磷酸酶报告
北京师范大学珠海分校
实验报告
碱性磷酸酶的提取及其比活性测定
小组成员: 林树程
温慧敏
朱崇华
巫鹏辉
指导教师: 许华
2012-11-1
1
碱性磷酸酶的提取及其比活性测定
一、实验目的
1、 掌握以有机溶剂分离技术提取蛋白质及酶的原理和方法;
2、掌握酶蛋白纯化过程中的活性、比活性、得率及纯化倍数的概念及计算;
3、了解AKP的临床意义及纯化蛋白质的一般方法。
二、实验原理
本实验采取有机溶剂沉淀法从猪肝匀浆液中提取分离碱性磷酸酶(AKP)。正丁醇能使部分杂蛋白变性,过滤除去杂蛋白即为含有AKP的滤液,AKP能溶于终浓度为33%的丙酮或30%的乙醇中,而不溶于终浓度为50%的丙酮或60%的乙醇中,通过离心即可得到初步纯化的AKP。
根据国际酶学委员会规定,酶的比活性(specific activity)用每mg蛋白质具有的酶活性单位(u/mg·pr)来表示。因此,测定样品的比活性必须测定:(1)每ml样品中的蛋白质mg数(mg/m1); (2)每ml样品中的酶活性单位数(u/ml)。酶的纯度越高酶的比活性也就越高。
本实验以磷酸苯二钠为底物,由碱性磷酸酶催化水解,生成游离酚和磷酸盐。酚在碱性条件下与4-氨基安替比林作用,经铁氰化钾氧化,生成红色的醌衍生物,颜色深浅和酚的含量成正比。于510nm处比色,即可求出反应过程中产生的酚含量,而碱性磷酸酶的活性单位(King-Armstrong法)可定义为:在37℃保温15min每产生lmg的酚为一个酶活性单位(U)。
…… …… 余下全文
篇六 :酶工程实验报告五(纤维素酶米氏常数—Km的测定)

本科学生实验报告[n1]
学号 104120440 姓名 孙永升
学院 生命科学学院 专业、班级 10生物技术
实验课程名称 酶 工 程 < 实验 >
教师及职称 李俊俊 < 讲师 >
开课学期 20## 至 2013 学年 第二学期
…… …… 余下全文
篇七 :碱性磷酸酶米氏常数的测定
碱性磷酸酶米氏常数的测定
[目的与要求]
通过碱性磷酸酶米氏常数的测定,了解其测定方法及意义。学会运用标准曲线测定酶的活性,加深对酶促反应动力学的理解。
[原理]
在环境的温度、pH和酶的浓度一定时。酶促反应速度与底物浓度之间的关系表现在反应开始时。酶促反应的速度(V)随底物浓度(S)的增加而迅速增加。若继续增加底物浓度,反应速度的增加率将减少。当底物浓度增加到某种程度时,反应速度会达到一个极限值,即最大反应速度(Vmax),如图37所示。
底物浓度与酶促反应速度的这种关系可用Michaelis-Menten方程式表示。
V = Vmax[S]/(Km+[S])
上式中Vmax为最大反应速度,[S]为底物浓度,Km为米氏常数(Michaelis constant),而其中V则表示反应的起始速度。当V= Vmax/2时,Km =[S]。所以米氏常数是反应速度等于最大反应速度一半时底物的浓度。因此Km的单位以摩尔浓度(mol/L)表示。
…… …… 余下全文
篇八 :测量数据处理实验报告


院系____________________
班级____________________
姓名____________________
学号____________________
目 录(页码根据自己需要填写)
一、实验项目须知.....................................
二、实验一 秩亏自由网上机实验........................
三、实验二 极大验后滤波、推估上机实验...............
…… …… 余下全文