篇一 :化学反应焓变的测定实验报告正文
化学反应焓变的测定
摘要:化学反应都伴随着能量的转移,而焓变就是能量转移的重要表现形式。因此,化学反应焓变的测定就成为我们学习化学知识、掌握化学反应原理、控制反应进行程度的重要手段。本次实验利用常见的保温杯等装置简易测定了Zn与CuSO4的化学反应焓变。结果表明:该实验测量效果好,操作简洁,易于观察实验现象
关键词:焓变;测定;Zn;CuSO4;保温杯;温度计
化学反应焓变的测定
化学反应过程中,除了发生物质的变化外,常伴有能量的变化,这种能量变化表现为反应热效率,而恒压条件下的反应热效应叫做等压热效应。在标准状态下的焓变成为化学反应的标准焓变。本实验采用普通保温杯和精密温度计作为简易量热计来测量。
在298.15K和标准条件下,1mol锌置换硫酸铜中的铜离子,放出218.7J的热量。
Zn+CuSO4=ZnSO4+Cu △rHm=-218.7KJ/mol
有溶液反应前后的温度变化,可求得上述反应的焓变。
考虑到热量计的热容,则反应放出的热量Qp等于系统中溶液吸收的热量与热量计吸收的热量之和:Qp=(c.m+Cp) △T
c--------溶液的比热容(取4.18)
m--------溶液的质量(近似等于溶剂的质量)
…… …… 余下全文
篇二 :化学反应摩尔焓变的测定
目录
实验一 化学反应摩尔焓变的测定………………………………………………1
实验二 氧化还原反应与电化学…………………………………………………9
实验三 醋酸解离度和解离常数的测定…………………………………………18
实验四 自来水硬度的测定………………………………………………………23
实验五 聚乙烯醇甲醛反应制备胶水……………………………………………27
实验一 化学反应摩尔焓变的测定
一、实验目的
1.了解测定反应的摩尔焓变的原理和方法;
2.学习称量、溶液配制和移取的基本操作;
3.学习实验数据的作图法处理。
二、实验原理
 化学反应通常是在恒压条件下进行的,反应的热效应一般指的就是恒压热效应qp 。化学热力学中反应的摩尔焓变
化学反应通常是在恒压条件下进行的,反应的热效应一般指的就是恒压热效应qp 。化学热力学中反应的摩尔焓变 rHm数值上等于qp,因此,通常可用量热的方法测定反应的摩尔焓变。对于一般溶液反应(放热反应)的摩尔焓变,可用简易量热计测定。该量热器采用玻璃保温杯制成,并附有数显温度计(可精确读至0.10C),以电磁搅拌来混合溶液。
rHm数值上等于qp,因此,通常可用量热的方法测定反应的摩尔焓变。对于一般溶液反应(放热反应)的摩尔焓变,可用简易量热计测定。该量热器采用玻璃保温杯制成,并附有数显温度计(可精确读至0.10C),以电磁搅拌来混合溶液。
本实验测定CUSO4溶液与锌粉反应的摩尔
焓变:
CU2+(aq)+Zn(s)=Cu(s)+Zn2+(aq)
…… …… 余下全文
篇三 :化学反应摩尔焓变的测定
化学反应摩尔焓变的测定
【实验目的】
(1) 了解测定化学反应焓变的原理和方法;
(2) 巩固电子(电光分析)天平的正确使用和容量瓶、移液管的正确使用,巩
固准确浓度溶液的配制;
(3) 学习用作图外推法处理实验数据。
【实验原理】
化学反应总是伴随着能量变化。若在恒压不做非体积功条件下,化学反应的热效应成为等压热效应。在化学热力学中用焓变ΔrHm来表示。放热反应的ΔrHm为负值,吸热反应ΔrHm为正值。
测定反应热效应的实验方法很多。本实验是在绝热条件下使反应物在简易量热计中反应。量热计中溶液温度升高的同时也使量热计的温度相应提高。 本实验中锌粉和硫酸铜溶液的反应,说明热效应的测定过程为:
Zn+CuSO4→ZnSO4+Cu
该反应是放热反应。测定时,先在量热计中放入稍过量的锌粉和已知浓度和体积的硫酸铜溶液。随着反应的进行,不时地记录溶液温度变化。当温度不再升高,并且开始下降时,说明反应结束。
使用量热计测定反应热效应,首先要知道量热计的热容,即量热计温度升高1K所需要的热量。因为在量热计中进行的化学反应所产生的热量,可以使量热计的温度升高,所以在测定反应焓变之前必须先确定所用量热计的热容,否则ΔrHm测定值会偏低。因此在恒压下反应产生的热效应或焓变,应为:
…… …… 余下全文
篇四 :化学反应摩尔焓变的测定
第五章 常用仪器介绍与化学常数的测定
常用仪器介绍
一、温度计
1.分类
具有与温度密切相关且能严格复现物理性质的物质,都可以设计并制成各类测温仪器,即温度计。
温度计通常分为接触式和非接触式两大类。接触式温度计与被测物质直接接触,当二者达热平衡时,温度相等。这样通过温度计中测温物质的某种性质变化就可以表示出温度。这类温度计很多,如最常见的水银温度计,还有热电偶,电阻温度计等;非接触式温度计与被测物质不直接接触,而是利用被测物质所发射的电磁辐射,根据其波长分布或强度和温度之间的关系来测定温度。
2.水银温度计的校正
水银温度计是实验室中最常用的液体温度计,水银具有热导率大,比热容小,膨胀系数均匀,在相当大的温度范围内,体积随着温度的变化呈直线关系,同时不润湿玻璃、不透明而便于读数等优点,因而水银温度计是一种结构简单、使用方便、测量较准确并且测量范围大的温度计。
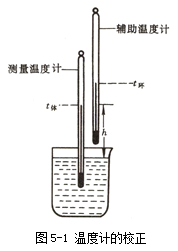 然而,当温度计受热后,水银球体积会有暂时的改变而需要较长时间才能恢复原来体积。由于玻璃毛细管很细,因而水银球体积的微小改变都会引起读数的较大误差。对于长期使用的温度计,玻璃毛细管也会发生变形而导致刻度不准。另外温度计有全浸式和半浸式两种,全浸式温度计的刻度是在温度计的水银柱全部均匀受热的情况下刻出来的,但在测量时,往往是仅有部分水银柱受热,因而露出的水银柱温度就较全部受热时低。这些在准确测量中都应予以校正。
然而,当温度计受热后,水银球体积会有暂时的改变而需要较长时间才能恢复原来体积。由于玻璃毛细管很细,因而水银球体积的微小改变都会引起读数的较大误差。对于长期使用的温度计,玻璃毛细管也会发生变形而导致刻度不准。另外温度计有全浸式和半浸式两种,全浸式温度计的刻度是在温度计的水银柱全部均匀受热的情况下刻出来的,但在测量时,往往是仅有部分水银柱受热,因而露出的水银柱温度就较全部受热时低。这些在准确测量中都应予以校正。
…… …… 余下全文
篇五 :物理化学实验报告 - 凝固点降低法测定摩尔质量
C6 凝固点降低法测定摩尔质量
——实验日期:年月日
姓名: 学号: 班级:
一、 实验目的
(一)用凝固点降低法测定萘的摩尔质量。
(二)掌握精密电子温差仪的使用方法。
二、 原理及实验公式
非挥发性溶质二组分溶液,其稀溶液具有依数性,凝固点降低就是依数性的一种表现。根据凝固点降低的数值,可以求出溶质的摩尔质量。
在溶剂中加入溶质时,溶液的凝固点比纯溶剂的凝固点低,其凝固点降低值Δ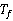 与溶质的质量摩尔浓度
与溶质的质量摩尔浓度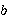 成正比。
成正比。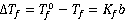
式中,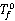 为纯溶剂的凝固点;
为纯溶剂的凝固点;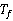 为浓度为
为浓度为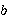 的溶液的凝固点;
的溶液的凝固点;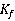 为溶剂的凝固点降低常数。
为溶剂的凝固点降低常数。
若已知某种溶剂的凝固点降低常数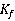 ,并测得溶剂和溶质的质量分别为
,并测得溶剂和溶质的质量分别为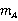 和
和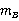 的稀溶液的凝固点降低值Δ
的稀溶液的凝固点降低值Δ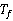 ,则可以通过下式计算溶质的摩尔质量
,则可以通过下式计算溶质的摩尔质量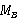 。
。
式中,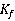 的单位为
的单位为 。
。
三、 凝固点的确定方法
(一)纯溶剂的凝固点确定方法
纯溶剂的凝固点为其液相和固相共存的平衡温度。若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降。开始凝固后因放出凝固热而补偿了热损失,体系将保持液-固两相共存的平衡温度而不变,直到全部凝固,温度再继续下降。冷却曲线如图1中1所示。
…… …… 余下全文
篇六 :化学反应摩尔焓变的测定
实验二 化学反应摩尔焓变的测定
一、实验目的
1.了解化学反应焓变或反应热效应测定的原理和方法。
2.学习用作图外推的方法处理实验数据。
3.练习准确浓度溶液配制的基本操作。
二、教学形式
1.讲解与提问
(1)用量热计测定化学反应焓变或反应热效应的简单原理和方法。
(2)试验中所用的锌粉为什么可用台秤称量,而所需CuSO4·5H2O却要在分析天平上称 取?所用的锌粉为什么要过量?
(3)怎样用减量法称取CuSO4·5H2O试样?如何配制250mL约0.2000mol/LCuSO4溶液?
(4)移液管和容量瓶的使用
(5)本实验成败的关键是什么?
2.基本操作与实验技能示范
(1)量热计装置的要求:
以盖上盖后能搅拌自如,温度计插至量热计较深处而不与量热计底及搅拌器相碰。
(2)讲解测定过程及作图法外推求ΔT值的方法及其必要性。
(3)介绍移液管的使用和溶液的配制方法。
3.注意事项与可能发生的问题
(1)测定所用的量热器必须洁净干燥,若有水珠可用滤纸擦干。
(2)溶解CuSO4·5H2O需用小烧杯,每次加水需少量多次。
(3)用移液管移取CuSO4溶液前,需先洗净移液管,并用所配制的CuSO4溶液洗涤3次,方可移液,并要将溶液倒入小烧杯中移液。以免因水带入而使CuSO4溶液的浓度变小,引起测定误差。
…… …… 余下全文
篇七 :化学反应焓变的测定
实验十四化学反应焓变的测定
一、教学要求:
1. 了解测定化学反应焓变的原理和方法;
2. 熟悉台秤、温度计和秒表的正确使用;
3. 学习数据测量,记录、整理,计算等方法;
二、预习内容
1. 复习《无机及分析化学》有关热力学部分的知识要点;
2. 锌与硫酸铜的置换反应;
3. 常用仪器 :台天平、电子天平、温度计以及容量瓶的使用方法;
三、基本操作
1. 台天平以及电子天平的使用;
2. 温度计及秒表的使用;
…… …… 余下全文
篇八 :燃烧热的测定实验报告 20xx.11.9
华南师范大学实验报告
一、实验目的
1.明确燃烧热的定义,了解恒压燃烧热和恒容燃烧热的差别和联系;
2.掌握量热技术的基本原理,学会测定萘的燃烧热;
3.了解氧弹卡计主要部件的作用,掌握卡计的实验技术;
4.学会用雷诺图解法校正温度变化。
二、实验原理
燃烧热是指1摩尔物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热称为恒容燃烧热(Qv),恒容燃烧热这个过程的内能变化(ΔU)。在恒压条件下测得的燃烧热称为恒压燃烧热(Qp),恒压燃烧热等于这个过程的热焓变化(ΔH)。若把参加反应的气体和反应生成的气体作为理想气体处理,则有下列关系式:undefinedcHm = Qp=Qv +ΔnRT。
量热反应测量的基本原理为能量守恒定律。热是一个很难测定的物理量,热量的传递往往表现为温度的改变,而温度却很容易测量。本实验采用氧弹热量计为测量仪器。氧弹是一个特制的不锈钢容器,为了保证样品完全燃烧,氧弹中应充以高压氧气(或者其他氧化剂),还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而几乎不与周围环境发生热交换。
在盛有定水的容器中,样品物质的量为n摩尔,放入密闭氧弹充氧,使样品完全燃烧,放出的热量传给水及仪器各部件,引起温度上升。设系统(包括内水桶,氧弹本身、测温器件、搅拌器和水)的总热容为C(通常称为仪器的水当量,即量热计及水每升高1K所需吸收的热量),假设系统与环境之间没有热交换,燃烧前、后的温度分别为T1、T2,则此样品的恒容摩尔燃烧热为:
…… …… 余下全文