篇一 :电导法测定乙酸电离平衡常数 实验报告
物理化学实验报告
姓名:何思思
班级:工艺五班
学号:10031010526
教师:李慎新
学院:材料化学与工程学院
电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二、 实验原理
1、 电离平衡常数Kc的测定原理:
α=∧m/∧m∞
CH3COOH —→ CH3COO- + H
开始 C 0 0
平衡 C(1-α) Cα Cα
…… …… 余下全文
篇二 :《水溶液中的解离平衡》实验报告
二、 实验步骤
(一)同离子效应
1、取两只小试管,0.1mol/LHAc溶液及1滴甲基橙,混合均匀,溶液呈红色。在一试管中加入少量NaAc(s),观察指示剂颜色变化 指示剂变黄。
HA c = H+ + Ac-
NaAc = Na+ + Ac—
2、取两只小试管,各加入5滴0.1mol/LMgCl2溶液,在其中以支试管中再加入5滴饱和NH4Cl溶液,然后分别在这两支试管中加入5滴2mol/LNH3·H2O,观察两试管发生的现象有何不同?何故?
MgCl2 = Mg2+ + 2Cl-
Mg2+ + 2OH— = Mg(OH)2↓
NH4Cl解离出的Cl-使 MgCl2解离平衡向左移动减小了溶液中Mg2+的浓度,因而在入5滴饱和NH4Cl溶液,然后在这支试管中加入5滴2mol/LNH3·H2O无白色沉淀生成。
(二)缓冲溶液的配制
1、用1mol/LHAc溶液和1mol/LNaAc溶液配置pH=4.0的缓冲溶液10mL.应该如何配制?配好后,用pH试纸测定其pH值,检验其是否符合要求.
PH = pKa + lgCAc-/CHAc
…… …… 余下全文
篇三 :四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六 电导法测定乙酸电离平衡常数
报告人:曾辉 实验时间20##年03月07日
一.实验目的:
1.掌握电导、电导率、摩尔电导率的概念以及它们之间的相互关系。
3.掌握电导法测定弱电解质电离平衡常数的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为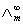 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率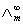 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
 (1)
(1)
…… …… 余下全文
篇四 :甲基红电离平衡常数测定实验预习报告

第一部分:实验预习报告
1. 实验目的(要求)
测定弱电解质电离平衡常数
了解指示剂变色反应原理
学习使用721型(或VIS-7220型)分光光度计及pHS-3C酸度计
2. 实验原理(概要)
甲基红是一种酸碱指示剂。它是一种弱酸,在一定pH值条件下,可发生电离,在乙醇水溶液中点力度很小。甲基红(HMR)醌式分子显红色,电离后的偶氮式阴离子( MR¯ )显黄色。
甲基红的电离平衡常数 为:
为:
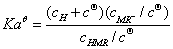
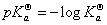
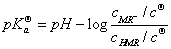
根据朗伯-比尔定律,溶液对单色光的吸收遵守下列关系式: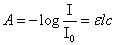
A为吸光度, 为透光率,
为透光率, 为摩尔吸光系数,l为被测溶液厚度,c为浓度。令
为摩尔吸光系数,l为被测溶液厚度,c为浓度。令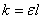
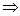
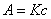 即被测溶液的吸光度与其浓度成正比。
即被测溶液的吸光度与其浓度成正比。
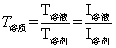
a. 若两种溶质的特征波长相差较大,被测溶质的吸收光谱图不重叠
b. 若两种被测溶质的吸收光谱图重叠,而且遵守朗伯-比尔定律,则用线性组合的关系式可求出两种被测组分的浓度。

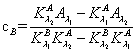
3. 实验操作过程概述:
1溶液制备。
甲基红标准液:80mg甲基红晶体分次以600mL乙醇溶解移入1000mL容量瓶中
…… …… 余下全文
篇五 :无机化学实验十一 电离平衡和沉淀反应
实验十一 电离平衡和沉淀反应
一、实验目的
1.了解同离子效应对弱电解质电离平衡的影响; 2.学习缓冲溶液的配制并了解其缓冲作用; 3.加深理解盐类的水解规律和容度积规则的应用; 4.练习离心机的使用。 [教学重点]
同离子效应,缓冲溶液的缓冲作用 [教学难点]
容度积规则的应用 [实验用品]
仪器:试管、离心试管、离心机、表面皿、温度计
药品:SbCl3(s)、NH4Ac(s)、Fe(NO3)3(s)、HNO3(6 mol·L-1)、HCl(0.2、6 mol·L-1)、0.2 mol·L-1HAc、
NaOH(0.2、2 mol·L-1)、NH3.H2O(0.2、6 mol·L-1)、PbI2(饱和)、KI(0.01、0.1 mol·L-1)、Pb(NO3)2(0.01、0.1 mol·L-1)、NaAc(0.2 mol·L-1)、NH4Cl(0.1 mol·L-1)、NH4Ac(0.1 mol·L-1)、NaCl(0.1、1.0 mol·L-1)、NaH2PO4(0.1 mol·L-1)、NaH2PO4(0.1 mol·L-1)、Na2HPO4(0.1 mol·L-1)、Na3PO4(0.1 mol·L-1)、K2CrO4(0.05、0.5 mol·L-1)、AgNO3(0.1 mol·L-1)、BaCl2(0.5 mol·L-1)、(NH4)2C2O4(饱和)、Na2S(0.1 mol·L-1)、Na2SO4(饱和)
…… …… 余下全文
篇六 :采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告
一、 实验目的
1、 了解一种测定弱电解质电离常数的方法。
2、 掌握分光光度计的测试原理和使用方法。
3、 进一步熟练掌握pH的原理和使用方法。
二、 实验原理
根据朗伯-比耳定律,溶液对单色光的吸收,遵守下列关系式:
 ①
①
式中,A为吸光度; I/I0为透光率T;k为摩尔吸光系数它是溶液的特性常数;C为溶液浓度;l为溶液的厚度。
…… …… 余下全文
篇七 :20xx年山东省大学生实验能竞赛 物理化学实验 弱电解质溶液电离平衡常数的测定
物理化学实验
实验一(2)、弱电解质溶液电离平衡常数的测定

说明:
1、本实验竞赛时间为 180 分钟(以选手在实验报告首页确认编号和监考教师签名为准),其中实验操作120分钟,数据处理60分钟。 每超时10分钟扣5分,最多不得超过20分钟;
2、实验设计要求从实验开始起20分钟内完成并交监考教师审阅。如果实验设计需监考老师部分指导,可提出申请,但需扣除相应的分数;
3、如果无法完成实验设计,可以由监考老师提供,但实验设计部分分数将被扣去;
4、请注意合理运筹时间。如在等待过程中,可进行后续实验准备或思考问答题等;
5、提供给每位选手的试剂已足够,请注意用量。不必要的过量使用将被扣分;
6、请认真阅读仪器使用说明并仔细操作。损坏仪器、打破玻璃器皿将被扣分。
7、实验完成后,请将所有玻璃仪器清洗干净,仪器设备归零、关闭电源。保持台面干净整洁,恢复原状。否则将被扣分;
8、本实验提供计算机及绘图软件(Origin, Excel)、毫米方格纸、直尺、铅笔、签字笔,供选用。
实验试题:
氨水溶液电离平衡常数的测定
实验原理:

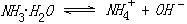
AB型弱电解质在溶液中电离达到平衡时,电离平衡常数KC与原始浓度C和电离度α有以下关系:
…… …… 余下全文
篇八 :实验六 电导法测定乙酸电离平衡 常数
实验六 电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为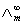 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率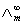 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
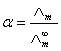 (1)
(1)
…… …… 余下全文