篇一 :配合物的生成和性质
配合物的生成和性质
一、实验目的
1、比较并解释配离子的稳定性;
2、了解配位离解平衡与其它平衡之间的关系;
3. 了解配合物的一些应用。
二. 实验原理
中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体。配位个体处于配合物的内界。若带有电荷就称为配离子,带正电荷称为配阳离子,带负电荷称为配阴离子。配离子与带有相同数目的相反电荷的离子(外界)组成配位化合物,简称配合物。
简单金属离子在形成配离子后,其颜色,酸碱性,溶解性及氧化还原性都会变化。
配离子之间也可转化,又一种配离子转化为另一种稳定的配离子。
具有环状结构的配合物称为螯合物,螯合物的稳定性更大,且具有特征颜色。
三. 实验内容
1. 简单离子与配离子的区别
铁氰化钾 K3[Fe(CN)6]加SCN-无血红色
Fe3+ + nSCN- = [Fe(NCS)n]3-n有血红色
…… …… 余下全文
篇二 :配合物的生成和性质.新doc
实验6 配合物的生成与性质
一、实验目的
1、了解有关配合物的生成与性质。
2、熟悉不稳定常数和稳定常数的意义。
3、了解利用配合物的掩蔽效应鉴别离子的方法。
二、实验原理
中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体。配位个体处于配合物的内界。若带有电荷就称为配离子,带正电荷称为配阳离子,带负电荷称为配阴离子。配离子与带有相同数目的相反电荷的离子(外界)组成配位化合物,简称配合物。
简单金属离子在形成配离子后,其颜色,酸碱性,溶解性及氧化还原性等往往和原物质有很大的差别。配离子之间也可转化,一种配离子转化为另一种稳定的配离子。
具有环状结构的配合物称为螯合物,螯合物的稳定性更大,且具有特征颜色。利用此类鳌合物的形成作为某些金属离子的特征反应而定性、定量地检验金属离子的存在。
仪器与试剂
H2SO4 (2mol.L-1)
三、实验内容
1.配合物的生成
(1) CuSO4 溶液中滴加NH3·H2O,先产生蓝色沉淀,继续滴加,蓝色沉淀溶解得一深蓝色溶液:
Cu2+ + SO42- + 2NH3 =2NH4++Cu2(OH)2SO4↓
…… …… 余下全文
篇三 :实验四 配合物的生成和性质(免费)
实验四 配合物的生成和性质
1. 简单离子与配离子的区别
铁氰化钾 K3[Fe(CN)6]加SCN-无血红色
Fe3+ + nSCN- = [Fe(NCS)n]3-n有血红色
结论:FeCl3为离子型简单化合物,在水中可解离出大量的Fe3+,K3[Fe(CN)6]为配合物,配离子[Fe(CN)6]3-比较稳定,难以解离出大量的Fe3+。
2. 配离子稳定性的比较
(1) Fe3+ + n SCN- = [Fe(NCS)n]3-n(有血红色)
[Fe(NCS)n]3-n+ (C2O4)22- → [Fe(C2O4)3]3- +SCN-
稳定性 [Fe(C2O4)3]3->[Fe(NCS)n]3-n
(2)AgNO3+ NaCl →AgCl ↓(白) + NH3 H2O→ [Ag(NH3)2]+
[Ag(NH3)2]++ KBr →AgBr↓(淡黄色),
再滴加Na2S2O3溶液→ 沉淀溶解[Ag(S2O3)2]3-,滴加KI溶液→AgI↓
…… …… 余下全文
篇四 :配合物的生成和性质
实验6 配合物的生成与性质
一、实验目的
1、了解有关配合物的生成与性质。
2、熟悉不稳定常数和稳定常数的意义。
3、了解利用配合物的掩蔽效应鉴别离子的方法。
二、实验原理
中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体。配位个体处于配合物的内界。若带有电荷就称为配离子,带正电荷称为配阳离子,带负电荷称为配阴离子。配离子与带有相同数目的相反电荷的离子(外界)组成配位化合物,简称配合物。
简单金属离子在形成配离子后,其颜色,酸碱性,溶解性及氧化还原性等往往和原物质有很大的差别。配离子之间也可转化,一种配离子转化为另一种稳定的配离子。
具有环状结构的配合物称为螯合物,螯合物的稳定性更大,且具有特征颜色。利用此类鳌合物的形成作为某些金属离子的特征反应而定性、定量地检验金属离子的存在。
三、实验内容
1.配合物的生成
(1) CuSO4 溶液中滴加NH3·H2O,先产生蓝色沉淀,继续滴加,蓝色沉淀溶解得一深蓝色溶液:
Cu2+ + SO42- + 2NH3 =2NH4++Cu2(OH)2SO4↓
…… …… 余下全文
篇五 :实验十一 配合物的生成、性质与应用
实验十一 配合物的生成、性质和应用
一、实验目的
1.了解配合物的生成和组成。
2.了解配合物与简单化合物的区别。
3.了解配位平衡及其影响因素。
4.了解螯合物的形成条件及稳定性。
二、实验原理
由中心离子(或原子)与配体按一定组成和空间构型以配位键结合所形成的化合物称配合物。配位反应是分步进行的可逆反应,每一步反应都存在着配位平衡。
M + nR 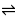 MRn
MRn 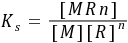 配合物的稳定性可由K稳 (即Ks)表示,数值越大配合物越稳定。增加配体(R)或金属离子(M)浓度有利于配合物(MRn)的形成,而降低配体和金属离子的浓度则有利于配合物的解离。如溶液酸碱性的改变,可能引起配体的酸效应或金属离子的水解等,就会导致配合物的解离;若有沉淀剂能与中心离子形成沉淀的反应发生,引起中心离子浓度的减少,也会使配位平衡朝离解的方向移动;若加入另一种配体,能与中心离子形成稳定性更好的配合物,则同样导致配合物的稳定性降低。若沉淀平衡中有配位反应发生,则有利于沉淀溶解。配位平衡与沉淀平衡的关系总是朝着生成更难解离或更难溶解物质的方向移动。
配合物的稳定性可由K稳 (即Ks)表示,数值越大配合物越稳定。增加配体(R)或金属离子(M)浓度有利于配合物(MRn)的形成,而降低配体和金属离子的浓度则有利于配合物的解离。如溶液酸碱性的改变,可能引起配体的酸效应或金属离子的水解等,就会导致配合物的解离;若有沉淀剂能与中心离子形成沉淀的反应发生,引起中心离子浓度的减少,也会使配位平衡朝离解的方向移动;若加入另一种配体,能与中心离子形成稳定性更好的配合物,则同样导致配合物的稳定性降低。若沉淀平衡中有配位反应发生,则有利于沉淀溶解。配位平衡与沉淀平衡的关系总是朝着生成更难解离或更难溶解物质的方向移动。
配位反应应用广泛,如利用金属离子生成配离子后的颜色、溶解度、氧化还原性等一系列性质的改变,进行离子鉴定、干扰离子的掩蔽反应等。
…… …… 余下全文
篇六 :配合物的生成和性质
实验四 配合物的生成和性质
一、实验目的
1、比较并解释配离子的稳定性;
2、了解配位离解平衡与其它平衡之间的关系;
3. 了解配合物的一些应用。
二. 实验原理
中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体。配位个体处于配合物的内界。若带有电荷就称为配离子,带正电荷称为配阳离子,带负电荷称为配阴离子。配离子与带有相同数目的相反电荷的离子(外界)组成配位化合物,简称配合物。
简单金属离子在形成配离子后,其颜色,酸碱性,溶解性及氧化还原性都会变化。
配离子之间也可转化,又一种配离子转化为另一种稳定的配离子。
具有环状结构的配合物称为螯合物,螯合物的稳定性更大,且具有特征颜色。
三. 实验内容
1. 简单离子与配离子的区别
铁氰化钾 K3[Fe(CN)6]加SCN-无血红色
Fe3+ + nSCN- = [Fe(NCS)n]3-n有血红色
…… …… 余下全文
篇七 :实验三_配合物的生成、性质与应用
实验三 配合物的生成、性质和应用
一、实验目的
1.了解配合物的生成和组成。
2.了解配合物与简单化合物合复盐的区别。
3.了解配位平衡及其影响因素。
4.了解螯合物的形成条件及稳定性。
5.熟悉过滤盒试管的使用等基本操作。
二、实验原理
由中心离子(或原子)与配体按一定组成和空间构型以配位键结合所形成的化合物称配合物。配位反应是分步进行的可逆反应,每一步反应都存在着配位平衡。
M + nR  MRn
MRn 
配合物的稳定性可由K稳 (即Ks)表示,数值越大配合物越稳定。增加配体(R)或金属离子(M)浓度有利于配合物(MRn)的形成,而降低配体和金属离子的浓度则有利于配合物的解离。如溶液酸碱性的改变,可能引起配体的酸效应或金属离子的水解等,就会导致配合物的解离;若有沉淀剂能与中心离子形成沉淀的反应发生,引起中心离子浓度的减少,也会使配位平衡朝离解的方向移动;若加入另一种配体,能与中心离子形成稳定性更好的配合物,则同样导致配合物的稳定性降低。若沉淀平衡中有配位反应发生,则有利于沉淀溶解。配位平衡与沉淀平衡的关系总是朝着生成更难解离或更难溶解物质的方向移动。
…… …… 余下全文
篇八 :配合物的生成和性质
配合物的生成和性质
一、实验目的
1、了解有关配合物的生成,配离子及简单离子的区别。
2、比较配离子的稳定性,了解配位平衡与沉淀反应、氧化还原反应以及溶液酸度的关系。
二、实验原理
由一个简单的正离子和几个中性分子或其它离子结合而成的复杂离子叫配离子,含有配离子的化合物叫配合物。配离子在溶液中也能或多或少地离解成简单离子或分子。例如:[Cu(NH3)4]2+配离子在溶液中存在下列离解平衡:
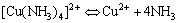
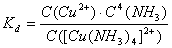
不稳定常数Kd表示该离子离解成简单离子趋势的大小。
配离子的离解平衡也是一种化学平衡。能向着生成更难离解或更难溶解的物质的方向进行,例如,在[Fe(SCN)]2+溶解中加入F-离子,则反应向着生成稳定常数更大的[FeF6]3- 配离子方向进行。
螯合物是中心离子与多基配位形成的具有环状结构的配合物。很多金属的螯合物都具有特征的颜色,并且很难溶于水而易溶于有机溶剂。例如,丁二肟在弱碱性条件下与Ni2+生成鲜红色难溶于水的螯合物,这一反应可作检验Ni2+的特征反应。
四、仪器及试剂
1、 仪器
试管、滴定管
2、 试剂
HgCl2(0.1mol·L-1)、KI(0.1 mol·L-1)、NiSO4(0.2 mol·L-1)、BaCl2(0.1mol·L-1)、NaOH(0.1mol·L-1)、1:1(NH3·H2O)、FeCl3(0.1mol·L-1)、KSCN(0.1 mol·L-1)、K3[Fe(CN)6](0.1 mol·L-1)、AgNO3(0.1mol·L-1)、NaCl(0.1 mol·L-1)、CCl4、FeCl3(0.5 mol·L-1)、NH4F(4 mol·L-1)、NaOH(2mol·L-1)、1:1H2SO4、HCl(浓)、NaF(0.1 mol·L-1)、CuSO4(0.1 mol·L-1)、K4P2O7(2 mol·L-1)、NiCl2(0.1 mol·L-1)、NH3·H2O(2 mol·L-1)、1%丁二肟、乙醚。
…… …… 余下全文