篇一 :高考离子共存总结
1. 复习重点
(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。
(2)定性中有定量,如“由水电离出的H+或OH-浓度为1×10-10mol/L的溶液中,……”。
2.难点聚焦
(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。
2、有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,
主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);
Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为
Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等;
SiO32-、AlO2- 、S2O32-等不能与H+大量共存是因为
SiO32-+2H+=H2 SiO3↓、AlO2-+H++H2O=Al(OH)3↓、S2O32-+2H+=S↓+SO2↑+H2O
…… …… 余下全文
篇二 :高考离子共存问题大总结
高考离子共存问题总结
不能共存的原因: 1、有气体产生;
H+与CO32-、HCO3-、SO32-、HSO3ˉ、S2ˉ、HSˉ等不能共存
如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,
主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。 2、有沉淀生成或生成微溶物质。
①SO4与Ba、Ca、Ag等不能共存;
2ˉ
2+
2+
+
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+等不能共存; ③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+等不能共存;
④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+等不能共存;
⑤AlO2ˉ与HCO3ˉ不能大量共存:AlO2ˉ+HCO3ˉ+H2O=Al(OH)3↓+CO32ˉ(发生双水解)
如:
Cu2+、Fe3+等不能与OH-大量共存
也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。 3、有弱电解质生成。 如OH、CH3COO、CO3
--2-
、HCO32- 、SO32-、 HSO3- 与H+不能大量共存,
…… …… 余下全文
篇三 :高考化学-离子共存 知识点 总结
离子反应方程式与离子共存
1. 复习重点
(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。
(2)定性中有定量,如“由水电离出的H+或OH-浓度为1×10-10mol/L的溶液中,……”。
2.难点聚焦
(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。
2、有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,
主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);
Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为
Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等;
SiO32-、AlO2- 、S2O32-等不能与H+大量共存是因为
SiO32-+2H+=H2 SiO3↓、AlO2-+H++H2O=Al(OH)3↓、S2O32-+2H+=S↓+SO2↑+H2O
…… …… 余下全文
篇四 :高考离子共存总结2
高考离子共存问题总结
一、不能共存的原因:
1、有气体产生。
H+与CO32-、HCO3-、SO32-、HSO3ˉ、S2ˉ、HSˉ等不能共存。如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。 2、有沉淀生成或生成微溶物质。
2ˉ2+2++ ①SO4与Ba、Ca、Ag等不能共存;
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+等不能共存;
③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+等不能共存;
④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+等不能共存;
ˉˉˉˉ2ˉ ⑤AlO2与HCO3不能大量共存:AlO2+HCO3+H2O=Al(OH)3↓+CO3(发生双水解)
如:Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。 3、有弱电解质生成。
--2- 2- 2-- + ①OH、CH3COO、CO3、HCO3、SO3、 HSO3与H不能大量共存。主要是由于OH?+H+=H2O、CH3COO?+H+=CH3COOH。
…… …… 余下全文
篇五 :高考离子共存问题总结
高考离子共存问题总结
不能共存的原因:
1、有气体产生;
H+与CO32-、HCO3-、SO32-、HSO3ˉ、S2ˉ、HSˉ等不能共存
如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存, 主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
2、有沉淀生成或生成微溶物质。
①SO4与Ba、Ca、Ag等不能共存; 2ˉ2+2++
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+等不能共存; ③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+等不能共存; ④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+等不能共存; ⑤AlO2ˉ与HCO3ˉ不能大量共存:AlO2ˉ+HCO3ˉ+H2O=Al(OH)3↓+CO32ˉ(发生双水解) 如:
Cu2+、Fe3+等不能与OH-大量共存
也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。 3、有弱电解质生成。
如OH、CH3COO、CO3--2- 、HCO32- 、SO32-、 HSO3- 与H+不能大量共存, NH4+与OH-不能大量共存
…… …… 余下全文
篇六 :高考离子共存问题总结
高考离子共存问题总结
不能共存的原因:
1. 有气体产生:
H+与CO32-、HCO3-、SO32-、HSO3ˉ、S2ˉ、HSˉ等不能共存 2. 有沉淀生成或生成微溶物质:
①SO42ˉ与Ba2+、Ca2+、Ag+ 等不能共存;
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+ 等不能共存; ③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+ 等不能共存;
④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+ 等不能共存;
ˉˉˉˉ2ˉ
⑤AlO2与HCO3不能大量共存:AlO2+ HCO3 + H2O = Al(OH)3↓ + CO3(发生双水解) 3. 有弱电解质生成(气体生成):
OH-、CH3COO-、CO32- 、HCO32- 、SO32-、 HSO3- 与H+ 不能大量共存,NH4+ 与OH- 不能大量共存。
4. 一些容易发生水解的离子,在溶液中的存在是有条件的:
①AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在; ②Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
…… …… 余下全文
篇七 :高考离子共存问题大总结
1、有气体产生 高考离子共存问题总结
H+与CO32-、HCO3-、SO32-、HSO3ˉ、S2ˉ、HSˉ等不能共存
如CO32-、S2-、HS-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存, 主要是由于CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑。
2、有沉淀生成或生成微溶物质
①SO42ˉ与Ba2+、Ca2+、Ag+等不能共存;
②CO32ˉ与Ba2+、Ca2+、Mg2+、Ag+、Cu2+、Zn2+等不能共存; ③S2ˉ与Cu2+、Pb2+、Fe2+、Hg2+、Ag+等不能共存;
④OHˉ与Mg2+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、Zn2+等不能共存; ⑤AlO2ˉ与HCO3ˉ不能大量共存:AlO2ˉ+HCO3ˉ+H2O=Al(OH)3↓+CO32ˉ(发生双水解) 如:Cu2+、Fe3+等不能与OH-大量共存也是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等。
3、有弱电解质生成
如OH-、CH3COO-、CO32- 、HCO32- 、SO32-、 HSO3- 与H+不能大量共存, NH4+与OH-不能大量共存
…… …… 余下全文
篇八 :广东高考化学历年离子共存总结
(2012)8 、在水溶液中能大量共存的一组是
A.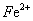
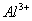
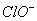
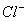 B.
B. 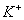
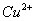
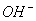
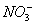
C .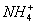
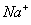
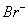
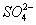 D.
D. 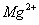
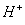

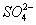
(2011)8. 能在水溶液中大量共存的一组离子是
A. H+、I―、NO3―、SiO32- B. Ag+、Fe3+、Cl―、SO42―
…… …… 余下全文