篇一 :高中有机化学总结
高中有机化学总结
一、烃知识归纳总结:
1、(1)烃的分类 饱和链烃——烷烃CnH2n+2 (n≥1) 链烃 烯烃CnH2n (n≥2) 不饱和链烃—— 烃 炔烃CnH2n-2 (n≥2) 芳香烃(如苯及其同系物)CnH2n-6 (n≥6)
(2)各类烃的结构特点和主要化学性质 结构特点 主要化学性质 烷烃 仅含C—C键 与卤素等发生取代反应、热分解 烯烃 含C==C键 与卤素等发生加成反应,与高锰酸钾发生氧化反应,聚合反应 炔烃 含C≡C键 与卤素等发生加成反应,与高锰酸钾发生氧化反应,聚合反应 苯(芳香烃) 与卤素等发生加成反应,与氢气等发生加成反应。
2、几个重要的概念
(1)同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质,互称为同系物; (2)同分异构现象:化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象; (3)同分异构体:具有同分异构现象的化合物互称为同分异构体;
4、几种重要的有机化学反应类型
(1)氧化反应:包括两层含义①与氧气的燃烧②能否被酸性KMnO4溶液氧化; (2)取代反应:有机物分子里的某些原子团或原子被其他原子或原子团所代替的反应叫取代反应。如烷烃与卤素的反应、苯与液溴的反应、苯的硝化、磺化反应等均属取代反应; (3)加成反应:有机物分子里不饱和碳原子与其他原子或原子团直接结合生成新化合物的反应叫加成反应。如乙烯与溴及其他卤素或氢气的反应、乙炔与卤素的反应等均属加成反应; (4)聚合反应:由相对分子质量小的化合物分子结合成相对分子质量大的高分子的反应叫做聚合反应。如乙烯的聚合、氯乙烯的聚合均属聚合反应;
…… …… 余下全文
篇二 :高中有机化学总结
有机化学总结
第一部分 烃
知识归纳总结
从大的方面讲,本章的知识可以从以下几个方面加以概括:1、有机物的结构特点;2、烃;3、几个重要的概念;4、几种重要的有机化学发应类型;5、烷烃的系统命名;6、石油和煤。
1、有机物的结构特点
有机物结构有何特点?有机物种类为什么繁多?
2、烃
什么叫烃?本章学过哪些烃?其通式是什么?
(1)烃的分类
饱和链烃——烷烃CnH2n+2 (n≥1)
链烃 烯烃CnH2n (n≥2)
不饱和链烃——
烃 炔烃CnH2n-2 (n≥2)
芳香烃(如苯及其同系物)CnH2n-6 (n≥6)
(2)各类烃的结构特点和主要化学性质
结构特点 主要化学性质
烷烃 仅含C—C键 与卤素等发生取代反应、热分解
烯烃 含C==C键 与卤素等发生加成反应,与高锰酸钾发生氧化反应,聚合反应
炔烃 含C≡C键 与卤素等发生加成反应,与高锰酸钾发生氧化反应,聚合反应
苯
(芳香烃) 与卤素等发生加成反应,与氢气等发生加成反应
3、几个重要的概念
(1)同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质,互称为同系物;
(2)同分异构现象:化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象;
(3)同分异构体:具有同分异构现象的化合物互称为同分异构体;
4、几种重要的有机化学反应类型
在本章所学各代表物的化学性质中涉及到哪些反应类型?其含义是什么?
(1)氧化反应:包括两层含义①与氧气的燃烧②能否被酸性KMnO4溶液氧化;
(2)取代反应:有机物分子里的某些原子团或原子被其他原子或原子团所代替的反应叫取代反应。如烷烃与卤素的反应、苯与液溴的反应、苯的硝化、磺化反应等均属取代反应;
(3)加成反应:有机物分子里不饱和碳原子与其他原子或原子团直接结合生成新化合物的反应叫加成反应。如乙烯与溴及其他卤素或氢气的反应、乙炔与卤素的反应等均属加成反应;
(4)聚合反应:由相对分子质量小的化合物分子结合成相对分子质量大的高分子的反应叫做聚合反应。如乙烯的聚合、氯乙烯的聚合均属聚合反应;
5、烷烃的系统命名法
烷烃的习惯命名法有什么弊端?烷烃的系统命名法的基本原则和步骤是什么?
系统命名法的基本原则有:①最简化原则;②明确化原则;可解释为一长一近一多一少即主链要长,编号起点离支链最近,支链数目要多,支链位置号码之和要少。
系统命名法的基本步骤可归纳为:①选主链,称某烷;②编号码,定支链;③取代基,写在前,注位置,连短线;④不同基,简在前,相同基,二三连。
6、石油和煤
石油和煤都是重要的化工原料,也是重要的能源物质,那么从原油到各种化工产品,要经过哪些途径?如何提高煤的燃烧效率和利用率?
石油的炼制包括分馏、裂化和裂解。分馏是利用烃的不同沸点,通过不断地加热和冷凝,把石油分离成不同沸点范围的蒸馏产物的过程。裂化是在一定条件下,使长链烃断裂成短链烃的方法,主要产物是相对分子质量较小的液态烃。裂解是深度裂化,主要产物是相对分子质量更小的不饱和烃如乙烯等。
煤的价值要想得到充分的利用,必须进行综合利用,一般的措施有煤的干馏(也称煤的焦化)、煤的气化和液化。
规律总结
一、计算并推断烃的分子式及其结构简式
确定烃分子式的基本方法:
[方法一] 根据有机物中各元素的质量分数(或元素的质量比),求出有机物的最简式, 再根据有机物的式量确定化学式(分子式)。即:质量分数→最简式→分子式
[方法二] 根据有机物的摩尔质量和有机物中各元素的质量分数(或元素质量比),推算出1mol该有机物中各元素的原子物质的量,从而确定分子中的各原子个数。即:
质量分数→1mol物质中各元素原子物质的量→分子式
[方法三] 燃烧通式法。如烃的分子式可设为CxHy,由于x和y是相对独立的,计算中数据运算简便。根据烃的燃烧反应方程式,借助通式CxHy进行计算,解出x和y,最后得出烃的分子式。
注:
(1)气体摩尔质量=22.4L/mol ×dg/L(d为标准状况下气体密度).
(2)某气体对A气体的相对密度为DA,则该气体式量M=MADA.
(3)由烃的分子量求分子式的方法:
①M/14,能除尽,可推知为烯烃或环烷烃,其商为碳原子数;
②M/14,余2能除尽,可推知为烷烃,其商为碳原子数;
③M/14,差2能除尽,推知为炔烃或二烯烃或环烯烃,其商为碳原子数。
④M/14,差6能除尽,推知为苯或苯的同系物。
由式量求化学式可用商余法,步骤如下:
1.由除法得商和余数,得出式量对称烃的化学式,注意H原子数不能超饱和。
2.进行等量代换确定出同式量其他烃或烃的衍生物的化学式:
(1)1个C原子可代替12个H原子;
(2)1个O原子可代替16个H原子或1个“CH4”基团;
(3)1个N原子可代替14个H原子或1个“CH2”基团,注意H原子数要保持偶数。
完全燃烧的有关规律
(1)等物质的量的烃(CnHm)完全燃烧时,耗氧量的多少决定于n+的值,n+的值越大,耗氧量越多,反之越少。
(2)等质量的烃(CnHm)完全燃烧时,耗氧量的多少决定于氢的质量分数,即的值,越大,耗氧量越多,反之越少。
(3)等质量的烃(CnHm)完全燃烧时,碳的质量分数越大,生成的CO2越多,氢的质量分数越大,生成的H2O越多。
(4)最简式相同的烃无论以何种比例混合,都有:①混合物中碳氢元素的质量比及质量分数 不变;②一定质量的混合烃完全燃烧时消耗O2的质量不变,生成的CO2的质量均不变。
(5)对于分子式为CnHm的烃:
①当m=4时,完全燃烧前后物质的量不变;
②当m<4时,完全燃烧后物质的量减少;
③当m>4时,完全燃烧后物质的量增加.
三、各类烃与H2加成的物质的量之比:
不饱和烃 与H2加成的最大物质的量之比
烯烃 1∶1
二烯烃 1∶2
炔烃 1∶2
苯及其同系物 1∶3
苯乙烯
—CH CH2 1∶4
四、根据烃的分子式推断其可能具有的结构
从烷烃通式CnH2n+2出发,分子中每形成一个C=C键或形成一个环,则减少2个氢原 子;分子中每形成一个C≡C键,则减少4个氢原子。依此规律可由烃的分子式推测其可能具有的结构,再由其性质可确定其结构简式。例如分子式为C5H8的烃可与等物质的量Br2加成,试推测其可能的结构并写出其结构简式.先根据其分子组成可知其分子比对应的C5H12少4个氢原子,可能是二烯烃、炔烃或环烯烃,再根据其与Br2的加成比例可知 其为环烯烃,结构简式为
五、加聚反应的书写及高聚物单体的判断
(1)加聚反应的写法:
单烯烃的加聚反应为:
共轭二烯烃的加聚反应为:
③不同单体加聚时还要考虑可能有不同的连接方式。例如苯乙烯与乙烯间的加聚反应:
(2)高聚物单体的判断
①聚乙烯型
链节为两个碳原子的,则其单体看作乙烯型,如:
②1,3—丁二烯型
链节为四个碳原子,且2,3碳原子间有C=C,则应对应1,3—丁二烯找单体,如:
③混合型
(ⅰ)当链节有四个碳原子,且C、C间无C=C时,应视为含有2个乙烯型单体,如:
(ⅱ)当链节更长时,首先看有无C= C ,若有,则与C=C相边的左 右各一个C原子,共同看作1,3—丁二烯型,其余C原子每两个看作一个乙烯型结构。如:
六、最低系列原则
所谓最低系列原则是:给主链编号从哪一端开始,要以支链位号最小为原则,如果有多个支链时,可从不同端点编号,然后将位号逐位对比,最早出现差别的那位数中,取位号小的那种编号法编号。
[例题]下列有机物的命名,正确的是
A.2,3,3,8,8——五甲基壬烷
B.2,2,7,7,8——五甲基壬烷
C.2,3,3,5,5——五甲基戊烷
D.2,2,4,4,5——五甲基戊烷
错解分析:依据早已摒弃的有机命名要遵循的“支链序号之和最小”的原则,而误选A。不注意4个“CH2”基团的存在,而误选C或D。
解题思路:首先确定主链,主链上有9个而非5个碳原子,C、D不可选。然后编号,若从左向右编,则支链编号为:2,3,3,8,8;若从右向左编,则支链编号为:2,2,7,7,8。将以上两种编号逐位对比,第一位相同,第二位不同。根据最低系列原则可知,后者是正确的,即所列有机物的名称是:2,2,7,7,8—五甲基壬烷。
答案:B
对于有机物的命名,现在我国执行的是1980年公布的新《原则》,为与国际命名相接轨,抛弃了源于前苏联的1960年公布的旧《原则》中的“序号之和最小原则”,代之以为“最低系列原则”。两种方法比较,序号之和最小原则通过计算才能确定编号的起点和方向,最低系列原则只需进行观察就能确定编号的起点和方向,显然后者更直接、更简捷。
七、同分异构现象和同分异构体的书写
同分异构现象的形式及书写顺序
碳架异构 官能团的位置异构 官能团的种类异构
同分异构体的书写口诀
从头摘,挂中间;往端移,不到边;先甲基,后乙基;先集中,后分散;变换位,不能同。
八、等效氢法判断烷烃一氯取代物的种类
同一碳原子上连接的H原子等效
同一碳原子上连接的甲基上的H原子等效
处于镜面对称位置上的H原子等效
附:碳原子数≤10的烷烃的一氯取代物只有一种的是:CH4、C2H6、C5H12、C8H18。它们的结构简式分别为:
…… …… 余下全文
篇三 :高中有机化学精华总结
有机化学知识点归类
[高考考试大纲要求]
1.理解基团、官能团、同分异构体、同系物等概念。能够识别结构式(结构简式)中各种原子的连接次序和方式、基团和官能团。能够辩认同系物和列举异构体。了解烷烃的命名原则。2.以一些典型的烃类化合物为例,了解有机化合物的基本碳架结构。掌握各类烃(烷烃、烯烃、炔烃、芳香炔)中各种碳碳键、碳氢键的性质和主要化学反应。3.以一些典型的烃类衍生物(乙醇、溴乙烷、苯酚、甲醛、(增加)乙醛、乙酸、乙酸乙酯、脂肪酸、甘油酯、多羟基醛、多羟基醛酮、氨基酸等)为例,了解官能团在化合物中的作用。掌握各主要官能团的性质和主要化学反应。4.通过上述各类化合物的化学反应,掌握有机反应的主要类型。5.综合应用各类化合物的不同性质,进行区别、鉴定、分离、提纯或推导未知物的结构简式。组合多个化合物的化学反应,合成具有指定结构简式的产物。
1.1mol有机物消耗H2或Br2的最大量
2.1mol有机物消耗NaOH的最大量
5.由反应试剂看有机物的类型
6.根据反应物的化学性质推断官能团
1
9.消除官能团的方法
①通过加成消除不饱和键;②通过消去或氧化或酯化等消除羟基(-OH);③通过加成或氧化等消除醛基(-CHO)。
…… …… 余下全文
篇四 :20xx高中有机化学实验总结最全
(一) 烃
1. 20xx有机化学基础实验 甲烷的氯代(必修2、P56)(性质)
实验:取一个100mL的大量筒(或集气瓶),用排 水 的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(注意:不要放在阳光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。
现象:大约3min后,可观察到混合气体颜色变浅,气体体积缩小,量筒壁上出现 油状液体 ,量筒内饱和食盐水液面 上升 ,可能有晶体析出【会生成HCl,增加了饱和食盐水】 ..
解释: 生成卤代烃
2. 石油的分馏(必修2、P57,重点)(分离提纯)
(1) 两种或多种 沸点 相差较大且 互溶 的液体混合物,要进行分离时,常用蒸馏或分
馏的分离方法。
(2) 分馏(蒸馏)实验所需的主要仪器:铁架台(铁圈、铁夹)、石棉网、 蒸馏烧瓶 、
带温度计的单孔橡皮塞、 冷凝管 、牛角管、 锥形瓶 。
(3) 蒸馏烧瓶中加入碎瓷片的作用是: 防止爆沸
(4) 温度计的位置:温度计的水银球应处于 支管口 (以测量蒸汽温度)
(5) 冷凝管:蒸气在冷凝管内管中的流动方向与冷水在外管中的流动方向 下口进,上
…… …… 余下全文
篇五 :高中有机化学知识点总结(修改过)
化学之高中有机化学知识点总结
1.需水浴加热的反应有:
(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解
凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有:
(1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、乙酸乙酯的水解(70-80℃) (4)制硝基苯(50-60℃)
〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:
醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:
(1)含有碳碳双键、碳碳叁键的烃和烃的衍生物、苯的同系物
(2)含有羟基的化合物如醇和酚类物质
(3)含有醛基的化合物
(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2、HI、H2S、H2SO3等)
…… …… 余下全文
篇六 :高中有机化学基础知识总结概括
高中有机化学基础知识总结概括
1.各类有机物异构体情况:
⑴ CnH2n+2:只能是烷烃,而且只有碳链异构。如CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4
⑵ CnH2n:单烯烃、环烷烃。如CH2=CHCH2CH3、
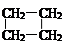
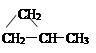 CH3CH=CHCH3、CH2=C(CH3)2、 、
CH3CH=CHCH3、CH2=C(CH3)2、 、
⑶ CnH2n-2:炔烃、二烯烃。如:CH≡CCH2CH3、CH3C≡CCH3、CH2=CHCH=CH2


 ⑷ CnH2n-6:芳香烃(苯及其同系物)。如: 、 、
⑷ CnH2n-6:芳香烃(苯及其同系物)。如: 、 、
⑸ CnH2n+2O:饱和脂肪醇、醚。如:CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3
⑹ CnH2nO:醛、酮、环醚、环醇、烯基醇。如:CH3CH2CHO、CH3COCH3、CH2=CHCH2OH、
…… …… 余下全文
篇七 :高中有机化学基础知识总结概括
高中有机化学基础知识总结概括
1、常温常压下为气态的有机物: 1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、
汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在
常温微溶与水,但高于65℃任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大
于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、
碳碳叁键)的有机物。能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CCl4、氯仿、液
态烷烃等。
5、能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱
和碳碳键的有机物、酚类(苯酚)。
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和
一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代
烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
…… …… 余下全文
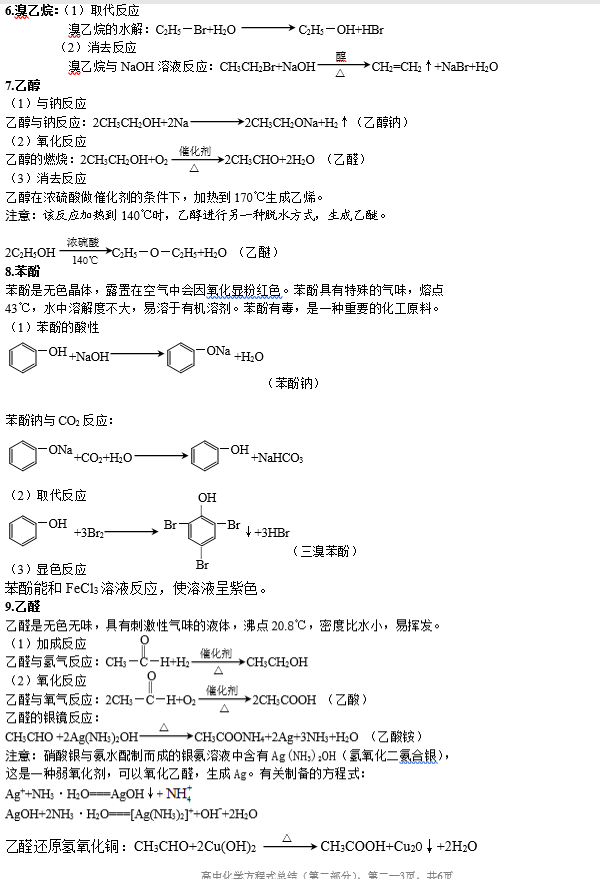
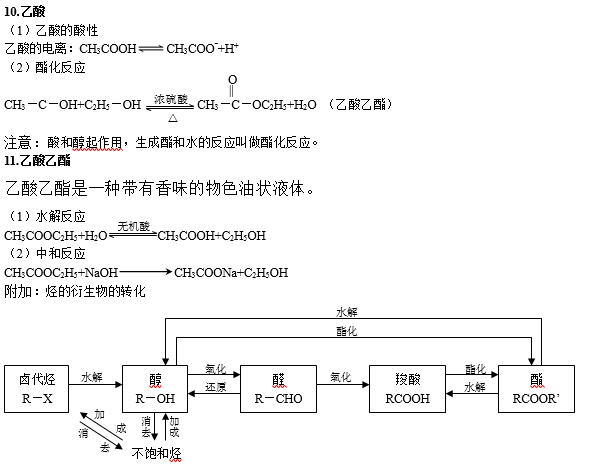
篇八 :(完美版)高中有机化学方程式,知识点总结
高中有机化学方程式总结
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:

高中有机化学知识点总结
1.需水浴加热的反应有: (1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有: (1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃) 〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
…… …… 余下全文