初中函数知识点总结归纳
函数知识点总结(掌握函数的定义、性质和图像)
(一)正比例函数和一次函数
1、正比例函数及性质
一般地,形如y=kx(k是常数,k≠0)的函数叫做正比例函数,其中k叫做比例系数.
注:正比例函数一般形式 y=kx (k不为零) ① k不为零 ② x指数为1 ③ b取零
当k>0时,直线y=kx经过三、一象限,从左向右上升,即随x的增大y也增大;当k<0时,直线y=kx经过二、四象限,从左向右下降,即随x增大y反而减小.
(1) 解析式:y=kx(k是常数,k≠0)
(2) 必过点:(0,0)、(1,k)
(3) 走向:k>0时,图像经过一、三象限;k<0时,图像经过二、四象限
(4) 增减性:k>0,y随x的增大而增大;k<0,y随x增大而减小
(5) 倾斜度:|k|越大,越接近y轴;|k|越小,越接近x轴
2、一次函数及性质
一般地,形如y=kx+b(k,b是常数,k≠0),那么y叫做x的一次函数.当b=0时,y=kx+b即y=kx,所以说正比例函数是一种特殊的一次函数.
注:一次函数一般形式 y=kx+b (k不为零) ① k不为零 ②x指数为1 ③ b取任意实数
一次函数y=kx+b的图象是经过(0,b)和(-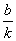 ,0)两点的一条直线,我们称它为直线y=kx+b,它可以看作由直线y=kx平移|b|个单位长度得到.(当b>0时,向上平移;当b<0时,向下平移)
,0)两点的一条直线,我们称它为直线y=kx+b,它可以看作由直线y=kx平移|b|个单位长度得到.(当b>0时,向上平移;当b<0时,向下平移)
(1)解析式:y=kx+b(k、b是常数,k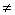 0)
0)
(2)必过点:(0,b)和(-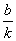 ,0)
,0)
(3)走向: k>0,图象经过第一、三象限;k<0,图象经过第二、四象限
b>0,图象经过第一、二象限;b<0,图象经过第三、四象限
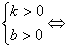 直线经过第一、二、三象限
直线经过第一、二、三象限 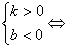 直线经过第一、三、四象限
直线经过第一、三、四象限
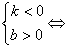 直线经过第一、二、四象限
直线经过第一、二、四象限 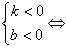 直线经过第二、三、四象限
直线经过第二、三、四象限
注:y=kx+b中的k,b的作用:
1、k决定着直线的变化趋势
① k>0 直线从左向右是向上的 ② k<0 直线从左向右是向下的
2、b决定着直线与y轴的交点位置
① b>0 直线与y轴的正半轴相交 ② b<0 直线与y轴的负半轴相交
(4)增减性: k>0,y随x的增大而增大;k<0,y随x增大而减小.
(5)倾斜度:|k|越大,图象越接近于y轴;|k|越小,图象越接近于x轴.
(6)图像的平移: 当b>0时,将直线y=kx的图象向上平移b个单位;
当b<0时,将直线y=kx的图象向下平移b个单位.
3、一次函数y=kx+b的图象的画法.
根据几何知识:经过两点能画出一条直线,并且只能画出一条直线,即两点确定一条直线,所以画一次函数的图象时,只要先描出两点,再连成直线即可.一般情况下:是先选取它与两坐标轴的交点:(0,b),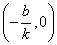 .即横坐标或纵坐标为0的点.
.即横坐标或纵坐标为0的点.
注:对于y=kx+b 而言,图象共有以下四种情况:
1、k>0,b>0 2、k>0,b<0 3、k<0,b<0 4、k<0,b>0
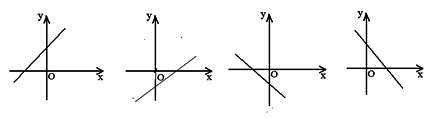
4、直线y=kx+b(k≠0)与坐标轴的交点.
(1)直线y=kx与x轴、y轴的交点都是(0,0);
(2)直线y=kx+b与x轴交点坐标为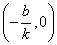 与 y轴交点坐标为(0,b).
与 y轴交点坐标为(0,b).
5、用待定系数法确定函数解析式的一般步骤:
(1)根据已知条件写出含有待定系数的函数关系式;
(2)将x、y的几对值或图象上的几个点的坐标代入上述函数关系式中得到以待定系数为未知数的方程;
(3)解方程得出未知系数的值;
(4)将求出的待定系数代回所求的函数关系式中得出所求函数的解析式.
6、两条直线交点坐标的求法:
方法:联立方程组求x、y
例题:已知两直线y=x+6 与y=2x-4交于点P,求P点的坐标?
7、直线y=k1x+b1与y=k2x+b2的位置关系
(1)两条直线平行:k1=k2且b1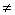 b2
b2
(2)两直线相交:k1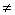 k2
k2
(3)两直线重合:k1=k2且b1=b2
平行于 轴(或重合)的直线记作
轴(或重合)的直线记作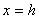 .特别地,
.特别地, 轴记作直线
轴记作直线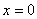
8、正比例函数与一次函数图象之间的关系
一次函数y=kx+b的图象是一条直线,它可以看作是由直线y=kx平移|b|个单位长度而得到(当b>0时,向上平移;当b<0时,向下平移).
9、一元一次方程与一次函数的关系
任何一元一次方程到可以转化为ax+b=0(a,b为常数,a≠0)的形式,所以解一元一次方程可以转化为:当某个一次函数的值为0时,求相应的自变量的值. 从图象上看,相当于已知直线y=ax+b确定它与x轴的交点的横坐标的值.
10、一次函数与一元一次不等式的关系
任何一个一元一次不等式都可以转化为ax+b>0或ax+b<0(a,b为常数,a≠0)的形式,所以解一元一次不等式可以看作:当一次函数值大(小)于0时,求自变量的取值范围.
11、一次函数与二元一次方程组
(1)以二元一次方程ax+by=c的解为坐标的点组成的图象与一次函数y=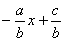 的图象相同.
的图象相同.
(2)二元一次方程组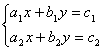 的解可以看作是两个一次函数y=
的解可以看作是两个一次函数y= 和y=
和y= 的图象交点.
的图象交点.
12、函数应用问题 (理论应用 实际应用)
(1)利用图象解题 通过函数图象获取信息,并利用所获取的信息解决简单的实际问题.
(2)经营决策问题 函数建模的关键是将实际问题数学化,从而解决最佳方案,最佳策略等问题.建立一次函数模型解决实际问题,就是要从实际问题中抽象出两个变量,再寻求出两个变量之间的关系,构建函数模型,从而利用数学知题.
(二)反比例函数
一般地,如果两个变量x、y之间的关系可以表示成y=k/x (k为常数,k≠0)的形式,那么称y是x的反比例函数。
取值范围: ① k ≠ 0; ②在一般的情况下 , 自变量 x 的取值范围可以是 不等于0的任意实数 ; ③函数 y 的取值范围也是任意非零实数。
反比例函数的图像属于以原点为对称中心的中心对称的双曲线
反比例函数图像中每一象限的每一支曲线会无限接近X轴Y轴但不会与坐标轴相交(K≠0)。
反比例函数的性质:
1.当k>0时,图象分别位于第一、三象限,同一个象限内,y随x的增大而减小;当k<0时,图象分别位于二、四象限,同一个象限内,y随x的增大而增大。
2.k>0时,函数在x<0和 x>0上同为减函数;k<0时,函数在x<0和x>0上同为增函数。
定义域为x≠0;值域为y≠0。
3.因为在y=k/x(k≠0)中,x不能为0,y也不能为0,所以反比例函数的图象不可能与x轴相交,也不可能与y轴相交。
4. 在一个反比例函数图象上任取两点P,Q,过点P,Q分别作x轴,y轴的平行线,与坐标轴围成的矩形面积为S1,S2,则S1=S2=|K|
5. 反比例函数的图象既是轴对称图形,又是中心对称图形,它有两条对称轴 y=x y=-x(即第一三,二四象限角平分线),对称中心是坐标原点。
6.若设正比例函数y=mx与反比例函数y=n/x交于A、B两点(m、n同号),那么A B两点关于原点对称。
7.设在平面内有反比例函数y=k/x和一次函数y=mx+n,要使它们有公共交点,则n2 +4k·m≥(不小于)0。 (k/x=mx+n,即mx^2+nx-k=0)
8.反比例函数y=k/x的渐近线:x轴与y轴。
9.反比例函数关于正比例函数y=x,y=-x轴对称,并且关于原点中心对称. (第5点的同义不同表述)
10.反比例上一点m向x、y轴分别做垂线,交于q、w,则矩形mwqo(o为原点)的面积为|k|
11.k值相等的反比例函数重合,k值不相等的反比例函数永不相交。
12.|k|越大,反比例函数的图象离坐标轴的距离越远。
(三)二次函数
二次函数是指未知数的最高次数为二次的多项式函数。二次函数可以表示为f(x)=ax^2+bx+c(a不为0)。其图像是一条主轴平行于y轴的抛物线。
一般式(已知图像上三点或三对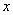 、
、 的值,通常选择一般式.)
的值,通常选择一般式.)
y=ax^2+bx+c(a≠0,a、b、c为常数),顶点坐标为(-b/2a,(4ac-b^2/4a) ;
顶点式(已知图像的顶点或对称轴,通常选择顶点式.)
y=a(x+m)^2+k(a≠0,a、m、k为常数)或y=a(x-h)^2+k(a≠0,a、h、k为常数),顶点坐标为(-m,k)或(h,k)对称轴为x=-m或x=h,有时题目会指出让你用配方法把一般式化成顶点式;
交点式(已知图像与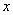 轴的交点坐标
轴的交点坐标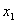 、
、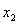 ,通常选用交点式)
,通常选用交点式)
y=a(x-x1)(x-x2) [仅限于与x轴有交点A(x1,0)和 B(x2,0)的抛物线] ;
抛物线的三要素:开口方向、对称轴、顶点
顶点
抛物线有一个顶点P,坐标为P ( -b/2a ,4ac-b^2/4a ) ,当-b/2a=0时,P在y轴上;当Δ= b^2-4ac=0时,P在x轴上。
开口
二次项系数a决定抛物线的开口方向和大小。 当a>0时,抛物线向上开口;当a<0时,抛物线向下开口。 |a|越大,则抛物线的开口越小。
决定对称轴位置的因素
一次项系数b和二次项系数a共同决定对称轴的位置。
当a与b同号时(即ab>0),对称轴在y轴左;当a与b异号时(即ab<0),对称轴在y轴右。(左同右异)
c的大小决定抛物线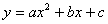 与
与 轴交点的位置.
轴交点的位置.
当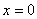 时,
时,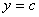 ,∴抛物线
,∴抛物线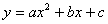 与
与 轴有且只有一个交点(0,
轴有且只有一个交点(0,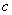 ):
):
①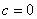 ,抛物线经过原点; ②
,抛物线经过原点; ②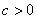 ,与
,与 轴交于正半轴;③
轴交于正半轴;③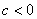 ,与
,与 轴交于负半轴.
轴交于负半轴.
直线与抛物线的交点
(1) 轴与抛物线
轴与抛物线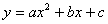 得交点为(0,
得交点为(0, 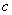 ).
).
(2)与 轴平行的直线
轴平行的直线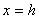 与抛物线
与抛物线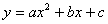 有且只有一个交点(
有且只有一个交点(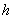 ,
, ).
).
(3)抛物线与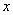 轴的交点
轴的交点
二次函数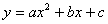 的图像与
的图像与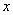 轴的两个交点的横坐标
轴的两个交点的横坐标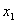 、
、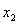 ,是对应一元二次方程
,是对应一元二次方程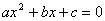 的两个实数根.抛物线与
的两个实数根.抛物线与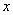 轴的交点情况可以由对应的一元二次方程的根的判别式判定:
轴的交点情况可以由对应的一元二次方程的根的判别式判定:
①有两个交点
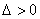
 抛物线与
抛物线与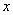 轴相交;
轴相交;
②有一个交点(顶点在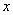 轴上)
轴上)
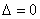
 抛物线与
抛物线与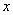 轴相切;
轴相切;
③没有交点
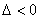
 抛物线与
抛物线与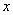 轴相离.
轴相离.
(4)平行于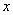 轴的直线与抛物线的交点同(3)一样可能有0个交点、1个交点、2个交点.当有2个交点时,两交点的纵坐标相等,设纵坐标为
轴的直线与抛物线的交点同(3)一样可能有0个交点、1个交点、2个交点.当有2个交点时,两交点的纵坐标相等,设纵坐标为 ,则横坐标是
,则横坐标是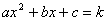 的两个实数根.
的两个实数根.
(5)一次函数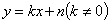 的图像
的图像 与二次函数
与二次函数 的图像
的图像 的交点,由方程组
的交点,由方程组 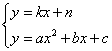 的解的数目来确定:
的解的数目来确定:
①方程组有两组不同的解时
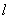 与
与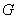 有两个交点; ②方程组只有一组解时
有两个交点; ②方程组只有一组解时
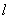 与
与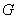 只有一个交点;③方程组无解时
只有一个交点;③方程组无解时
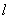 与
与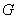 没有交点.
没有交点.
(6)抛物线与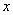 轴两交点之间的距离:若抛物线
轴两交点之间的距离:若抛物线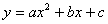 与
与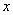 轴两交点为
轴两交点为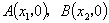 ,由于
,由于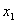 、
、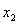 是方程
是方程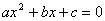 的两个根,故
的两个根,故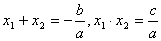
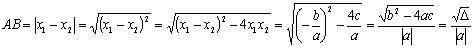
第二篇:初中化学知识点总结归纳
化学知识点的归纳总结.
一,初中化学常见物质的颜色
(一),固体的颜色
1,红色固体:铜,氧化铁
2,绿色固体:碱式碳酸铜
3,蓝色固体:氢氧化铜,硫酸铜晶体
4,紫黑色固体:高锰酸钾
5,淡黄色固体:硫磺
6,无色固体:冰,干冰,金刚石
7,银白色固体:银,铁,镁,铝,汞等金属
8,黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9,红褐色固体:氢氧化铁
10,白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸 铜,五氧化二磷,氧化镁
(二),液体的颜色
11,无色液体:水,双氧水
12,蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13,浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14,黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15,紫红色溶液:高锰酸钾溶液
16,紫色溶液:石蕊溶液
(三),气体的颜色
17,红棕色气体:二氧化氮
18,黄绿色气体:氯气
19,无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气 体等大多数气体.
二,初中化学之三
1,我国古代三大化学工艺:造纸,制火药,烧瓷器.
2,氧化反应的三种类型:爆炸,燃烧,缓慢氧化.
3,构成物质的三种微粒:分子,原子,离子.
4,不带电的三种微粒:分子,原子,中子.
5,物质组成与构成的三种说法: (1),二氧化碳是由碳元素和氧元素组成的; (2),二氧化碳是由二氧化碳分子构成的; (3),一个二氧化碳分子是由 一个碳原子和一个氧原子构成的.
6,构成原子的三种微粒:质子,中子,电子.
7,造成水污染的三种原因: (1)工业"三废"任意排放, (2)生活污水任意排放 (3)农药化肥任意施放
8,收集气体的三种方法:排水法(不容于水的气体),向上排空气法(密度比 空气大的气体),向下排空气法(密度比空气小的气体).
9,质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变.
10,不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升 高或降低).
11,复分解反应能否发生的三个条件:生成水,气体或者沉淀
12,三大化学肥料:N,P,K
13,排放到空气中的三种气体污染物:一氧化碳,氮的氧化物,硫的氧化物. 14,燃烧发白光的物质:镁条,木炭,蜡烛.
15,具有可燃性,还原性的物质:氢气,一氧化碳,单质碳.
16,具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用).
17,CO 的三种化学性质:可燃性,还原性,毒性.
18,三大矿物燃料:煤,石油,天然气.(全为混合物)
19,三种黑色金属:铁,锰,铬.
20,铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁.
21,炼铁的三种氧化物:铁矿石,焦炭,石灰石.
22,常见的三种强酸:盐酸,硫酸,硝酸.
23,浓硫酸的三个特性:吸水性,脱水性,强氧化性.
24,氢氧化钠的三个俗称:火碱,烧碱,苛性钠.
25,碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳.
26,实验室制取 CO2 不能用的三种物质:硝酸,浓硫酸,碳酸钠.
27,酒精灯的三个火焰:内焰,外焰,焰心.
28,使用酒精灯有三禁:禁止向燃着的灯里添加酒精,禁止用酒精灯去引燃另一 只酒精灯,禁止用嘴吹灭酒精灯.
29,玻璃棒在粗盐提纯中的三个作用:搅拌,引流,转移
30,液体过滤操作中的三靠:(1)倾倒滤液时烧杯口紧靠玻璃棒,(2)玻璃棒 轻靠在三层滤纸的一端,(3)漏斗下端管口紧靠烧杯内壁.
31,固体配溶液的三个步骤:计算,称量,溶解.
32,浓配稀的三个步骤:计算,量取,溶解.
33,浓配稀的三个仪器:烧杯,量筒,玻璃棒.
34,三种遇水放热的物质:浓硫酸,氢氧化钠,生石灰.
35,过滤两次滤液仍浑浊的原因:滤纸破损,仪器不干净,液面高于滤纸边缘.
36,药品取用的三不原则:不能用手接触药品,不要把鼻孔凑到容器口闻药品的 气味,不得尝任何药品的味道.
37,金属活动顺序的三含义:(1)金属的位置越靠前,它在水溶液中越容易失 去电子变成离子,它的活动性就越强;(2)排在氢前面的金属能置换出酸里的 氢,排在氢后面的金属不能置换出酸里的氢;(3)排在前面的金属能把排在后 面的金属从它们的盐溶液中置换出来.
38,温度对固体溶解度的影响:(1)大多数固体物质的溶解度随着温度的升高 而增大,(2)少数固体物质的溶解度受温度影响变化不大(3)极少数固体物质 的溶解度
随着温度的升高而减小.
39,影响溶解速度的因素:(1)温度,(2)是否搅拌(3)固体颗粒的大小
40,使铁生锈的三种物质:铁,水,氧气.
41,溶质的三种状态:固态,液态,气态.
42,影响溶解度的三个因素:溶质的性质,溶剂的性质,温度.
三,初中化学常见混合物的重要成分
1,空气:氮气(N2)和氧气(O2)
2,水煤气:一氧化碳(CO)和氢气(H2)
3,煤气:一氧化碳(CO) 4,天然气:甲烷(CH4)
5,石灰石/大理石:(CaCO3)
6,生铁/钢:(Fe)
7,木炭/焦炭/炭黑/活性炭:(C) 8,铁锈:(Fe2O3)
四,初中化学常见物质俗称
1,氯化钠 (NaCl) : 食盐
2,碳酸钠(Na2CO3) : 纯碱,苏打,口碱
3,氢氧化钠(NaOH):火碱,烧碱,苛性钠
4,氧化钙(CaO):生石灰
5,氢氧化钙(Ca(OH)2):熟石灰,消石灰
6,二氧化碳固体(CO2):干冰
7,氢氯酸(HCl):盐酸
8,碱式碳酸铜(Cu2(OH)2CO3):铜绿
9,硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾
10,甲烷 (CH4):沼气
11,乙醇(C2H5OH):酒精
12,乙酸(CH3COOH):醋酸
13,过氧化氢(H2O2):双氧水
14,汞(Hg):水银
15,碳酸氢钠(NaHCO3):小苏打
四,初中化学溶液的酸碱性
1,显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠,硫酸氢钾等)
2,显碱性的溶液:碱溶液和某些盐溶液(碳酸钠,碳酸氢钠等)
3,显中性的溶液:水和大多数的盐溶液
五,初中化学敞口置于空气中质量改变的
(一)质量增加的
1,由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
2,由于跟水反应而增加的:氧化钙,氧化钡,氧化钾,氧化钠,硫酸铜
3,由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
(二)质量减少的
1,由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
2,由于风化而减少的:碳酸钠晶体.
六,初中化学物质的检验
(一) ,气体的检验
1,氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
2,氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧 杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3,二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
4,氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
5,水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.
(二),离子的检验.
6,氢离子:滴加紫色石蕊试液/加入锌粒
7,氢氧根离子:酚酞试液/硫酸铜溶液
8,碳酸根离子:稀盐酸和澄清的石灰水
9,氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子
10,硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
11,铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口 12,铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子
13,铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子
(三),相关例题
14,如何检验 NaOH 是否变质:滴加稀盐酸,若产生气泡则变质
15,检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石
16,检验 NaOH 中是否含有 NaCl:先滴加足量稀硝酸,再滴加 AgNO3 溶液,若产 生白色沉淀,则含有 NaCl.
17,检验三瓶试液分别是稀 HNO3,稀 HCl,稀 H2SO4? 向三只试管中分别滴加 Ba(NO3)2 溶液,若产生白色沉淀,则是稀 H2SO4;再分 别滴加 AgNO3 溶液,若产生白色沉淀则是稀 HCl,剩下的是稀 HNO3
18,淀粉:加入碘溶液,若变蓝则含淀粉.
19, 葡萄糖: 加入新制的氢氧化铜, 若生成砖红色的氧化亚铜沉淀, 就含葡萄糖.
七,物质的除杂
1,CO2(CO):把气体通过灼热的氧化铜
2,CO(CO2):通过足量的氢氧化钠溶液
3,H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4,CuO(Cu):在空气中(在氧气流中)灼烧混合物
5,Cu(Fe) :加入足量的稀硫酸
6,Cu(CuO):加入足量的稀硫酸
7,FeSO4(CuSO4): 加 入足量的铁粉
8,NaCl(Na2CO3):加 入足量的盐酸
9,NaCl(Na2SO4):加入足量的氯化钡溶液
10,NaCl(NaOH):加入足量的盐酸
11,NaOH(Na2CO3):加入足量的氢氧化钙溶液
12,NaCl(CuSO4):加入足量的氢氧化钡溶液
13,NaNO3(NaCl):加入足量的硝酸银溶液
14,NaCl(KNO3):蒸发溶剂
15,KNO3(NaCl):冷却热饱和溶液.
16,CO2(水蒸气):通过浓硫酸.
八,化学之最
1,未来最理想的燃料是 H2 .
2,最简单的有机物是 CH4 .
3,密度最小的气体是 H2 .
4,相对分子质量最小的物质是 H2 .
5,相对分子质量最小的氧化物是 H2O .
6,化学变化中最小的粒子是 原子 .
7,PH=0 时,酸性最强,碱性最弱 . PH=14 时,碱性最强 ,酸性最弱 .
8,土壤里最缺乏的是 N,K,P 三种元素,肥效最高的氮肥是 尿素 .
9,天然存在最硬的物质是 金刚石 .
10,最早利用天然气的国家是 中国 .
11,地壳中含量最多的元素是 氧 .
12,地壳中含量最多的金属元素是 铝 .
13,空气里含量最多的气体是 氮气 .
14,空气里含量最多的元素是 氮 .
15,当今世界上最重要的三大化石燃料是 煤,石油,天然气.
16,形成化合物种类最多的元素:碳
九,有关不同
1,金刚石和石墨的物理性质不同:是因为 碳原子排列不同.
2,生铁和钢的性能不同:是因为 含碳量不同.
3,一氧化碳和二氧化碳的化学性质不同:是因为 分子构成不同. (氧气和臭氧的化学性质不同是因为分子构成不同; 水和双氧水的化学性质不同 是因为分子构成不同.)
4,元素种类不同:是因为质子数不同.
5,元素化合价不同:是因为最外层电子数不同.
6,钠原子和钠离子的化学性质不同:是因为最外层电子数不同
十,有毒的物质
1, 有毒的固体:亚硝酸钠(NaNO2),乙酸铅等;
2, 有毒的液体:汞,硫酸铜溶液,甲醇,含 Ba2+的溶液(除 BaSO4);
3, 有毒的气体:CO,氮的氧化物,硫的氧化物
-
初中函数知识点总结非常全
知识点一、平面直角坐标系1、平面直角坐标系在平面内画两条互相垂直且有公共原点的数轴,就组成了平面直角坐标系。其中,水平的数轴叫做x…
-
初中函数知识点总结归纳
函数知识点总结(掌握函数的定义、性质和图像)(一)正比例函数和一次函数1、正比例函数及性质一般地,形如y=kx(k是常数,k≠0)…
-
初中数学函数知识点汇总
函数及其图像一、平面直角坐标系在平面内画两条互相垂直且有公共原点的数轴,就组成了平面直角坐标系。坐标平面被x轴和y轴分割而成的四个…
-
初中函数知识点总结
函数知识点总结掌握函数的定义性质和图像一平面直角坐标系1定义平面上互相垂直且有公共原点的两条数轴构成平面直角坐标系简称为直角坐标系…
-
初中函数知识点总结大全(含有高中衔接内容)
一次函数一定义与定义式自变量x和因变量y有如下关系ykxb则此时称y是x的一次函数特别地当b0时y是x的正比例函数即ykxk为常数…
-
20xx函数知识点总结【较全】
基本概念1、变量:在一个变化过程中可以取不同数值的量。常量:在一个变化过程中只能取同一数值的量。2、函数:一般的,在一个变化过程中…
-
初中数学二次函数知识点总结
初中数学二次函数知识点总结原文阅读I.定义与定义表达式一般地,自变量x和因变量y之间存在如下关系:y=ax^2+bx+c(a,b,…
-
高一数学上册_第二章基本初等函数之对数函数知识点总结及练习题(含答案)
〖2.2〗对数函数【2.2.1】对数与对数运算(1)对数的定义①若ax?N(a?0,且a?1),则x叫做以a为底N的对数,记作x?…
-
第二章_基本初等函数知识点总结
第二章基本初等函数一、指数函数(一)指数与指数幂的运算1.根式的概念:一般地,如果x?a,那么x叫做a的n次方根,其中n1,且n∈…
-
语文初中知识点总结
一、语文知识点1.小说三要素:A人物B情节C环境2.议论文三要素:A论点B论据C论证3.比喻三要素:A本体B喻体C喻词4.记叙文六…
-
【人教版】初中数学九年级知识点总结:28锐角三角函数
【人教版】初中数学九年级知识点总结28锐角三角函数【编者按】本章内容主要学习正弦、余弦和正切等锐角三角函数的概念以及研究直角三角形…