高中化学计算公式总结
高中化学计算公式总结
1. 
2.  3.
3. 
4. 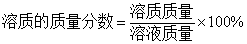 5.
5. 
6. 
7. 物质的量浓度与质量分数的关系: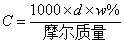

8. 用C表示的稀释公式或浓缩公式: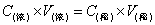
9. 同种溶液不同物质的量浓度溶液混合公式:
 ( 体积变化忽略不计)
( 体积变化忽略不计)

 10. 气体平均相对分子质量:
10. 气体平均相对分子质量:
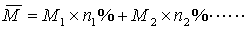
 11.
11.  (25℃)
(25℃)  (100℃)
(100℃)

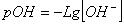
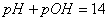
12. 气态方程:①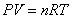 ②
②
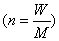
③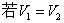

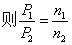 ④
④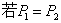

 ⑤
⑤
13. 标准状况下气体摩尔质量=22.4×标况下的密度 (此公式也可求相对分子质量)
14. 利用相对密度求摩尔质量(相对分子质量) A对B的相对密度为d,则有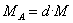
15. 
16.
17. 
18. 
19. “万能公式”: ?
?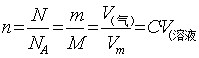 ?
?
20. 烷烃燃烧的通式: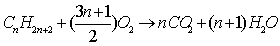
21. 烯烃燃烧的通式: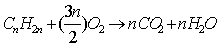
22. 炔烃燃烧的通式: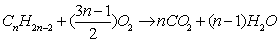
23. 苯及其同系物燃烧的通式:
24. 烃燃烧的通式:
? ?
?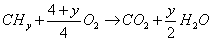
25. 醇燃烧的通式:
26. 醛燃烧的通式:
27. 羧酸或酯燃烧的通式:
28. 含C、H、O的有机物燃烧的通式:
29. 二元羧酸燃烧的通式: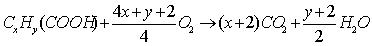
30. n价金属与酸反应的通式: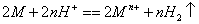
31. n价金属与水反应的通式: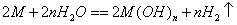
32. 金属显X价的金属氧化物与 溶液反应的通式:
溶液反应的通式:
33. CO还原金属氧化物的通式: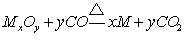
34. 化学平衡常数表达式: ;在一定温度下达到平衡时:
;在一定温度下达到平衡时:
35. 电离平衡常数表达式: ,平衡常数
,平衡常数
36. 水的离子积:
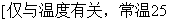 ℃
℃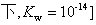
第二篇:高中化学常用公式总结
高中化学常用公式总结
1. 有关物质的量(mol)的计算公式
(1)物质的量(mol)
(2)物质的量(mol)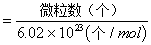
(3)气体物质的量(mol)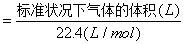
(4)溶质的物质的量(mol)=物质的量浓度(mol/L)×溶液体积(L)
2. 有关溶液的计算公式
(1)基本公式
①溶液密度(g/mL)
②溶质的质量分数
③物质的量浓度(mol/L)
(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:
①溶质的质量分数
②物质的量浓度
(3)溶液的稀释与浓缩(各种物理量的单位必须一致):
①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变)
②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c(浓)·V(浓)=c(稀)·V(稀)]
(4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)
3. 有关溶解度的计算公式(溶质为不含结晶水的固体)
(1)基本公式:
①
②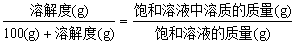
(2)相同温度下,溶解度(S)与饱和溶液中溶质的质量分数(w%)的关系:


(3)温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m的计算:

(4)降低热饱和溶液的温度,析出晶体的质量m的计算:

4. 平均摩尔质量或平均式量的计算公式
(1)已知混合物的总质量m(混)和总物质的量n(混):
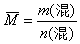
说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。
(2)已知标准状况下,混合气体的密度 (混):
(混):
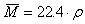 (混)
(混)
注意:该方法只适用于处于标准状况下(0℃, )的混合气体。
)的混合气体。
(3)已知同温、同压下,混合气体的密度与另一气体A的密度之比D(通常称作相对密度):

则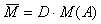
5. 化学反应速率的计算公式
(1)某物质X的化学反应速率:
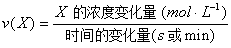
(2)对于下列反应:
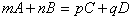
有
或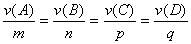
6. 化学平衡计算公式
对于可逆反应:
(1)各物质的变化量之比=方程式中相应系数比
(2)反应物的平衡量=起始量-消耗量
生成物的平衡量=起始量+增加量
表示为(设反应正向进行):
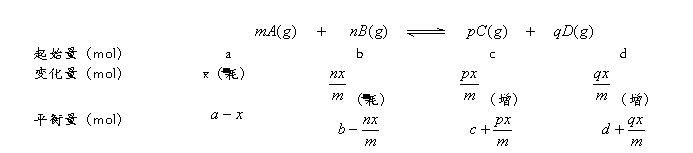
(3)反应达平衡时,反应物A(或B)的平衡转化率(%)

说明:计算式中反应物各个量的单位可以是mol/L、mol,对于气体来说还可以是L或mL,但必须注意保持分子、分母中单位的一致性。
(4)阿伏加德罗定律及阿伏加德罗定律的三个重要推论。
①恒温、恒容时: ,即任何时刻反应混合气体的总压强与其总物质的量成正比。
,即任何时刻反应混合气体的总压强与其总物质的量成正比。
②恒温、恒压时: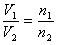 ,即任何时刻反应混合气体的总体积与其总物质的量成正比。
,即任何时刻反应混合气体的总体积与其总物质的量成正比。
③恒温、恒容时: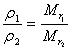 ,即任何时刻反应混合气体的密度与其反应混合气体的平均相对分子质量成正比。
,即任何时刻反应混合气体的密度与其反应混合气体的平均相对分子质量成正比。
(5)混合气体的密度
(6)混合气体的平均相对分子质量 的计算。
的计算。
①
其中M(A)、M(B)……分别是气体A、B……的相对分子质量;a%、b%……分别是气体A、B……的体积(或摩尔)分数。
②
7. 溶液的pH值计算公式
(1)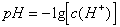
若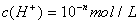 ,则
,则
若 ,则
,则
(2)任何水溶液中,由水电离产生的 与
与 总是相等的,即:
总是相等的,即:

(3)常温(25℃)时:
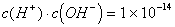
(4)n元强酸溶液中 ;n元强碱溶液中
;n元强碱溶液中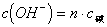
8. 有关物质结构,元素周期律的计算公式
8.1 原子核电荷数、核内质子数及核外电子数的关系
核电荷数=核内质子数=原子核外电子数
注意:阴离子:核外电子数=质子数+所带的电荷数
阳离子:核外电子数=质子数-所带的电荷数
8.2 质量数(A)、质子数(Z)、中子数(N)的关系

8.3 元素化合价与元素在周期表中的位置关系
(1)对于非金属元素:最高正价+|最低负价|=8(对于氢元素,负价为-1,正价为+1)。
(2)主族元素的最高价=主族序数=主族元素的最外层电子数。
9. 烃的分子式的确定方法
(1)先求烃的最简式和相对分子质量,再依(最简式相对分子质量)n=相对分子质量,求得分子式。
(2)商余法: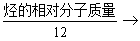 商为C原子数,余数为H原子数。
商为C原子数,余数为H原子数。
注意:一个C原子的质量=12个H原子的质量
10. 依含氧衍生物的相对分子质量求算其分子式的方法
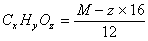 ,所得的商为x,余数为y。
,所得的商为x,余数为y。
注意:1个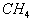 原子团的式量=1个O原子的相对原子质量=16
原子团的式量=1个O原子的相对原子质量=16

-
高中化学公式总结
1.碳与氧气(不足)的反应2C+O2====2CO碳与氧气(充足)的反应C+O2====CO22.一氧化碳与氧气的反应2CO+O2…
-
高中化学公式总结
高中化学公式总结非金属单质(F2,Cl2,O2,S,N2,P,C,Si)1.氧化性:F2+H2===2HF2F2+2H2O===4…
-
高中化学方程式总结_高考必备
一氯气的化学性质1氯气和金属单质反应KCaNaMgAlZnFeCu生成高价金属氯化物2Fe3Cl2FeCl3点燃CuClCuCl2…
-
高中化学公式大全
高中化学常用公式总结1.有关物质的量(mol)的计算公式(1)物质的量(mol)?物质的质量?g?物质的摩尔质量(g/mol)微粒…
-
高中化学公式大全
高中化学公式大全SO2SO2S6HNO3浓H2SO46NO22H2O3S4HNO3稀3SO24NO2H2ON2O22NO4P5O2…
-
20xx年高二化学期末教学工作总结
本学期,我担任高二C236,C243,C251三个班化学教学工作,现就一学期来的主要工作做以下总结:1.课前准备:备好课。把握课程…
-
高二化学备课组工作总结
高二化学备课组由6人组成,半年来,在化学组的指导下、充分发挥团结协作的精神,努力做好教学研究和集体备课功能,使高二化学教学质量有较…
-
高二化学工作总结
高中期末教学工作总结本学期,我担任高二化学教学工作。现就本学期的主要工作做以下总结:高中化学课程目标是:提高学生的科学素养为宗旨,…
-
高二化学教学总结
20xx-20xx学年第二学期教学工作总结段正强20xx年x月x日高二化学教学工作总结时间过得好快,一转眼,一学期又结束了.回想这…
-
高二化学总结
1、有机物的结构特点有机物结构有何特点?有机物种类为什么繁多?2、烃(1)烃的分类饱和链烃烷烃CnH2n+2(n≥1)不饱和链烃烯…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…