高一物理上学期知识点总结
高一物理上学期知识点总结
运动
1、质点:(1)没有形状、大小且有质量的点
(2)质点是一个理想化模型,实际并不存在
(3)一个物体是否能看成质点并不取决于这个物体的大小,而是看所研究的问题中物体的形状大小和物体上各部分运动情况的差异是否为可以忽略的次要因素,要具体问其具体分析。
2、路程和位移

4、速度、平均速度和瞬时速度(A)
(1)表示物体运动快慢的物理量,它等于位移s跟发生这段位移所用时间t的比值。即v=s/t。速度是矢量,既有大小也有方向,其方向就是物体运动的方向。在国际单位制中,速度的单位是(m/s)米/秒。
(2)平均速度是描述作变速运动物体运动快慢的物理量。一个作变速运动的物体,如果在一段时间t内的位移为s, 则我们定义v=s/t为物体在这段时间(或这段位移)上的平均速度。平均速度也是矢量,其方向就是物体在这段时间内的位移的方向。
(3)瞬时速度是指运动物体在某一时刻(或某一位置)的速度。从物理含义上看,瞬时速度指某一时刻附近极短时间内的平均速度。瞬时速度的大小叫瞬时速率,简称速率.
5、匀速直线运动(A)
(1) 定义:物体在一条直线上运动,如果在相等的时间内位移相等,这种运动叫做匀速直线运动。
根据匀速直线运动的特点,质点在相等时间内通过的位移相等,质点在相等时间内通过的路程相等,质点的运动方向相同,质点在相等时间内的位移大小和路程相等。
6、加速度(A)
(1)加速度的定义:加速度是表示速度改变快慢的物理量,它等于速度的改变量跟发生这一改变量所用时间的比值,定义式:
(2)加速度是矢量,它的方向是速度变化的方向
(3)在变速直线运动中,若加速度的方向与速度方向相同,则质点做加速运动; 若加速度的方向与速度方向相反,则则质点做减速运动.
力
1.力是物体对物体的作用。⑴力不能脱离物体而独立存在。⑵物体间的作用是相互的。
2.力的三要素:力的大小、方向、作用点。
3.力作用于物体产生的两个作用效果。使受力物体发生形变或使受力物体的运动状态发生改变。
4.力的分类:
⑴按照力的性质命名:重力、弹力、摩擦力等。
⑵按照力的作用效果命名:拉力、推力、压力、支持力、动力、阻力、浮力、向心力等。
12、重力(A)
1.重力是由于地球的吸引而使物体受到的力
⑴地球上的物体受到重力,施力物体是地球。 ⑵重力的方向总是竖直向下的。
2.重心:物体的各个部分都受重力的作用,但从效果上看,我们可以认为各部分所受重力的作用都集中于一点,这个点就是物体所受重力的作用点,叫做物体的重心。
① 质量均匀分布的有规则形状的均匀物体,它的重心在几何中心上。
② 一般物体的重心不一定在几何中心上,可以在物体内,也可以在物体外。一般采用悬挂法。
3.重力的大小:G=mg
13、弹力(A)
1.弹力⑴发生弹性形变的物体,会对跟它接触的物体产生力的作用,这种力叫做弹力。
⑵产生弹力必须具备两个条件:①两物体直接接触;②两物体的接触处发生弹性形变。
2.弹力的方向:物体之间的正压力一定垂直于它们的接触面。绳对物体的拉力方向总是沿着绳而指向绳收缩的方向,在分析拉力方向时应先确定受力物体。
3.弹力的大小:弹力的大小与弹性形变的大小有关,弹性形变越大,弹力越大.
弹簧弹力:F = Kx (x为伸长量或压缩量,K为劲度系数)
4.相互接触的物体是否存在弹力的判断方法:如果物体间存在微小形变,不易觉察,这时可用假设法进行判定.
14、摩擦力(A)
(1 ) 滑动摩擦力:
说明 : a、FN为接触面间的弹力,可以大于G;也可以等于G;也可以小于G
b、 为滑动摩擦系数,只与接触面材料和粗糙程度有关,与接触面
积大小、接触面相对运动快慢以及正压力FN无关.
(2 ) 静摩擦力: 由物体的平衡条件或牛顿第二定律求解,与正压力无关.
大小范围: O<f静fm (fm为最大静摩擦力,与正压力有关)
说明:
a 、摩擦力可以与运动方向相同,也可以与运动方向相反,还可以与运动方向成一定夹角。
b、摩擦力可以作正功,也可以作负功,还可以不作功。
c、摩擦力的方向与物体间相对运动的方向或相对运动趋势的方向相反。
d、静止的物体可以受滑动摩擦力的作用,运动的物体可以受静摩擦力的作用。
15、力的合成与分解(B)
1.合力与分力 如果一个力作用在物体上,它产生的效果跟几个力共同作用在物体上产生的效果相同,这个力就叫做那几个力的合力,而那几个力叫做这个力的分力。
2.共点力的合成
⑴共点力:几个力如果都作用在物体的同一点上,或者它们的作用线相交于同一点,这几个力叫共点力。
⑵力的合成方法 求几个已知力的合力叫做力的合成。
a.若 和 在同一条直线上
① 、 同向:合力 方向与 、 的方向一致
② 、 反向:合力 ,方向与 、 这两个力中较大的那个力同向。
b. 、 互成θ角——用力的平行四边形定则
平行四边形定则:两个互成角度的力的合力,可以用表示这两个力的有向线段为邻边,作平行四边形,它的对角线就表示合力的大小及方向,这是矢量合成的普遍法则。
注意:(1) 力的合成和分解都均遵从平行四边行法则。
(2) 两个力的合力范围: F1-F2 F F1 +F2
(3) 合力可以大于分力、也可以小于分力、也可以等于分力
(4)两个分力成直角时,用勾股定理或三角函数。
16、共点力作用下物体的平衡(A)
1.共点力作用下物体的平衡状态
(1)一个物体如果保持静止或者做匀速直线运动,我们就说这个物体处于平衡状态
(2)物体保持静止状态或做匀速直线运动时,其速度(包括大小和方向)不变,其加速度为零,这是共点力作用下物体处于平衡状态的运动学特征。
2.共点力作用下物体的平衡条件
共点力作用下物体的平衡条件是合力为零,亦即F合=0
(1)二力平衡:这两个共点力必然大小相等,方向相反,作用在同一条直线上。
(2)三力平衡:这三个共点力必然在同一平面内,且其中任何两个力的合力与第三个力大小相等,方向相反,作用在同一条直线上,即任何两个力的合力必与第三个力平衡
(3)若物体在三个以上的共点力作用下处于平衡状态,通常可采用正交分解,必有:
F合x= F1x+ F2x + ………+ Fnx =0
F合y= F1y+ F2y + ………+ Fny =0 (按接触面分解或按运动方向分解)
19、力学单位制(A)
1.物理公式在确定物理量数量关系的同时,也确定了物理量的单位关系。基本单位就是根据物理量运算中的实际需要而选定的少数几个物理量单位;根据物理公式和基本单位确立的其它物理量的单位叫做导出单位。
2.在物理力学中,选定长度、质量和时间的单位作为基本单位,与其它的导出单位一起组成了力学单位制。选用不同的基本单位,可以组成不同的力学单位制,其中最常用的基本单位是长度为米(m),质量为千克(kg),时间为秒(s),由此还可得到其它的导出单位,它们一起组成了力学的国际单位制。
牛顿定律
牛顿第一定律(惯性定律)
1. 内容:一切物体总保持匀速运动状态或静止状态,知道外力迫使它改变之中状态为止。
2. 一切物体都有保持匀速直线运动状态或静止状态的特性。
3. 物体运动状态的改变需要外力。
4. 惯性的定义:物体的这种保持原来的匀速直线运动或静止状态的性质叫做惯性。
5. 一切物体都具有惯性,物体的运动并不需要力来维持。
6. 惯性是物质的固有属性,不论物体处于什么状态,都具有惯性。
牛顿第二定律
1. 内容:物体的加速度跟所受的合外力大小成正比,跟物体的质量成反比,加速度的方向跟合外力的方向相.
2. 表达式:F=ma
(1) 定律的表达式虽写成F=ma,但不能认为物体所受外力大小与加速度大小成正比,与物体质量成正比
(2) 式中的F是物体所受的合外力,而不是其中的某一个力当然如果F是某一个力或某一方向的分量,其加速度也是该力单独产生的或者是在某一方向上产生的
3.(1)如果合外力的方向与物体运动的方向相同,则加速度的方向与运动方向相同,这时物体
(2)如果合外力的方向与物体运动的方向相反,则加速度的方向与运动方向相反,这时物体做减速运动。
(3)如果合外力不变(恒定),则加速度也不变(恒定),这时物体做匀变速直线运动。
(4)如果合外力为零,则加速度也为零,这时物体做匀速直线运动或处于静止状态。
牛顿第三定律
1. 两个物体之间力的作用总是相互的。我们把其中一个力叫做作用力,另一个力就叫做反作用力。
2. 作用力与反作用力的特点
(1) 作用在两个物体上
(2) 具有同种性质
(3) 同时产生,同时消失。
(4) 在同一直线上,方向相反。
3. 作用力和反作用力与平衡力的异同

物理公式
运动学
1.平均速度V平=S/t (定义式) 2.有用推论Vt^2 –Vo^2=2as
3.中间时刻速度 Vt/2=V平=(Vt+Vo)/2 4.末速度Vt=Vo+at
5.中间位置速度Vs/2=[(Vo^2 +Vt^2)/2]1/2 6.位移S= V平t=Vot + at^2/2=Vt/2t
7.加速度a=(Vt-Vo)/t 以Vo为正方向,a与Vo同向(加速)a>0;反向则a<0
8.实验用推论ΔS=aT^2 ΔS为相邻连续相等时间(T)内位移之差
9.主要物理量及单位:初速(Vo):m/s
加速度(a):m/s^2 末速度(Vt):m/s
2) 自由落体
1.初速度Vo=0
2.末速度Vt=gt
3.下落高度h=gt^2/2(从Vo位置向下计算)
4.推论Vt^2=2gh
6. 对于初速度为零的匀加速直线运动有下列规律成立:
(1). 1T秒末、2T秒末、3T秒末…nT秒末的速度之比为: 1 : 2 : 3 : … : n.
(2). 1T秒内、2T秒内、3T秒内…nT秒内的位移之比为: 12 : 22 : 32 : … : n2.
(3). 第1T秒内、第2T秒内、第3T秒内…第nT秒内的位移之比为: 1 : 3 : 5 : … : (2 n-1).
(4). 第1T秒内、第2T秒内、第3T秒内…第nT秒内的平均速度之比为: 1 : 3 : 5 : … : (2 n-1).
牛顿运动定律
1. 牛顿第二定律: F合= ma
注意: (1)同一性: 公式中的三个量必须是同一个物体的.
(2)同时性: F合与a必须是同一时刻的.
(3)瞬时性: 上一公式反映的是F合与a的瞬时关系.
(4)局限性: 只成立于惯性系中, 受制于宏观低速.
2. 整体法与隔离法:
整体法不须考虑整体(系统)内的内力作用, 用此法解题较为简单, 用于加速度和外力的计算. 隔离法要考虑内力作用, 一般比较繁琐, 但在求内力时必须用此法, 在选哪一个物体进行隔离时有讲究, 应选取受力较少的进行隔离研究.
3. 超重与失重:
当物体在竖直方向存在加速度时, 便会产生超重与失重现象. 超重与失重的本质是重力的实际大小与表现出的大小不相符所致, 并不是实际重力发生了什么变化,只是表现出的重力发生了变化.
力
重力:G = mg
摩擦力:
(1) 滑动摩擦力:f = μFN 即滑动摩擦力跟压力成正比。
(2) 静摩擦力:①对一般静摩擦力的计算应该利用牛顿第二定律,切记不要乱用
f =μFN;②对最大静摩擦力的计算有公式:f = μFN (注意:这里的μ与滑动摩擦定律中的μ的区别,但一般情况下,我们认为是一样的)
力的合成与分解:
(1) 力的合成与分解都应遵循平行四边形定则。
(2) 具体计算就是解三角形,并以直角三角形为主。
物体平衡
1. 物体平衡条件: F合 = 0
2. 处理物体平衡问题常用方法有:
(1). 在物体只受三个力时, 用合成及分解的方法是比较好的. 合成的方法就是将物体所受三个力通过合成转化成两个平衡力来处理; 分解的方法就是将物体所受三个力通过分解转化成两对平衡力来处理.
(2). 在物体受四个力(含四个力)以上时, 就应该用正交分解的方法了. 正交分解的方法就是先分解而后再合成以转化成两对平衡力来处理的思想.
第二篇:高一化学上册知识小结
高一化学上册知识小结
1)
2)
3) 化学小结之一:第二周期元素中,电子总数为10的小结 分子 CH4 NH3 H2O HF Ne(原子) +2+3++++离子 阳离子Na 、Mg 、Al 、NH4、 H3O 、H2F 3—2— ——— 阴离子N 、O 、F 、OH 、NH2 ++++注意 A. 11个质子10个电子有 Na NH4 H3O H2F
B. 10个质子10个电子有 CH4 NH3 H2O HF Ne
——— C. 9个质子10个电子有 F OH NH2
其中A、B、C具有相同的质子数和电子数的微粒,注意单核与多核之分别。
化学小结之二:关于漂白小结
SO2漂白 有色物质+SO2无色物质(加热后分解又有色)
Na2O2、H2O2 、HClO(潮湿氯气、漂白粉)漂白 有色物质被氧化褪色
浓HNO3 石蕊→变红→氧化褪色 (非漂白) 活性炭、硅藻土 吸附有色物质 (非漂白) 化学小结之三:溶解性归类(主要针对硫化物)
不溶于水,不溶于稀酸(HCl、H2SO4的) 如: CUS CU2S Hg2S Ag2S HgS(前者均为黑色) AgCl BaSO4(注:可发生弱酸制取强酸特例如H2S+CUSO4==CUS↓+ H2SO4)
不溶于水,溶于稀酸(HCl、H2SO4的) 如FeS ZnS MnS 不溶性碳酸盐CaCO3 BaCO3,亚硫酸盐、硅酸盐……CaCl2+CO2+H2O不反应弱酸不能制取强酸。
3)溶于水,溶于稀酸的(发生反应) 如K2S Na2S (NH4)2S
化学小结之四:离子组不能大量共存的规律小结
结合生成沉淀而不能大量共存
+-2+2-2+2-2+2-2+2-2+-Ag 与Cl 、Ba 与SO4 、Ca 与CO3 、Ba与CO3 、Fe 与S 、Cu与OH 、 3+-+2-+2-Fe与OH 、H 与S2O3、H 与SiO3
结合生成气体而不能大量共存
+2-+2-+2-+-+-H 与S、H 与SO3、H 与CO3、H 与HCO3、NH4与OH
结合生成难电离的物质而不能大量共存
+-+2-+-+-+-H 与OH、H 与S、、H 与ClO、H 与 CH3COO、NH4与OH
发生氧化还原反应而不能大量共存
3+2-3+-----+2-Fe与S、Fe与I 、MnO4与Br、 MnO4与I、H 与S2O3、
2-2+-+SO3与氧化剂、Fe与NO3(H)
结合生成络合物而不能大量共存
3+-+-++-2++-3+-Fe与C6H5O、Ag 与CN、Ag 与NH4(OH)、Cu与NH4(OH) 、Fe与SCN 因互相促进水解而不能大量共存
3+2-3+-3+3+2-+-3+-Al 与CO3、Al 与HCO3、(Fe同) 、Al与S、NH4与AlO2、Al与AlO2
+-弱酸式根离子不能和H 或OH大量共存
+---+-----+-H 与HCO3、OH与HCO3、H 与HS、OH 与HS、OH与H2PO4、H与H2PO4
3+2+2+-题中明确为无色而不能存在 Fe(棕黄色)、Fe(绿色)、Cu(蓝色)、MnO4(紫色)
+-隐含条件:PH=0(强酸性)即大量H;PH=14(强碱性)即大量OH。
+-12--12水中电离出H=10或OH=10时,可能是酸性或碱性。
化学小结之五: 熔沸点大小比较规律
一、从晶体类型看1)一般原子晶体最大,离子晶体、金属晶体次之,分子晶体最小。
2)原子晶体中:原子半径小、键短、键能大熔沸点高,如C-C、C-SI SI-SI
3)离子晶体中:原子半径小、离子电荷高、键能大熔沸点高, 如NaF>NaCI>NaBr>NaI 如MgCI2>NaCI 如X+CI2=XCI2+Q1 Y+CI2=YCI2+Q2 Q1>Q2键能XCI2>YCI2
4)金属晶体中:原子半径小、金属性弱、价电子多熔沸点高,如锂>钠>钾>铷>铯 如铝>镁>钠5)分子晶体中:结构组成相似的,分子量大熔沸点高,如C1-4气C5-16液C16以上固 如F2<CI2<Br2<I2 氦<氖<氩<氪<氙(单原子分子,不含化学键)
1 1) 2) 3) 1) 2) 1) 2) 3) 4) 5) 6) 7) 8) 9)
如:烃<卤代烃(氯代烃<溴代烃<碘代烃)<醇<羧酸(含有氢键)
6)存在氢键的一般熔沸点高,如HF>HI>HBr>HCI如H2O>H2Te>H2Se>H2S 注意:分子间形成氢键,熔沸点反而低。如邻羟基苯甲酸。
二、从状态上看:常温下 固态>液态>气态 如I2 >H2O>HCI
三、从结构上看:
直链的、排列紧密的熔沸点高,如:正丁烷>异丁烷。
化学小结之六:离子化合物小结1,物质中有阴离子必有阳离子,但有阳离子不一定有阴离子(如合金及金属)。
2,共价化合物中一定无离子键,离子化合物中不一定无共价键。
3,离子、原子晶体中一定无分子存在,亦无范德华力,只有分子晶体中存在范德华力,唯一无共价键的是稀有气体晶体。
4,非金属元素间一般不能形成离子化合物,但铵盐却是离子化合物。
5,构成分子的稳定性与范德华力无关,由共价键强弱决定。分子的熔沸点才与范德华力有关,且随着分子间作用力增强而增高。
6,原子晶体的熔沸点不一定比金属高,金属的熔沸点也不一定比分子晶体高。
7,由同种非金属元素的原子间形成的化学键为非极性键,由不同种非金属元素的原子间形成的化学键为极性键。较弱的金属和非金属间形成的键亦有可能是极性键(如AlCl3)。
-+2+2--+2+3+2--+2+8. 电子层结构相同的离子:H、Li、Be(与He);O、F、Na、Mg、Al(与Ne);S、Cl、K、Ca(与Ar)。
9.含有离子键、共价键、配位键的离子化合物有:NH4Cl铵盐类
10.含有非极性和键极性分子有:H2O2乙烯、乙炔等
11.含有极性键的非极性分子有:CCl4、CO2、CH4
12.离子化合物中一定含有离子键13.含极性共价键的离子化合物:碱、含氧酸盐、铵盐
14.含非极性共价键的离子化合物:Na+[O-O]2-Na+、过氧化钾、FeS2、CaC2电石、苯酚钠
15. 含阳离子的晶体可以是离子晶体,也可以是金属晶体。
16.全部是非金属元素可以形成的离子化合物:NH4NO3、NH4Cl等。
化学小结之七:常温下不共存气体小结
1.H2S与SO2 ;2.NH3与HCl(HBr、HI) 3.NO与O2 4. H2S(HBr、HI)与Cl2 (F2) 5.H2与F2
化学小结之八:单质与碱溶液的反应
1. 生成氢气:2Al+2NaOH+2H2O===2NaAlO2+3H2↑ Zn+2NaOH+H2O===Na2ZnO2+2H2↑Si+2NaOH+H2O===Na2SiO3+2H2↑
2. 发生岐化反应:Cl2+2NaOH===NaCl+NaClO+ H2O 3Cl2+6NaOH===5NaCl+NaClO3+ 3H2O
3Br2+6NaOH===5NaBr+NaBrO3+ 3H2O 3I2+6NaOH===5NaI+NaIO3+ 3H2O
3S+6NaOH===2Na2S+Na2SO3+ 3H2O
3.跟水反应:Na、K、Ca、F2等2H2O+2F2==4HF+O2
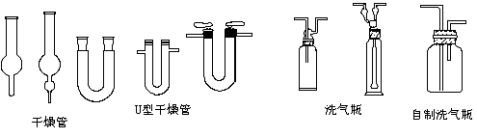
化学小结之九:气体干燥除杂质1. 氢气中含氯化氢和水:依次通过盛饱和食盐水的洗气瓶;盛浓硫酸的洗气瓶
2. 二氧化碳中含氯化氢和水:依次通过盛饱和碳酸氢钠的洗气瓶;盛浓硫酸的洗气瓶
3. 二氧化碳中含二氧化硫: 依次通过盛饱和碳酸氢钠的洗气瓶;盛浓硫酸的洗气瓶
4. 硫化氢中含氯化氢和水:依次通过盛饱和NaHS的洗气瓶;盛五氧化二磷或无水氯化钙的干燥管
5. 氨气中有水:盛碱石灰(NaOH、CaO)的干燥管
6. 氯气中含氯化氢和水:依次通过盛饱和食盐水的洗气瓶;盛浓硫酸的洗气瓶
化学小结之十:化学键与晶体结构
从整体上认识化学键与晶体结构的相互关系:

2
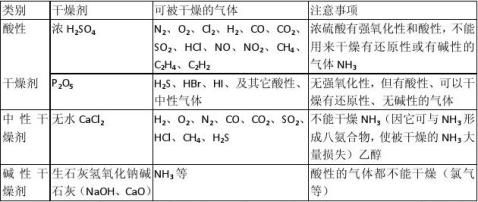
化学小结之十一:气体的干燥:常用干燥剂及其应用注意事项
化学小结之十二:液氯、氯水与盐酸区别
液态的氯气称液氯,分子式为Cl2,属纯净物,呈黄绿色. 氯水为氯气的水溶液,由于部分Cl2与水发生反应:Cl2+H2O == HCl+HClO,所以,成分复杂存在三种分子,H2O、Cl2、HCl0、
+---(O2忽略)和四种离子:H、Cl、ClO、OH由于HClO分子不稳定,在光和热条件下分解为HCl和O2,所以新制氯水中Cl2、
++
HClO多H离子少,故氧化性强,酸性弱,久置氯水,Cl2、HClO少,H浓度大,所以,PH值降低,氧化性弱,酸性强,
+
甚至完全转化为稀盐酸.氯水呈酸性,能使石蕊试纸变红,这是H与之作用的结果,但变红的试纸又会慢慢地褪为无色,这是HClO氧化的结果.
+-+-
盐酸是HCl的水溶液,存在H2O分子,H与

Cl.无HCl分子存在。(区别液态HCl,只有HCl分子,无H与Cl、H2O分子,纯净物。)

4CCl4中橙红色;也有其他颜色
化学小结之十四:HX X2的实验室制法反应原理
(1)HF:CaF2+浓H2SOCaSO4+2HF ↑
铝皿
(2) HCl:NaCl(固)+浓H2SONaHSO4+HCl↑ 2NaCl(固)+浓H2SO4 Na2SO4+2HCl ↑ (3) HBr: NaBr+H3PO4(2PO4+HBr ↑ (4) HI:KI+H3PO4(浓) KH2PO4+HI↑ X2(除F2外)的实验室制法
3
(1) Cl2
①MnO2+4HCl
(浓)2+2H2O+Cl2 ↑ ②2KMnO4+16HCl(浓)==2KCl+2MnCl2+8H2O+5Cl2 ↑ ③2NaCl+3H2SO4(浓)+MnO2NaHSO4+Mn SO4+2H2O+Cl2 ↑
或:2NaCl+2H2SO4(浓)+MnONa2SO4+MnSO4+2H2O+Cl2 ↑
(2)Br2
①2KBr+Cl2 ==2KCl+Br2 ②4NaBr+2H2SO4(浓)+MnO2 2SO4+MnBr2+Br2+2H2O 或2NaBr+2H2SO4(浓)+MnO4+ MnSO4+Br2+2H2O
(3) I2
① 2Kl+Cl2== 2KCl+I2 ② 2Kl+Br2 ==2KBr+I2
化学小结之十五:能使KI-淀粉试纸变蓝的有
Cl2 、Br2、I2、NO2、O3、HNO2、氧化剂(HNO3、KMnO4、FeCl3……) 注:Br2蒸气和NO2都棕红色区别用AgNO3溶液
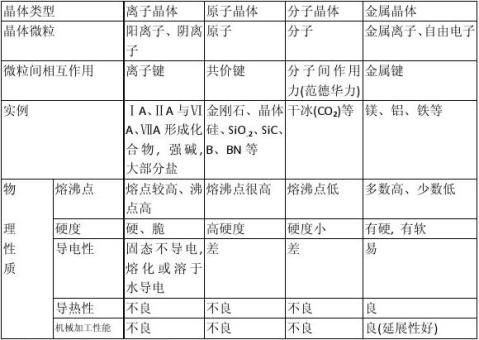
化学小结之十六:四类晶体的比较
化学小结之十七:类(拟)卤物质1)
2) (CN)2 (SCN)2 、ICl 、 IBr 、 BrCl(后三者与水反应是非氧化反应) 基础 Cl2+H2O== HCl+ HClO Cl2+2NaOH==NaCl+NaClO+H2O
MnO2+4 HCl(浓) MnCl2+Cl2↑+2H2O
3) 推论1 (CN)2+H2O== H CN + H CNO (CN)2 +2NaOH==Na CN +Na CNO+H2O
MnO2+4 HCN(浓) Mn(CN)2 +(CN)2↑+2H2O
4) 推论2 ICl +H2O== HCl + H IO ICl +2NaOH==NaCl +NaIO +H2O
2 Mg+2 ICl== MgCl2 + MgI2
化学小结之十八:卤素单质及化合物的特性
F元素:
①最外层电子数比次外层多5个; ②除H后前18号元素中原子半径最小; 4
③无正价; ④不能被任何物质氧化; ⑤能与水反应置换水中的氧;
⑥CaF2难溶、AgF溶于水; ⑦无含氧酸;⑧HF为弱酸。
Cl元素:
①最外层比次外层少一个电子,比最内层多5个电子; ②有多种化合价—1、+1、+3、+5、+7; ③对应的含氧酸有HClO、HClO2、HClO3、HClO4; ④HClO4是目前发现的含氧酸中的最强酸。 其他
(1)F原子半径小,获电子能力强,是最强的非金属单质,无正价、F与氧的化合物为OF2,无含氧酸.
(2) F2与H2反应剧烈,低温暗处发生爆炸.
(3) F2可以与稀有气体中的Xe、Kr等作用生成相应的氟化物、XeFe2、XeF4、XeF6等.
(4)HF的分子量小于HCl,但沸点较HCl高,这里HF分子间形成氢键缘故.
沸点HF> HI >HBr> HCl
(5) 酸性Hl>HBr>HCl>HF(弱酸)
稳定性HF>HCl>HBr>Hl,其生成由易 →难为:HF>HCl>HBr>HI
(6)AgCl(白)AgBr(浅黄)、Agl(黄),但AgF为无色晶体,前几者都不溶于水,也不溶于HCl 和HNO3,但AgF能溶于水得无色溶液。
(7) F2、HF气体与氢氟酸均能腐蚀玻璃,不能用玻璃容器盛装.
SiO2+2F2 ===SiF4↑ + O2↑ SiO2+4HF=== SiF4 ↑+2H2O
(8) 氧化性比较:F2 >O2,故能置换出水中的氧F2+2H2O==4HF+O2↑ F2能分解水放出O2,故F2不能从其他卤素化合物的水溶液中将其他的卤素单质置换出来.
(9) 氯气、液氯均无漂白性.氯水中因为存在HClO分子,该分子见光分解,放出氧化性极强的新生态O2,能使许多有色有机物褪色,即漂白.
(10) HClO4是最强的酸,其酸酐Cl2O7,不能用Cl2与O2直接制备,酸性HClO4>HClO3>HClO2>HClO,氧化性HClO>HClO2>HClO3>HClO4,稳定性HClO4>HClO3>HClO2>HClO.
(11) Br2在常温下为液态,并且是唯一的一种液态非金属单质.
(12) 液态Br2有剧毒,易挥发,故要用蜡严密封闭保存在磨口玻璃瓶中,还可加少许水作保护剂以抑制Br2挥发.
(13) 溴蒸气与NO2气体同是红棕色气体,均能使湿润的KI淀粉试纸变蓝,因此不能用KI淀粉试纸鉴别,可用水或AgNO3溶液或CCl4鉴别.
(14) 碘水能使淀粉变蓝,I2晶体易升华,是固体单质中唯一双原子分子.I2(紫黑色)易升华,Br2(红棕色)易挥发,CI2(黄绿色)易液化,F2(浅黄绿色)(原因X2分子晶体,结构相似,分子量大,熔沸点高) CaX2中,除CaF2难溶于水外,其余都易溶于水
化学小结之十九:比较微粒半径大小的几条规律
1)
2)
3) 同一周期主族元素的原子半径,由左至右逐渐变小 同一主族元素的原子半径,由上至下逐渐增大(电子层多半径大) 同一原子:原子半径比它的阳离子半径大,原子半径比它的阴离子半径小
如rNa>rNa rCl<rCl-
4) 电子层结构相同的离子,核电荷数大的离子半径小或离子电荷数高的离子半径小
如N3 >O2>F>Ne>Na> Mg2>Al3 ———++++
5) 同一元素的原子的不同离子,电荷大离子半径小如Fe2>Fe3
++
5
-
高一物理上学期知识点总结
高一物理上学期知识点总结运动1质点1没有形状大小且有质量的点2质点是一个理想化模型实际并不存在3一个物体是否能看成质点并不取决于这…
-
高一物理上学期知识点总结
asaaer高一物理上学期知识点总结运动1质点1没有形状大小且有质量的点2质点是一个理想化模型实际并不存在3一个物体是否能看成质点…
-
高一上物理知识点总结
高一上物理期末考试知识点复习提纲1质点A1没有形状大小而具有质量的点2质点是一个理想化的物理模型实际并不存在3一个物体能否看成质点…
-
高一物理上学期知识点总结
第一章运动的描述第一节认识运动机械运动物体在空间中所处位置发生变化这样的运动叫做机械运动运动的特性普遍性永恒性多样性参考系1任何运…
-
高一物理上期知识点总结
高一上物理期末考试知识点复习提纲1.质点(A)(1)没有形状、大小,而具有质量的点。(2)质点是一个理想化的物理模型,实际并不存在…
-
高二物理上册知识点总结
高二物理知识点总结第八章电场一、三种产生电荷的方式1、摩擦起电:(1)正点荷:用绸子摩擦过的玻璃棒所带电荷;(2)负电荷:用毛皮摩…
-
高一上学期物理教学工作总结
20xx-20xx第一学期高一物理教学工作总结高一物理组对于新课改背景下的物理教学,教师的作用不应该是“知识传授者”,而应成为学生…
-
高一物理上期知识点总结
高一上物理期末考试知识点复习提纲1.质点(A)(1)没有形状、大小,而具有质量的点。(2)质点是一个理想化的物理模型,实际并不存在…
-
高一上学期物理教学总结
紧张忙碌的高一上学期结束了。回首半年来的物理教学工作,可以说有欣慰,更有许多无奈。这是第3次带高一,虽说对教材内容比较熟悉,并且也…
-
沪科版_高一化学下学期知识点总结
高一下学期化学期末复习要点一硫氮单质及化合物一硫单质S黑火药的使用S2KNO33CK2S3CO2N21硫的物理性质硫是淡黄色晶体脆…
-
高一物理知识点总结
高一上物理期末考试知识点复习提纲1质点A1没有形状大小而具有质量的点2质点是一个理想化的物理模型实际并不存在3一个物体能否看成质点…