高中化学 必修一第四章知识点总结(详细)
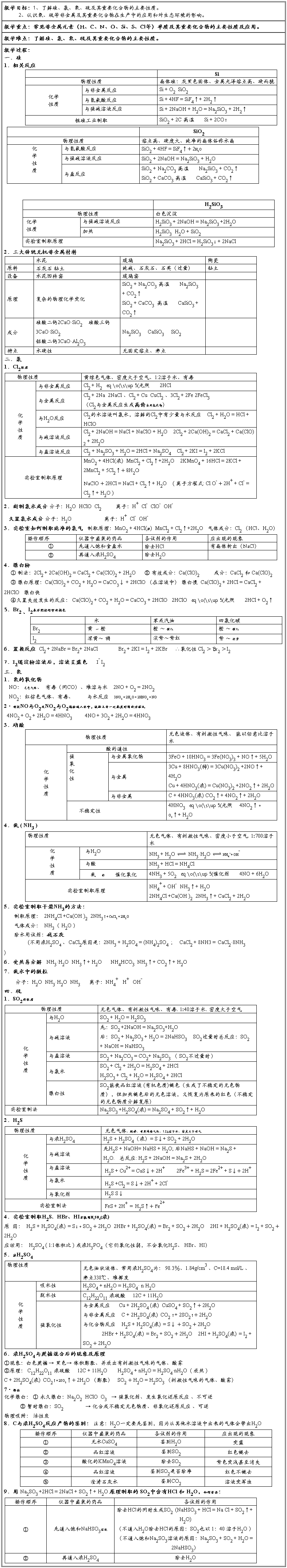
第二篇:高中化学必修一第四章__非金属及其化合物知识点总结
第四章 非金属及其化合物
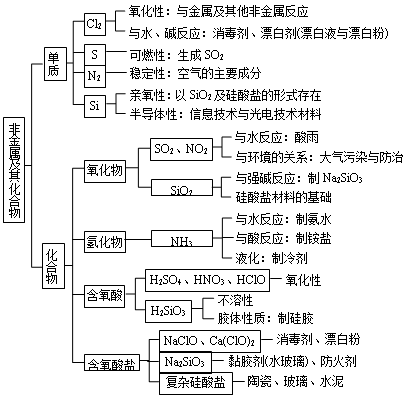 【内容结构】
【内容结构】
【知识要点】
一、硅及其化合物的相互转化

二、氯及其化合物的相互转化

 三、硫及其化合物的相互转化
三、硫及其化合物的相互转化
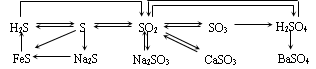
四、氮及其化合物的相互转化

二、本章知识结构梳理
(一) 硅及其化合物
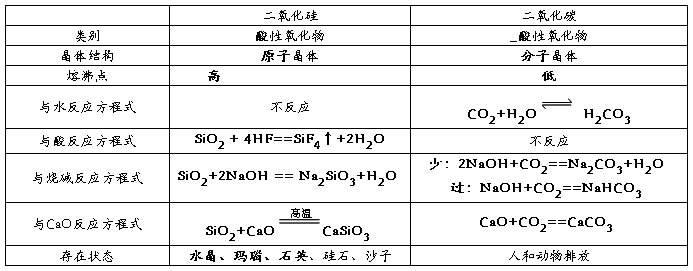
1、二氧化硅和二氧化碳比较
2、硅以及硅的化合物的用途

(二) 氯
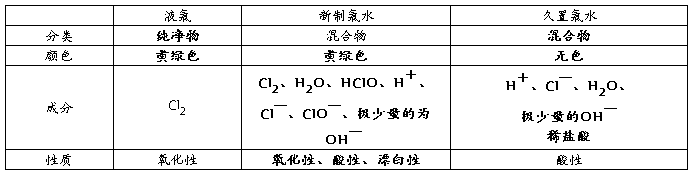
1、液氯、新制的氯水和久置的氯水比较
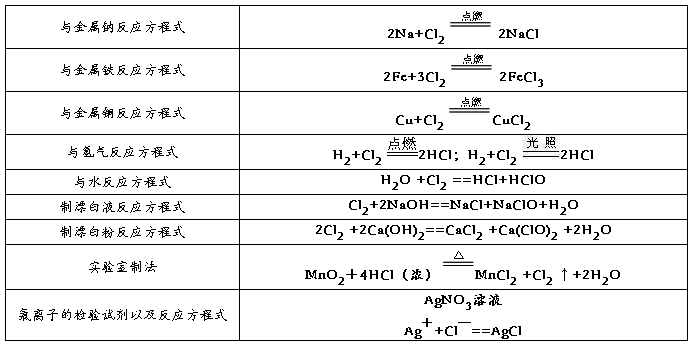
2、氯气的性质
(三) 硫、氮
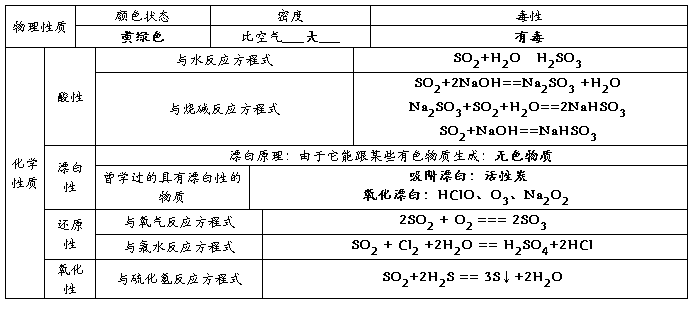
1、二氧化硫的性质
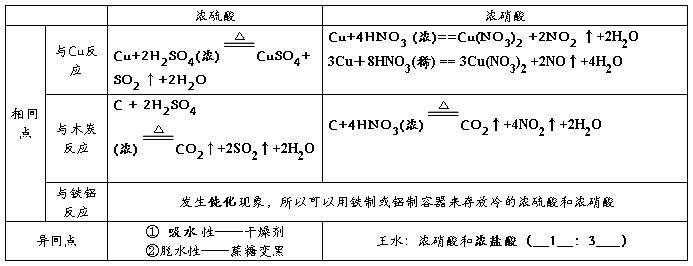
2、浓硫酸和浓硝酸的性质
3、氨气、氨水与铵盐的性质
高中化学必修一第四章 非金属及其化合物
二氧化硅
1结构:二氧化硅晶体是由氧原子和硅原子构成的,在二氧化硅晶体中无二氧化硅晶体。在晶体中每个硅原子与四个氧原子结合,每个氧原子与两个硅原子结合,向空间网状结构,即二氧化硅晶体由硅原子和氧原子按1:2的比例组成的空间网状结构晶体
2物理性质:二氧化硅具有硬度大、熔点高、不溶于水、不导电等性质,纯净的二氧化硅晶体无色透明
3化学性质:
① 二氧化硅是酸性氧化物,能与碱和碱性氧化物反应,
如:
② 弱氧化性:
③ 特性二氧化硅是酸性氧化物,却能与氢氟酸发生反应:
4用途:制备高性能通讯材料光导纤维;制备石英玻璃、石英钟;制造电子工业中的重要部件、光学仪器、精密仪器、轴承、耐磨器皿;装饰品
硅酸:硅酸是一种弱酸,比碳酸还弱,切难溶于水。通过复分解反应制的硅酸形成胶体溶液,进一步形成凝胶,硅酸凝胶经干燥脱水可形成常用作干燥剂的“硅胶”
硅酸的制备:
硅酸盐
1硅酸盐是由硅、氧和金属组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都不溶于水。化学性质稳定,是地壳岩石的主要成分
2最简单最常用的硅酸盐是硅酸钠,其水溶液熟称水玻璃,其化学性质稳定,不能燃烧,不易被腐蚀,热稳定性强,有粘性。可用作建筑材料、纸张粘合剂,木材织物的防腐剂、防火剂
3硅酸盐由于组成比较复杂,通常用二氧化硅和金属氧化物的形式表示其组成。如:Na2SiO3→Na2O.SiO2
氯气
氯气通常状况下呈黄绿色,是一种具有强烈刺激性气味的有毒气体,化学性质活泼,具有较强的氧化性
1氯气与金属反应(除金、铂外)
① 产生黄色的火焰和大量白烟
② 产生大量棕色气体
③ 产生大量棕色的烟
2氯气与氢气反应
方程式:
氢气在氯气中燃烧,发出苍白火焰。氢气燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,及其瓶口处有白雾
3氯气和水反应
氯气的水溶液叫氯水。氯气与水反应生成盐酸和次氯酸,氯气既是氧化剂又是还原剂
方程式:
① 氯水的成分:三分子(水分子,氯气、次氯酸分子)四离子(氢离子、氯离子、次氯酸根离子、少量氢氧根离子)
② 颜色:新制的饱和的氯水呈浅黄绿色
③ 因含有盐酸和次氯酸而成酸性,但主要是由于盐酸
④ 沉淀性:与银离子反应生成沉淀
⑤ 强氧化性因含有次氯酸和氯气而呈强氧化性,但氧化性主要由次氯酸决定,氯气的强氧化性决定它具有漂白性
⑥ 不稳定性:由于次氯酸:
4氯气与碱反应:
方程式:
① 吸收多余的氯气用氢氧化钠
② 漂白粉的有效成分是次氯酸钙
5氯气与某些还原性物质的反应
氯气具有强氧化性,可与二氧化硫,亚硫酸根,硫离子、溴离子、碘离子、亚铁离子等具有还原性的微粒发生氧化还原反应
6氯气的用途:自来水杀菌;制造盐酸;制造漂白剂;合成塑料、橡胶、人造纤维;农药、燃料、药品。
氯气的实验室制法
方程式:
制得的气体含有盐酸和水,因此分别通过饱和食盐水、浓硫酸(氯化钙)等进行除杂。气体用向上排空气法或排饱和食盐水法收集。尾气用氢氧化钠吸收。
卤素
1卤素包括氟氯溴碘
2卤素均具有强氧化性,并且氟>氯>溴>碘>爱
3化学性质:
① 与金属反应:卤素都能与金属反应生成金属卤化物
② 都与氢气反应生成对应的酸
③ 与水反应:
④ 与碱反应:
二氧化硫:
1物理性质:无色、有刺激性气味的有毒气体,密度比空气大,易于液化
2化学性质:
① 与水反应生成显酸性的物质,具有漂白作用,但漂白后新物质不稳定,受热易恢复原色
② 常见的能被二氧化硫漂白的物质有:品红溶液、白纸浆、毛、丝、草帽辫。但二氧化硫不能漂白酸碱指示剂
③ 二氧化硫的氧化性和还原性
与氧气反应: 与氯气反应:
与溴反应: 与碘反应:
与硫化氢反应:
亚硫酸根与氯气反应:
亚硫酸与氯气反应:
亚硫酸根与氧气反应:
亚硫酸与氧气反应:
氮的重要氧化物NO和NO2
1 一氧化氮:无色无味气体,不溶于水,易被氧气氧化,方程式:
(反应现象:无色气体变成红棕色有刺激性气味的气体),有毒,能与血红蛋白结合2二氧化氮:红棕色气体,有刺激性气味,有毒,刺激呼吸器官导致呼吸道、肺部病变,浓度大时引起死亡
化学性质:
与水反应方程式:
雷雨发庄稼的化学原理:
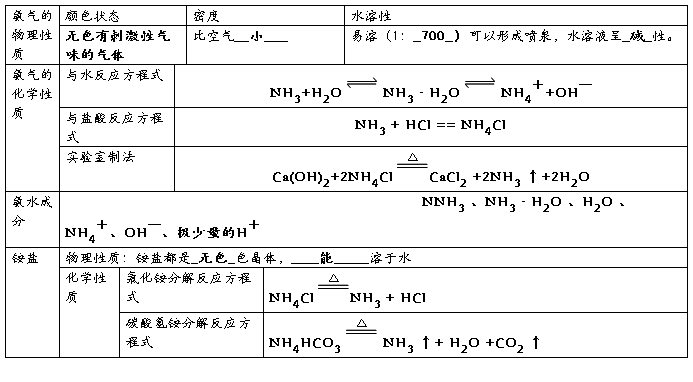
氨
1物理性质:无色有刺激性气味气体,密度较小,极易溶于水,易液化
2化学性质:
① 与水反应:
② 与氯化氢反应:
3氨的实验室制备
方程式:
收集方法:向下排空气法 尾气处理:用稀硫酸吸收
验满方法:用湿润的红色石蕊试纸检验:试纸变蓝;用浓盐酸检验:产生大量白烟
干燥方法:碱石灰干燥
氨的用途:肥料、化工合成、制冷剂
铵盐
1物理性质:晶体,易溶于水
2化学性质:
① 受热易分解:
氯化铵分解: 碳酸铵分解:
碳酸氢铵分解:
硝酸铵分解:
② 铵盐与碱反应:(铵盐的特征反应)
硫酸铵与氢氧化钠反应:
硝酸铵与氢氧化钠反应:
硝酸
1硝酸与金属铜反应
铜与稀硝酸反应:
铜与浓硝酸反应:
硝酸是一种强氧化剂,几乎能与所有金属反应(金、铂)除外,但是与铝、铁在冷的浓硝酸中会发生钝化现象。浓度越大,氧化性越大。一旦沾在皮肤上,用小苏打水或肥皂水洗涤
2硝酸与非金属反应
硝酸与碳反应:
硫酸
1浓硫酸的物理性质
纯净的硫酸是无色粘稠油状液体,沸点较高,不易挥发,密度大于水,溶于水时放出大量的热
2浓硫酸的三大特性:吸水性、脱水性、强氧化性
① 浓硫酸的吸水性:由于浓硫酸有吸水性常可以作为干燥剂,但是浓硫酸不能干燥碱性气体,氨,还原性气体,如:硫化氢、溴化氢、碘化氢
② 浓硫酸的脱水性:脱水性是化学变化
③ 浓硫酸的氧化性:
a浓硫酸具有很强的氧化性,可以把还原性很弱的银氧化,但遇到铝、铁发生钝化
b在做氧化剂时一般会还原为二氧化硫
浓硫酸与碳反应:
-
高中化学必修一第一章复习知识点整理
高一化学必修1从第一章复习提纲及试题第一章从实验学化学第一节化学实验基本方法班别姓名一确保实验安全应注意的问题1遵守实验室规则2了…
-
高中化学必修一知识点总结
高中化学必修一全册基本内容梳理第一章从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或…
-
高一化学必修一第一章知识总结
高一化学必修一第一章知识总结11化学实验基本方法111化学实验安全A常见危险化学品爆炸品KClO3KMnO4KNO3易燃气体H2C…
-
高中化学必修一知识点总结
高中化学必修1复习提纲注A了解B理解C综合应用必修1全册基本内容梳理一从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中…
-
高中化学必修一第一、二章知识点总结
必修一第一二章总结第一章第一节主要知识点1化学危险品标志参考书P4图2几种物质分离提纯方法过滤一贴二低三靠即滤纸紧贴漏斗内壁滤纸边…
-
人教版高中化学必修1前两单元知识点总结
必修1知识点总结从实验学化学一、化学实验安全1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等…
-
高一化学必修一第一章知识总结
高一化学必修一第一章知识总结1.1.化学实验基本方法1.1.1化学实验安全A.常见危险化学品爆炸品:KClO3KMnO4KNO3易…
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
- 高中化学__必修一第三第四章知识点总结(详细)
-
高一化学必修一知识点总结+练习(附答案)
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
- 高中化学__必修一第四章知识点总结(详细)