高中化学必修1化学方程式总结
高中化学必修1化学方程式总结
一、钠及其化合物的转化关系
1.钠在空气中燃烧:2Na+O2 Na2O2
Na2O2
2.钠在氧气中燃烧:4Na+O2 2Na2O
2Na2O
3.钠与水反应:2Na+2H2O=2NaOH+H2↑
4.氧化钠与水反应:Na2O+H2O=2NaOH
5.过氧化钠与水反应:2Na2O2+2H2O=4NaOH+O2↑
6.氧化钠与盐酸反应:Na2O+2HCl=2NaCl+H2O
7.钠与盐酸反应:2Na+2HCl=2NaCl+H2↑
8.氧化钠与二氧化碳反应:Na2O+CO2=Na2CO3
9.过氧化钠与二氧化碳反应:
2Na2O2+2CO2=2Na2CO3+O2
10.电解氯化钠(工业制钠):2NaCl 2Na+Cl2↑
2Na+Cl2↑
11.碳酸钠与水和二氧化碳反应:
Na2CO3+H2O+CO2=2NaHCO3
12.碳酸氢钠遇热分解:
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
13.碳酸氢钠与氢氧化钠反应:
NaHCO3+NaOH=Na2CO3+H2O
14.碳酸钠与盐酸反应:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
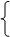 ①Na2CO3+HCl=NaHCO3;
①Na2CO3+HCl=NaHCO3;
②NaHCO3+HCl=NaCl+H2O+CO2↑
15.碳酸氢钠与盐酸反应:
NaHCO3+HCl=NaCl+H2O+CO2↑
16.碳酸钠与氯化钙反应:Na2CO3+CaCl2=CaCO3↓+2NaCl
17.候氏治碱法:
①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
②HCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
18.钠与四氯化钛反应:TiCl4+4Na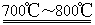 Ti+4NaCl
Ti+4NaCl
19.钠与硫酸铜溶液反应:
①有水环境下:2Na+2H2O=2NaOH+H2↑;
NaOH+CuSO4=Cu(OH)2+Na2SO4
②熔融条件下:Na+CuSO4 Cu+Na2SO4
Cu+Na2SO4
20.钠与硫反应:Na+S Na2S
Na2S
二、铝及其化合物的转化关系
1.高温灼烧氢氧化铝:2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
2.电解氧化铝:Al2O3 4Al+3O2↑
4Al+3O2↑
3.铝与盐酸反应:2Al+6HCl=2AlCl3+3H2↑
4.铝与氢氧化钠反应:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
5.铝与稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑
6.氧化铝与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O
7.氧化铝与氢氧化钠反应:
Al2O3+2NaOH=2NaAlO2+H2O
8.氧化铝与稀硫酸反应:
Al2O3+3H2SO4=Al2(SO4)3+3H2O
9.氯化铝与氨水反应(实验室制氢氧化铝):
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
10.往氯化铝中滴加氢氧化钠至过量:
(先有白色沉淀,后沉淀逐渐溶解)
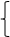 ①AlCl3+3NaOH=Al(OH)3↓+3NaCl;
①AlCl3+3NaOH=Al(OH)3↓+3NaCl;
②Al(OH)3+NaOH = NaAlO2+2H2O
11.往氢氧化钠中滴加氯化铝至过量:
(先无现象,后有白色沉淀)
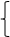 ①AlCl3+4NaOH = NaAlO2+3NaCl+2H2O ;
①AlCl3+4NaOH = NaAlO2+3NaCl+2H2O ;
②3NaAlO2+6H2O+AlCl3 = 4Al(OH)3↓+3NaCl
12.偏铝酸钠与盐酸反应:
NaAlO2+HCl+H2O =Al(OH)3↓+NaCl
若盐酸过量:
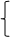 ①NaAlO2+HCl+H2O =Al(OH)3↓+NaCl;
①NaAlO2+HCl+H2O =Al(OH)3↓+NaCl;
②Al(OH)3↓+HCl=AlCl3+3H2O
13.偏铝酸钠与二氧化碳反应:
NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
14.铝还原氧化铁(焊接铁轨):
2Al+Fe2O3 2Fe(铁水)+Al2O3(铝热反应)
2Fe(铁水)+Al2O3(铝热反应)
三、氯及其化合物的转化关系
1.铁在氯气中燃烧:2Fe+3Cl2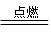 2FeCl3(棕褐色烟)
2FeCl3(棕褐色烟)
2.铜在氯气中燃烧:Cu+Cl2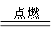 CuCl2(棕黄色烟)
CuCl2(棕黄色烟)
3.氢气在氯气中燃烧:
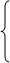 H2+Cl2
H2+Cl2  2HCl(苍白色火焰)
2HCl(苍白色火焰)
H2+Cl2  2HCl(会发生爆炸)
2HCl(会发生爆炸)
4.实验室制氯气(浓盐酸与氧化锰反应):
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
5.工业制氯气(电解饱和食盐水):
2NaCl+2H2O 2NaOH+H2↑+Cl2↑(氯碱工业)
2NaOH+H2↑+Cl2↑(氯碱工业)
6.氯气溶于水:Cl2+H2O ? HCl+HClO
7.次氯酸遇光分解:2HClO 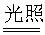 2HCl+O2↑
2HCl+O2↑
8.氯气与氢氧化钠反应:
Cl2+2NaOH = NaCl+NaClO+H2O
(吸收氯气尾气)
9.氯气与氢氧化钙反应:
2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O(制漂白粉)

10.向漂白粉溶液中通入过量的CO2:(漂白粉失效)
Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO
11.氯气与碘化钾反应:Cl2+2KI=I2 +2KCl(检验氯气)
四、铁及其化合物的转化关系
1.铁与水反应:
4H2O(气态)+3Fe Fe3O4+4H2
Fe3O4+4H2
2.铁在氧气中燃烧:3Fe+2O2 Fe3O4
Fe3O4
3.铁和盐酸反应:Fe+2HCl=FeCl2+H2↑
4.铁和稀硫酸反应: Fe+H2SO4 = FeSO4+H2↑
5.铁和氯化铁反应:Fe+2FeCl3 = 3FeCl2
6.铁和氯化铜反应:
Fe+2CuCl2=FeCl2+Cu(制造电路板)
7.铁在氯气中燃烧:2Fe+3Cl2=2FeCl3
8.氯化亚铁和氯气反应:2FeCl2+Cl2 = 2FeCl3
9.氯化亚铁和氢氧化钠反应:
(白色沉淀迅速变成灰绿色,最后变成红褐色)
 ①FeCl2+2NaOH = Fe(OH)2↓+2NaCl;
①FeCl2+2NaOH = Fe(OH)2↓+2NaCl;

 ②4Fe(OH)2+O2+2H2O = 4Fe(OH)3
②4Fe(OH)2+O2+2H2O = 4Fe(OH)3
(氢氧化亚铁被氧化)
10.氯化铁氢氧化钠反应:
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
11.氢氧化亚铁与盐酸反应:
Fe(OH)2+2HCl = FeCl2+2H2O
12.氢氧化铁与盐酸反应:Fe(OH)3+3HCl = FeCl3+3H2O
13.氧化铁与盐酸反应:Fe2O3+6HCl = 2FeCl3+3H2O
14.四氧化三铁与盐酸反应:
Fe3O4+8HCl =2FeCl2+FeCl3+4H2O
15.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O
16.一氧化碳还原四氧化三铁:Fe3O4+4CO 3Fe+4CO2
3Fe+4CO2
17.一氧化碳还原氧化铁: Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
18.高温煅烧氢氧化铁:2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
19.铁在高温条件下与浓硫酸反应:
2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
△常温下,铝,铁遇浓硫酸,浓硝酸被钝化,表面形成一层致密的氧化膜,阻止反应的进一步进行。
20.工业炼铁:
①C+O2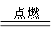 CO2
CO2
②CO2+C 2CO
2CO
③Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
④CaCO3 CaO+CO2↑
CaO+CO2↑
⑤SiO2+CaO CaSiO3(炉渣)
CaSiO3(炉渣)
21.检验三价的铁离子:
FeCl3+3KSCN = Fe(SCN)3+3KCl
【Fe3++3SCN-= Fe(SCN)3】
五.硅及其化合物的转化关系
1. 硅与氧气在高温条件下反应:Si + O2 SiO2
SiO2
2.硅与氯气在高温条件下反应:
Si + 2Cl2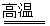 SiCl4(液态)
SiCl4(液态)
3.二氧化硅与碳反应:SiO2+2C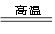 Si+2CO↑
Si+2CO↑
4.二氧化硅与氧化钙反应:SiO2+CaO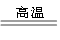 CaSiO3
CaSiO3
5.二氧化硅与氢氟酸反应 (雕刻玻璃):
SiO2+4HF = SiF4↑+2H2O
6.二氧化硅与氢氧化钠反应:
SiO2+2NaOH = Na2SiO3+H2O
7.硅酸钠和二氧化碳反应:
Na2SiO3+H2O+CO2=H2SiO3↓(黏性剂)+Na2CO3
8.四氯化硅和氢气反应:SiCl4+2H2 Si+4HCl (气态)
Si+4HCl (气态)
9.工业制硅:
①SiO2+2C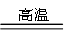 Si+2CO↑
Si+2CO↑
②Si + 2Cl2 SiCl4
SiCl4
③SiCl4+2H2 Si+4HCl
Si+4HCl
六.镁及其化合物的转化关系
1.镁和氧气反应:2Mg+ O2 2MgO
2MgO
2.镁和氮气反应:3Mg+N2 Mg3N2
Mg3N2
3.镁和二氧化碳反应:2Mg+CO2 2MgO+C
2MgO+C
4.镁和盐酸反应:Mg+2HCl=MgCl2+H2↑
5.镁和水反应:Mg+2H2O Mg(OH)2↓+H2↑
Mg(OH)2↓+H2↑
6.电解氯化镁:MgCl2 Mg+Cl2↑
Mg+Cl2↑
7.氯化镁与氢氧化钙反应:
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
8.氢氧化镁与盐酸反应:Mg(OH)2+2HCl=MgCl2+H2O
七.溴和碘及其化合物的转化关系
1.氯气与碘化钾反应(制碘):Cl2+2KI=I2 +2KCl
2.碘化钠和硝酸银反应:NaI+AgNO3=AgI↓+NaNO3

3.溴化钠和硝酸银反应:NaBr+AgNO3=AgBr↓+NaNO3

4.溴和碘化钾反应:Br2+2KI=I2 +2KBr
5.氯气与溴化钾反应(制溴):Cl2+2KBr=Br2 +2KCl
八.硫及其化合物的转化关系
1.硫和氧气反应:S+O2 =SO2
2.二氧化硫与水反应:SO2 + H2O ? H2SO3
3.二氧化硫与氧气反应:2SO2 + O2 ? 2SO3
4.三氧化硫与水反应:SO3+H2O=H2SO4
5.二氧化硫与强碱反应:
 如 SO2+NaOH=Na2SO3+H2O
如 SO2+NaOH=Na2SO3+H2O
若碱过量:SO2+H2O+Na2SO3=NaHSO3
6.二氧化硫与碱性氧化物反应:如SO2+CaO=Ca2SO3
7.二氧化硫与高锰酸钾反应:
5SO2+2KMnO4+2H2O=K2SO4+MnSO4+H2SO4
8.二氧化硫与过氧化氢反应:H2O2+SO2=H2SO4
9.二氧化硫与氯气反应:Cl2+SO2+2H2O=2HCl+H2SO4
10.二氧化硫与溴水反应:Br2+SO2+2H2O=2Br2+H2SO4
11.二氧化硫与硫化氢反应(氧化性):
SO2+2H2S=3S↓+2H2O
12.(浓)硫酸和亚硫酸钠反应(实验室制二氧化硫):
Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑
(非氧化还原反应)
13.工业制二氧化硫:
①4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
②2SO2 + O2 ? 2SO3
③SO3+H2O=H2SO4
14.浓硫酸与碳反应:2H2SO4(浓)+C CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
15.浓硫酸与铜反应:
2H2SO4(浓)+Cu CuSO4+2H2O+2SO2↑
CuSO4+2H2O+2SO2↑
九.氮及其化合物的转化关系
1.氮与氧气反应:N2+O2 2NO
2NO
2.一氧化氮与氧气反应:2NO+O2=2NO2
3.二氧化氮与水反应:3NO2+H2O=2HNO3+NO
4.二氧化氮与水、氧气反应:4NO2+O2+2H2O=4HNO3
5.一氧化氮与水、氧气反应:4NO+3O2+2H2O=4HNO3
6.氮气与氢气反应(工业制氨气):N2+H2?NH3
7.氨气与酸反应:如NH3+ HCl=NH4Cl(白烟)
8.铵盐遇热分解:如NH4Cl NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
9.氨气与水反应:NH3 + H2O? NH3·H2O?NH4+ + OH-
10.氨气与氧气反应:4NH3+5O2 4NO+6H2O
4NO+6H2O
(工业制硝酸的第一步)
11.铵盐与强碱反应(实验室制氨气):
如2NH4Cl+Ca(OH)2NH3↑+2H2O+CaCl2
12.浓硝酸与金属反应:
如4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O
13.稀硝酸与金属反应:
如8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O
14.浓硝酸与碳反应:4HNO3(浓)+C CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
十.几种常见离子的检验:
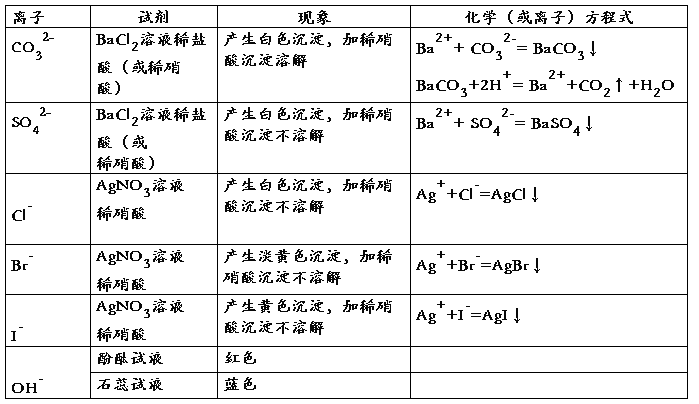
第二篇:高中化学必修1第三章化学方程式总结
高中化学必修1第三章化学方程式总结
1、钠及其化合物
(1)Na
4Na+O2=2Na2O
2Na+O2 Na2O2
Na2O2
2Na+2HCl=2NaCl+H2↑ 2Na+2H+=2Na++H2↑
2Na+2H2O=2NaOH+H2↑ 2Na+2H2O=2Na++2OH-+H2↑
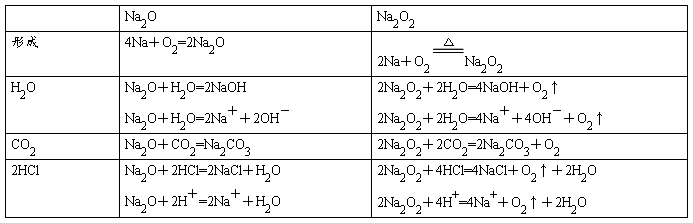
(2)Na2O和Na2O2的对比
(3)NaOH,Na2CO3 ,NaHCO3
2NaOH+CO2=Na2CO3+H2O (CO2较少) 2OH-+CO2=CO32-+H2O
NaOH+CO2=NaHCO3 (CO2较多) OH-+CO2=HCO3-
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH CO32-+Ca2+=CaCO3↓
Na2CO3+H2O+CO2=2NaHCO3 CO32-+H2O+CO2=2HCO3-
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO32-+2H+=H2O+CO2↑
2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
NaHCO3+NaOH=Na2CO3+H2O HCO3-+OH-=CO32-+H2O
NaHCO3+HCl=NaCl+H2O+CO2↑ HCO3-+H+=H2O+CO2↑
(4)①石灰水中加入少量NaHCO3 :
Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
Ca2++OH-+HCO3-=CaCO3↓+H2O
②石灰水中加入过量NaHCO3 :
Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
2、铝及其化合物的转化关系
(1)Al
4Al+3O2 2Al2O3
2Al2O3
2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)Al2O3
Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O
Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH-=2AlO2-+H2O
(3)Al(OH)3
制备:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl Al3++3NH3·H2O = Al(OH)3↓+3NH4+
性质:2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH = NaAlO2+2H2O Al(OH)3+OH-= AlO2-+2H2O
(4)NaAlO2(AlO2-)
NaAlO2+HCl+H2O =Al(OH)3↓+NaCl AlO2-+H++H2O=Al(OH)3↓
NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 (CO2较多)
AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3 (CO2较少)
2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
(5)AlCl3(Al3+)
AlCl3+3NaOH = Al(OH)3↓+3NaCl Al3++3OH-= Al(OH)3↓
AlCl3+4NaOH = NaAlO2+3NaCl+2H2O Al3++4OH-= AlO2-+2H2O
(6)Al,Al2O3 ,Al(OH) 3的两性的比较


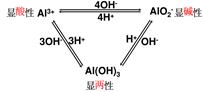
3、铁及其化合物的转化关系
(1)Fe
3Fe+2O2 Fe3O4
Fe3O4
3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
Fe+2HCl=FeCl2+H2↑ Fe+2H+=Fe2++H2↑
Fe+2FeCl3 = 3FeCl2 Fe+2Fe3+= 3Fe2+
2Fe+3Cl2 2FeCl3
2FeCl3
(2)FeCl2
2FeCl2+Cl2 = 2FeCl3 2Fe2++Cl2 = 2Fe3++2Cl-
FeCl2+2NaOH = Fe(OH)2↓+2NaCl Fe2++2OH-= Fe(OH)2↓
(3)FeCl3
2FeCl3+Fe= 3FeCl2 Fe+2Fe3+= 3Fe2+
2FeCl3+Cu= 2FeCl2+CuCl2 2 Fe3++Cu= 2 Fe2++Cu2+
FeCl3+3NaOH = Fe(OH)3↓+3NaCl Fe3++3OH-= Fe(OH)3↓
FeCl3+3KSCN = Fe(SCN)3+3KCl Fe3++3SCN-= Fe(SCN) 3(血红色)
(4)Fe(OH)2
Fe(OH)2+2HCl = FeCl2+2H2O Fe(OH)2+2H+= Fe2++2H2O
4Fe(OH)2+O2+2H2O = 4Fe(OH)3 白色沉淀迅速变成灰绿色,最后变成红褐色
(5)Fe(OH)3
Fe(OH)3+3HCl = FeCl3+3H2O Fe(OH)3+3H+= Fe3++3H2O ⑿2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
⒀Fe2O3+6HCl = 2FeCl3+3H2O Fe2O3+6H+= 2Fe3++3H2O


-
人教版高中化学必修1化学方程式总结知识点归纳
化学必修一知识大总结一教材中涉及的离子检验物质检验的一般步骤取试样加试剂观现象定结论1SO4的检验取待测液先用稀盐酸酸化再加BaC…
-
高中化学必修1化学方程式总结
高中化学必修1化学方程式总结一钠及其化合物的转化关系1钠在空气中燃烧2NaO2点燃Na2O22钠在氧气中燃烧4NaO2点燃2Na2…
- 高一化学必修1化学方程式及离子方程式汇总(背诵版)
-
高中化学 化学方程式总结 人教版必修1
高中化学必修1化学方程式总结1钠及其化合物的转化关系2NaCl2Na2O2HCl2NaClH2O2Na2HCl2NaClH2Na2…
-
高中化学必修1的化学方程式分类归纳
化学必修1全部化学方程式分类归纳一置换反应氧化还反应1还原性非金属单质与氧化物反应置换金属单质碳还原氧化铜2CuOC高温2CuCO…
-
高中必修1化学方程式大全
高中化学必修1化学方程式总结1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2…
-
高一化学必修一第三章化学方程式总结
高一化学必修1化学方程式归纳小结一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na+O22.钠与水反应:2N…
-
高一化学必修一化学方程式总结
1、钠及其化合物的转化关系①Na2②2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑Na2O+2H…
-
高中化学必修1化学方程式总结
1、钠及其化合物的转化关系2②NaCl2①Na2O+2HCl=2NaCl+H2O②2Na+2HCl=2NaCl+H2↑++++Na…
-
必修1化学方程式总结
必修1化学方程式总结1、硫酸根离子的检验:BaCl2+Na2SO4=BaSO4↓+2NaCl2、碳酸根离子的检验:CaCl2+Na…
-
高中化学必修一第三章金属及其化合物化学方程式或离子方程式总汇(完美编辑版)
高中化学必修一第三章金属及其化合物化学方程式或离子方程式总汇第一节金属的化学性质一、钠、镁、铝、铁、铜分别与氧气反应1、4Na+O…