原料药产品年度质量回顾分析报告模板
原料药产品年度质量回顾分析报告模板
XX(产品名称) 年度质量回顾分析报告
回顾周期:XX年XX月XX日-XX年XX月XX日
产品年度质量报告编码:XXXXX XXXXX
目 录
11概述
1.1 1.1概要……………………………………………………………
1.2 1.2回顾周期………………………………………………………
1.3 1.3产品描述………………………………………………………
1.4 1.4生产质量情况…………………………………………………
22原辅料质量情况回顾…………………………………………
33生产工艺中间控制情况回顾 ……………………………………
3.1 3.1关键工艺参数控制情况………………………………………
3.2 3.2中间体控制情况……………………………………………
3.3 3.3收率………………………………………………………
44成品检验结果回顾…………………………………………………
55公共系统回顾
5.1 5.1工艺用水回顾…………………………………………………
5.2 5.2环境监测回顾…………………………………………………
5.3 5.3与药品直接接触的工艺用气体质量回顾……………………
6偏差调查……………………………………………………………
7稳定性考察及不良趋势分析………………………………………
8变更控制回顾………………………………………………………
9验证回顾……………………………………………………………
10 产品投诉/退货/召回情况回顾
10.1投诉情况回顾…………………………………………………
10.2退货/召回情况回顾……………………………………………
11 相关研究回顾………………………………………………………
12 上一次年度质量报告跟踪…………………………………………
13 结论…………………………………………………………………
1、概述
1.1 概要
根据《产品年度质量报告相关制度》的规定,对XXXX(产品名称)进行年度质量回顾分析,并通过统计和趋势分析,证实工艺的一致性。
1.2 回顾周期:XXXX年XX月XX日-XXXX年XX月XX日
1.3 产品描述
1.3.1 批准注册、认证信息:XXXX
1.3.2 产品工艺流程(简单介绍产品生产工艺,生产工艺流程图)
1.3.3 关键工艺参数:XXXX
1.4 1.4生产质量情况

评价:XXXX XXXX XXXX
2、原辅料质量情况回顾
根据实际情况可对关键物料质量情况,也可只对物料质量异常情况进行回顾(可略)
3、生产工艺中间控制情况回顾
3.1 关键工艺参数控制
3.1.1 列出关键工艺控制项目和控制范围
3.1.2 将各工序关键操作参数控制结果进行汇总,然后据此制出趋势图,并在相应图上标出相应的控制线。
参数1控制情况趋势图1(略)
参数2控制情况趋势图2(略)
……
(参考制剂年度质量报告关键工艺参数控制部分)
评价(举例):XX批次在XX工序XX步骤中,由于XX原因导致XX指标偏离,详见编号为XX的偏差报告,应采取XX措施进行改进。
XX工序已经明确的关键工艺参数包括XX、XX等。其中XX的控制方法(或控制范围)还不够理想,应继续研究控制方法(或控制范围)。或应针对XX因素去通过试验发现新的关键工艺参数。
3.2 中间体控制
对中间体相关质量指标控制结果进行汇总分析,方法同上。
3.3 收率
对收率监测结果数据进行汇总分析,方法同上。
4、成品检验结果回顾
4.1介绍成品质量标准,如果某检测项目发生分析方法变更等情况,应简要说明。
4.2对照质量标准,对成品检验结果进行汇总分析。若返工或重新处理、母液回收等生产工艺不同,应对不同工艺所得的产品分别进行质量数据汇总分析。
质量标准项目1检验结果趋势图1(略)
质量标准项目2检验结果趋势图2(略)
……
(对于质量数据波动过大或超出预期趋势的异常数据,应分析原因,并提出改进措施。对于超出质量标准限度的情况在“OOS及偏差调查”中进行调查分析)
评价(举例):XX产品的正常(返工、母液回收)工艺是稳定可靠的,但是对XX等指标应加强控制试验研究。(或者:以上质量数据分析说明XX产品的正常工艺不够稳定可靠,需作XX方面的改进。)
5、公共系统回顾
5.1 5.1工艺用水回顾
与XX产品相关的注射用水/纯化水使用点共有XX个,日常监测项目有XX、XX等。监测频次:XX
对注射用水/纯化水关键项目日常监测结果趋势分析:
(分析方法参照制剂年度质量报告工艺用水回顾部分)
趋势图1(略)
趋势图2(略)
……
工艺用水日常监测出现异常情况回顾:

评价:XXXX XXXX XXXX
5.2 环境监测回顾
无菌原料药应对生产环境尘埃粒子、沉降菌、浮游菌的监测值进行汇总分析,其他原料药也可对生产环境控制参数监测境况进行汇总分析。
趋势图1(略)
趋势图2(略)
……
评价:(举例)XX阶段XX项目监测值超过合格标准,该阶段生产的XX批次(产品名称)已采取XX措施,XX批已按偏差处理,偏差象编号为XX。
未出现超标情况,但XX阶段XX项目监测值有所升高,分析其原因是由于XX方面引起,建议进行XX方面的整改。
5.3 与药品直接接触的工艺用气质量回顾
XX产品生产过程中使用的与产品直接接触的气体是XX气体,日常监测XX项目,监测频次:XX,对监测结果进行汇总分析。
评价:XXXX XXXX XXXX
6、偏差调查
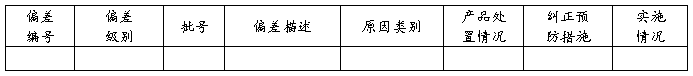
偏差趋势分析:(例如,本年度共发生偏差XX起,由XX问题产生偏差有XX起,呈XX趋势,今后需加强对XX的控制。)
评价:XXXX XXXX XXXX
7、稳定性考察及不良趋势分析
稳定性考察留样批号:XX,留样包装:XX,留样条件:XX,稳定性考察检验项目:XX、XX等,检验时间:XX
稳定性考察期间各个项目随着时间的变化趋势进行分析
XX(考察项目1)变化趋势图1
XX(考察项目2)变化趋势图2
……
(稳定性考察过程中若出现不良趋势,应对不良趋势情况进行总结分析)
评价:XXXX XXXX XXXX
8、变更控制回顾
总结标准、设备、工艺、原辅料和包装材料、控制规程以及分析方法等方面的变更的内容、时间、原因、依据,审核变更程序的符合性和合法性,评价变更结果是否达到预期效果。
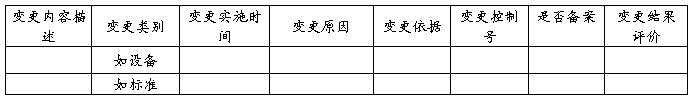
*注释:变更依据指变更能够实施的支持证据,如验证或相关研究等。
评价:XXXX XXXX XXXX(举例)本年度共进行XX次变更,其中工艺变更XX次,设备变更XX次,分析方法变更XX次,供应商变更XX次,其他方面的变更XX次。变更的相关工作均已完成,且达到了变更的效果。
9、验证回顾
阐述年度XX产品线发生的工艺验证、清洁验证、设备验证、分析方法验证等验证情况。

评价:XXXX XXXX XXXX
10 、1产品退货/投诉/召回情况回顾
10.1 投诉情况回顾

评价:XXXX XXXX XXXX(举例)XX类型客户投诉的比例呈XX趋势,分析其深层原因是由于XX方面引起,建议进行XX方面的整改。
10.2 退货/召回情况回顾
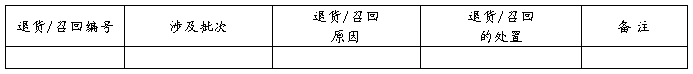
评价:XXXX XXXX XXXX(如XX类型退货的比例呈XX趋势,分析其原因是由于XX方面引起,建议进行XX方面的整改。)
11 、相关研究回顾
阐述在回顾周期内产品相关研究或补充研究工作开展情况,如变更研究、工艺控制研究、标准研究等。
12 、上一次年度质量报告跟踪
对上一次年度质量报告中建议的改进措施执行情况和执行效果进行跟踪。
13 、结论
结论:XXXX XXXX XXXX(举例)XX年度,XX产品的生产工艺、生产设备未发生变更,所有的偏差、客户投诉、质量分析、生产分析和工艺设备验证表明工艺是稳定可靠的。
建议:XXXX XXXX XXXX
(举例)通过回顾分析,认为XX产品在以下方面需要进一步加强研究,改进药品质量:
1、产品生产过程的改进
2、处方的改进
3、分析方法的改进
4、再验证……
第二篇:产品质量回顾分析报告20xx
***年度产品质量回顾分析报告
产品名称: *****
规 格:10g/支
产品代号: ****
回顾期限:20##年01月-20##年12月
回顾分析人:****
目录
1 概要
2 回顾期限
3 制造情况
4 产品生产的关键工艺参数
5 物料质量回顾
5.1 原辅料、包装材料质量问题回顾
5.2 主要原辅料购进情况回顾
5.3 供应商管理情况回顾
5.4 工艺用水、与药品直接接触的气体质量问题回顾
6 产品质量标准情况
6.1 产品质量标准
6.2 质量指标统计及趋势分析
7 生产工艺分析
7.1 关键工艺参数控制情况
7.2 中间体控制情况
7.3 工艺变更情况
7.4 物料平衡
7.5 收率
7.6 返工与再加工
7.7 设施设备情况
8 偏差回顾
9 超常超标回顾
10 产品稳定性考察
11 拒绝批次
11.1 拒绝的物料
11.2 拒绝的中间产品及成品
12 变更控制回顾
13 验证回顾
14 环境监测情况回顾
15 人员情况
16 委托加工、委托检验情况回顾
17 不良反应
18 产品召回、退货
18.1 产品召回
18.2 退货
19 投诉
20 药品注册相关变更的申报、批准及退审
21 结论
22 建议
1 概要:
根据《年度产品质量回顾分析管理规程》的规定,20##年12月对****进行产品质量回顾分析。本报告对该品种1个规格(10g/支:7批)共生产的7批产品进行统计和趋势分析。
2 回顾期限:20##年1月-20##年12月
3 制造情况:
10年度共生产****** 10g/支:3批,总批量为****万支,总产量为****万支,总收率为95.7%;
11年度共生产*******10g/支:4批,总批量为****万支,总产量为******万支,总收率为95.3%;
4产品生产的关键工艺参数
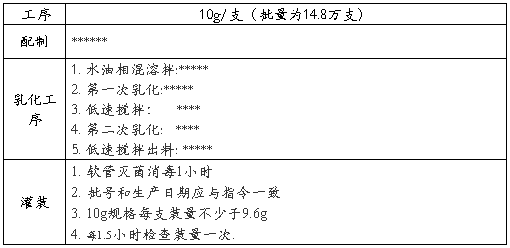
5. 物料质量回顾
5.1 原辅料、包装材料质量问题回顾
本年度购进的原辅料、包装材料经化验中心检查未出现质量问题.
5.2主要原辅料的购进情况回顾:
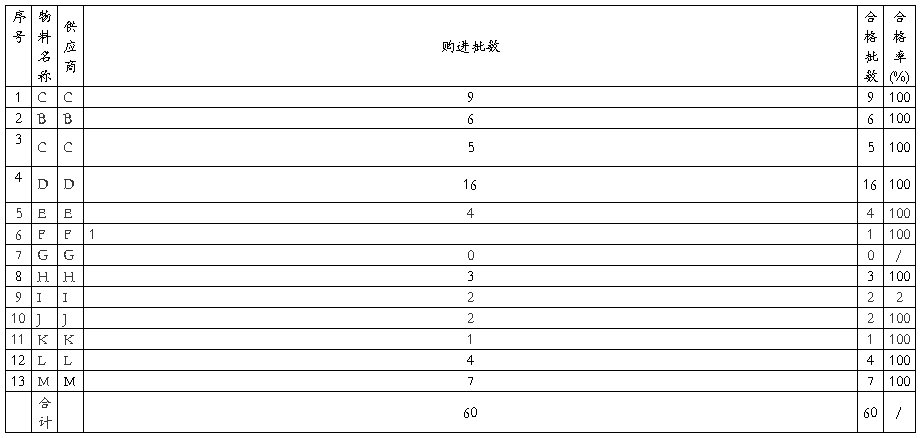
评价:1.全年共购进与本产品相关的原辅料和内包材共12种, 60批。
2.购进的每批物料经化验中心检查,均符合规定要求,合格率达到100%.
5.3 供应商的管理情况回顾
新增供应商情况:无
变更供应商情况:无
5.4工艺用水、与药品直接接触的气体质量问题回顾
本品20##-20##年生产期间工艺用水全部符合规定;
与药品直接接触的压缩空气经净化处理并经验证符合要求。
6产品质量标准情况:
6.1 产品质量标准
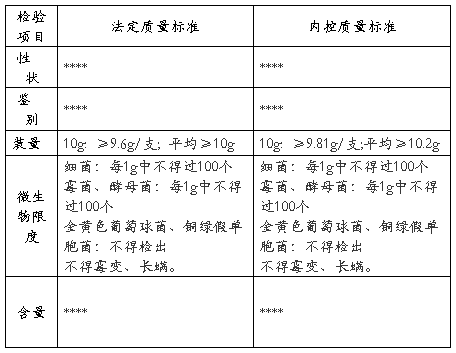
6.2质量指标统计及趋势分析
****10g/支检测质量统计表
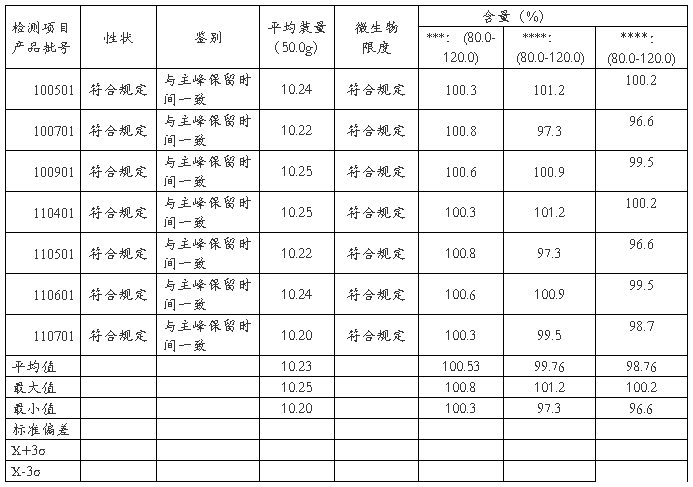
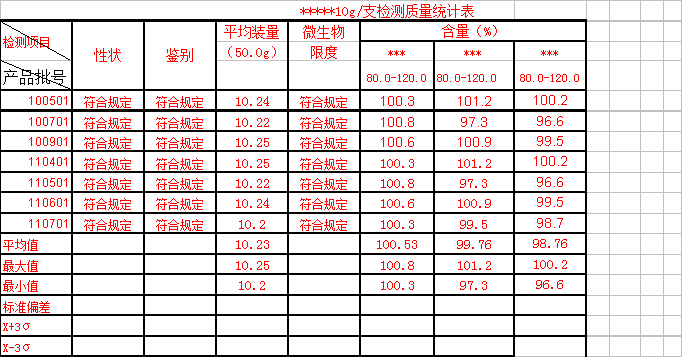
评价: 1. 20##-20##年度共检验****产品共7批,性状、鉴别和微生物限度均符合规定,趋势良好。
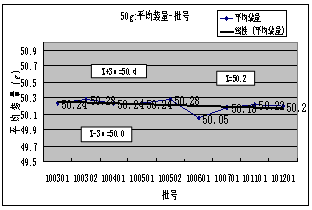
2. 平均装量 :年度总共检测20##-20##年度共检验****产品共7批,平均值:10.23 g,最高 :10.25g,最低:10.20g,极差:0.05g。从表1及平均装量-批号趋势图图可看出,各批的平均装量均符合要求,趋势良好。
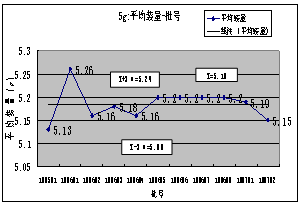
3.****(内控标准:90%~110%):20##-20##年度总共检测产品7批,平均值:100.53%,最高 :100.8%,最低:100.3,极差:0.5%;。从表1及***-批号趋势图可看出,产品各批的***含量均符合内控标准要求,趋势良好。
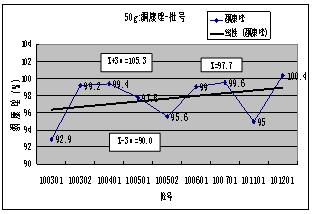
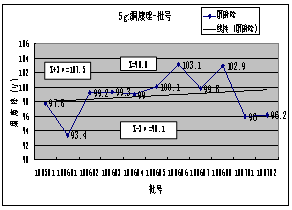
4. ****含量( 内控标准:90.0-110.0):20##-2011 年度总共检测产品7批,平均值:99.0%,最高 :101.5%,最低:95.1%,极差:6.4%;5g规格产品11批,平均值:99.1%,最高 :102.5%,最低:93.0%,极差:9.5%。从表和*****-批号图可看出,各规格产品各批的******含量均符合内控标准要求,但波动较大。

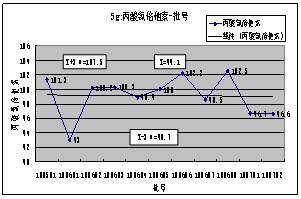
小结:成品控制指标共6项,各项控制指标均符合规定。
7生产工艺分析:
7.1关键工艺参数控制情况

7.2中间体控制情况
全年共检验*******批,性状、含量、装量均符合规定。
7.3工艺变更情况:
********
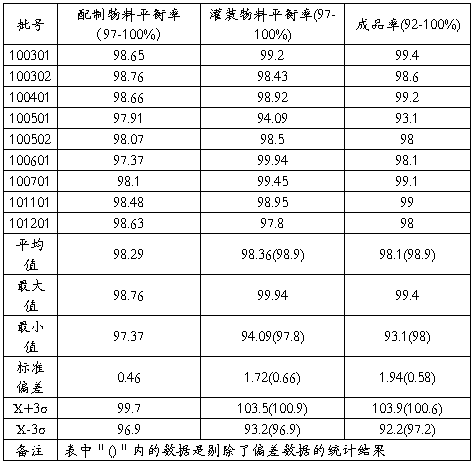
7.4物料平衡(生产各规格批号的物料平衡和成品率见下表)
表三 ****(10g/支)各工序物料平衡和成品率统计表
表四 ****(***g/支)各工序物料平衡和成品率统计表
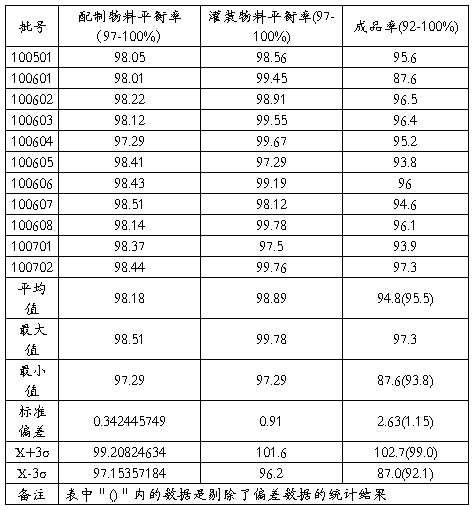
小结:**************************产品各工序的物料平衡,全部结果符合内控标准。
7.5成品率
小结:年度总共统计了50g规格产品9批,平均成品率:98.1%;5g规格产品11批,平均成品率:94.8%,其中100601因封口不牢,出现泄漏,致成品率偏低,偏差原因清楚,泄漏半成品已挑出,不影响产品质量。
7.6返工与再加工
评价:该产品全年生产过程中未发生返工和再加工。
7.7设备设施情况(与该产品有关的设施设备及与药品接触气体)
变更情况:新增了*********0自动包装机.
维护维修情况:按设备维护维修操作规程执行。
小结:各生产设备、设施运行良好;新增设备投入使用前经验证,符合生产工艺要求.
8 偏差回顾:

9 超常超限回顾:
评价:未发生超常超限事件
10 产品稳定性考察:
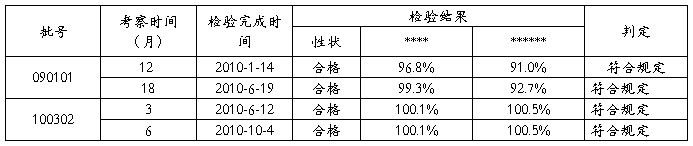
评价:20##年全年共进行50g规格留样检验2批, 09年产品和10年产品各1批,根据法定标准判定,均符合规定。
11 拒绝批次
11.1拒绝的物料
评价:与该品种相关的物料在20##年度未发生拒绝的情况。
11.2拒绝的成品及中间产品
评价:本品20##年度未发生拒绝的成品及中间产品的情况。
12 变更控制回顾:
评价:本品20##年度未发生变更。
13 验证回顾:
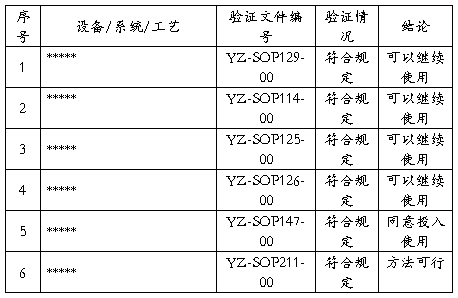
评价:全年本产品涉及的设备、系统验证共5个,清洁验证1个,已全部完成,验证结果均符合规定。未涉及工艺验证。
14 环境监测情况回顾:
评价:*****车间10万级洁净区域全年应测尘埃粒子总次数为4次,全年实测次数为4次,全年应测沉降菌总次数为12次,全年实测次数为12次,监测率为100%。全部监测次数均符合规定,合格率100%。监测过程未发生偏差,该车间环境(尘埃粒子、沉降菌)良好。
15 人员情况:
新增人员:无
人员体检及培训情况:每年体检,每年参加培训。
16.委托加工、委托检验情况回顾:
委托加工情况:该产品无委托加工。
委托检验情况:原辅料涉及红外色谱、砷盐检测的项目,均委托*****药品检验所检测。
17 不良反应:
评价:本品20##-20##年度未见到不良反应的情况。
18 产品召回、退货:
18.1产品召回
评价:本品20##-20##年度未发生产品召回情况。
18.2退货
评价:本品20##-20##年度未发生退货情况。
19 投诉:
评价:本品20##-20##年度未发生产品投诉情况。
20 药品注册相关变更的申报、批准及退审
本品20##-20##年度**************。
21 结论:
综合以上分析,在回顾期20##年01月到20##年12月生产的10g规格产品共***批,,原辅料均是进厂检验合格后放行使用,中间产品严格按照内控标准进行监控。在生产、物料、检验等过程控制较好,出现偏差能及时查明原因,***批产品经最终评价结果符合规定并已放行。
22 建议:
1)加强人员卫生培训,避免对产品造成污染。
2)加强供应商物料的质量审核,严格把好源头质量关。
3)加强产品质量回顾、分析、评估,及时跟踪产品趋势变化。
-
某制药厂年度产品质量回顾分析报告模板
第页共页年度产品质量回顾分析报告药品生产质量管理文件目录1概要2回顾期限3制造情况4产品描述5物料质量回顾6成品质量标准情况7生产…
-
年度产品质量回顾分析报告
年度产品质量回顾分析报告医用气态氧回顾日期20xx年01月20xx年12月目录1概要2回顾期限3制造情况4产品描述41产品工艺42…
-
产品年度质量回顾分析制度
产品质量回顾管理制度第1页共11页JSQASMP0901200目的通过每年定期对药品生产企业生产的所有药品按品种分类后开展产品质量…
-
20xx年上半年产品质量分析报告
甘肃同辉塑业有限责任公司聚乙烯吹塑农用地膜覆盖薄膜20xx年上半年质量回顾分析报告回顾周期20xx年1月1日20xx年6月30日半…
-
产品年度质量回顾报告
五层共挤输液用膜年度质量回顾报告第1页共8页五层共挤输液用膜年度质量回顾报告回顾周期20xx年1月1日20xx年12月31日产品年…
-
四年级语文期末考试质量分析报告
四年级语文期末质量检测分析报告(20xx—20xx学年第二学期)李咀小学20xx.08.25李咀小学四年级语文期末质量检测分析报告…
-
20xx年上学期小学期末考试质量分析报告
20xx年上学期小学期末考试质量分析报告本学期从各年级期末考试的总体成绩,尤其是毕业班的考试成绩来说,金山学校是丰收的一期,作为金…
-
13-14学年期末考试七年级语文教学质量分析报告
20xx—20xx学年教学质量分析报告----期末考试七年级语文一、基本情况我所担任的是七三班的语文,全级最高分107分,七三班最…
-
20xx年产品质量分析报告
20xx年产品质量分析报告泡沫陶瓷:一、1-12月份泡沫陶瓷产品质量均达到或超过公司下达的质量合格率指标95%,实际合格率为95.…
-
三年级科学质量分析报告
20xx-20xx-2三年级(下册)科学期中考试质量分析报告一、试卷命题情况分析:1、本次考试试题覆盖率高,基本上涵盖了本册前两单…
-
产品质量状况分析报告
无锡市宏杰电器配件厂HJ-D-PZ-059A------管理评审输入汇报资料部门:品质部主题:产品质量控制标题:20xx年x月-2…