人教版化学必修二第一章知识点总结
第一章 物质结构 元素周期表
第一节 元素周期表
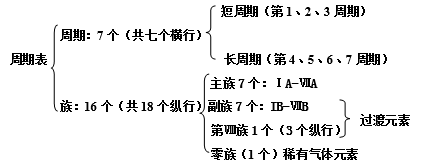
一、周期表
原子序数 = 核电荷数 = 质子数 = 核外电子数
1、依据
横行:电子层数相同元素按原子序数递增从左到右排列
纵行:最外层电子数相同的元素按电子层数递增从上向下排列
2、结构
周期序数=核外电子层数 主族序数=最外层电子数
二.元素的性质和原子结构
(一)碱金属元素:
1、原子结构 相似性:最外层电子数相同,都为1个
递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大
2、物理性质的相似性和递变性:
(1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K反常) ②熔点、沸点逐渐降低
结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质
(1)相似性:
(金属锂只有一种氧化物)
4Li + O2  Li2O 2Na + O2
Li2O 2Na + O2  Na2O2
Na2O2
2 Na + 2H2O = 2NaOH + H2↑ 2K + 2H2O = 2KOH + H2↑
2R + 2 H2O = 2 ROH + H2 ↑
产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有1个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈
结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
注:金属性强弱的判断依据:
①与水或酸反应越容易,金属性越强;
②最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
③置换反应,金属性强的金属置换金属性弱的金属
④离子的氧化性越弱对应金属的金属性越强
总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从Li到Cs的金属性逐渐增强。
(二)卤族元素:
1、原子结构 相似性:最外层电子数相同,都为7个
递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大
2.物理性质的递变性:(从F2到I2)
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(B r2反常)(3)单质的熔、沸点升高
3、化学性质
(1)卤素单质与氢气的反应: X2 + H2= 2 HX
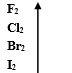
卤素单质与H2的剧烈程度:依次增强 ; 生成的氢化物的稳定性:依次增强(HF最稳定)
(2)卤素单质间的置换反应
2NaBr +Cl2=2NaCl + Br2 氧化性:Cl2________Br2;还原性:Cl-_____Br-
2NaI +Cl2=2NaCl + I2 氧化性:Cl2_______I2; 还原性:Cl-_____I-
2NaI +Br2=2NaBr + I2 氧化性:Br2_______I2; 还原性:Br-______I-

单质的氧化性:从下到上依次增强(F2氧化性最强),对于阴离子的还原性:从上到下依次增强( I-还原性最强)
结论:①非金属性逐渐减弱②原子结构的递变性导致化学性质的递变性。
注:非金属性的强弱的判断依据:
①从最高价氧化物的水化物的酸性强弱。
②与H2反应的难易程度以及氢化物的稳定性来判断。
③置换反应,非金属性强的置换非金属性弱的非金属
④离子的还原性越弱,非金属性越强
总结:递变性:从上到下(从F2到I2),随着核电核数的增加,卤族元素原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子得到电子的能力减弱,即非金属性逐渐减弱。所以从F2到I2的非金属性逐渐减弱。
总之:同主族从上到下,随着核电核数的增加,电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子得电子的能力减弱,失电子的能力增强,即非金属性逐渐减弱,金属性逐渐增强。
三.核素
(一)原子的构成:
(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽略。
(3)原子序数 = 核电核数 = 质子数 = 核外电子数
(4)质量数(A)=质子数(Z)+中子数(N)
(5)在化学上,我们用符号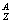 X 来表示一个质量数为A ,质子数为Z 的具体的X 原子。
X 来表示一个质量数为A ,质子数为Z 的具体的X 原子。

(二)核素
核素:把具有一定数目的质子和一定数目的中子的一种原子称为核素。一种原子即为一种核素。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
或:同一种元素的不同核素间互称为同位素。
(1)两同:质子数相同、同一元素
(2)两不同:中子数不同、质量数不同
(3)属于同一种元素的不同种原子
第二节 元素周期律
一.原子核外电子的排布
1.在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。
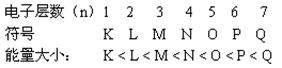
2、核外电子的排布规律
(1)核外电子总是尽先排布在能量低的电子层,然后由里向外,依次排布。
(能量最低原理)。
(2)各电子层最多容纳的电子数是2n2(n表示电子层)
(3)最外层电子数不超过8个(K层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
二.元素周期律:
1、核外电子层排布的周期性变化
每周期最外层电子数:从1--------8(K层由1-2)
2、原子半径呈周期性的变化:每周期原子半径:逐渐减小(同周期第0族最大)
3、主要化合价:
每周期最高正化合价:+1 +7(稀有气体0价,F化合物中没有正价)
+7(稀有气体0价,F化合物中没有正价)
每周期负化合价:-4 -1
-1
4、元素的金属性和非金属性呈周期性的变化。
同周期元素金属性和非金属性的递变性:
(1)2Na + 2H2O =2NaOH + H2↑ (容易)
Mg + 2 H2O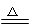 2Mg(OH)2 + H2↑(较难)
2Mg(OH)2 + H2↑(较难)
金属性:Na > Mg
2)Mg + 2HCl =MgCl2 + H2↑ (容易)
2Al + 6 HCl = 2AlCl3 +3H2↑(较难)
金属性:Mg > Al 根据1、2得出: 金属性 Na > Mg > Al

(5)随着原子序数的递增,元素的核外电子排布、主要化合价、金属性和非金属性都呈现周期性的变化规律,这一规律叫做元素周期律。
总结 :元素周期律:元素的性质随着原子序数的递增而呈周期性的变化的规律。
实质:元素原子的核外电子排布周期性变化的必然结果。
四、同周期、同主族金属性、非金属性的变化规律是:

1. 周期表中金属性、非金属性之间没有严格的界线。在分界线附近的元素具有金属性又具有非金属性。
2. 金属性最强的在周期表的左下角是,Cs;非金属性最强的在周期表的右上角,是F。(两个对角)
3.元素化合价与元素在周期表中位置的关系。
①元素的最高正价等于主族序数。特:F无正价,非金属除H外不能形成简单离子。
②主族元素的最高正价数与最低负价的绝对值之和等于8.
4.元素周期表和元素周期律应用
①在周期表中的左上角附近探索研制农药的材料。
②半导体材料:在金属与非金属的分界线附近的元素中寻找。
③在过渡元素中寻找优良的催化剂和耐高温、耐腐蚀的合金材料。
5. 元素周期表中元素性质的递变规律
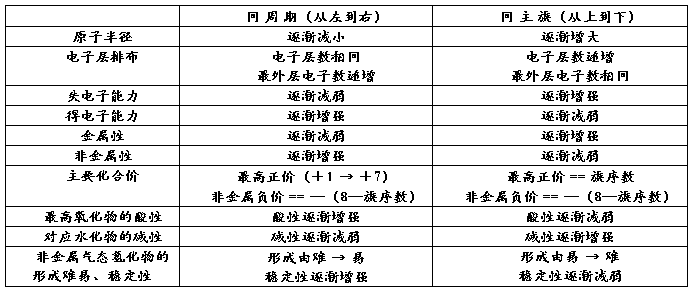
总结:
元素金属性的判断:
1.与水反应的难易程度(越容易反应,金属性越强)
2.与水、酸反应的剧烈程度(越剧烈,越活泼、金属性越强)
3.最高价氧化物水化物(氢氧化物)的碱性 (对应碱的碱性越强,金属性越强)
例如(碱性NaOH>Mg(OH)2>Al(OH)3 ,可判断金属性Na>Mg>Al)
元素非金属性的判断:
1.与氢气反应的难易程度
(1)越容易反应,金属性越强;
(2)现象越剧烈,金属性越强;
(3)生成的氢化物越稳定,金属性越强。如稳定性HF>HCl>HBr>HI,可判断非金属性F2>Cl2>Br2>I2),由于HI最不稳定,很容易失去氢离子,所以HI酸性最强,相对的,HF酸性最弱。
2.最高价氧化物水化物(最高价含氧酸)的酸性。注意:一定是最高价的含氧酸的比较。例如要比较Cl和S的非金属性,应比较HClO4(Cl+7价)和H2SO4(S+6价)的酸性强弱,不能比较HClO4和H2SO3(S+4价)的酸性强弱。由酸性HClO4>H2SO4 >H3PO4 得出非金属性Cl>S>P,反之,因为Cl>S>P,所以酸性HClO4>H2SO4 >H3PO4
第三节 化学键
一.离子键
1.离子键:阴阳离子之间强烈的相互作用叫做离子键。
相互作用:静电作用(包含吸引和排斥)
注:(1)成键微粒: 阴阳离子间
(2)成键本质: 阴、阳离子间的静性作用
(3)成键原因:电子得失
(4)形成规律: 活泼金属和活泼非金属化合时形成离子键
离子化合物:像NaCl这种由离子构成的化合物叫做离子化合物。
(1)活泼金属与活泼非金属形成的化合物。如NaCl、Na2O、K2S等
(2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等
(3)大多数盐:如Na2CO3、BaSO4
(4)铵盐:如NH4Cl
小结:一般含金属元素的物质(化合物)+铵盐。(一般规律)
注意:(1)酸不是离子化合物。
(2)离子键只存在离子化合物中,离子化合物中一定含有离子键。
2、电子式
电子式:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
用电子式表示离子化合物形成过程:
(1)离子须标明电荷数; (2)相同的原子可以合并写,相同的离子要单个写; (3)阴离子要用方括号括起; (4)不能把“→”写成“=”; (5)用箭头标明电子转移方向(也可不标)。
二.共价键
1.共价键:原子间通过共用电子对所形成的相互作用叫做共价键。
用电子式表示HCl的形成过程:
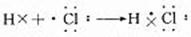
注:(1)成键微粒: 原子
(2)成键实质: 静电作用
(3)成键原因: 共用电子对
(4)形成规律: 非金属元素形成的单质或化合物形成共价键
2.共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
化合物 离子化合物
共价化合物 化合物中不是离子化合物就是共价化合物
3.共价键的存在:
非金属单质:H2、X2、N2等(稀有气体除外)
共价化合物:H2O、 CO2、SiO2、 H2S等
复杂离子化合物:强碱、铵盐、含氧酸盐
4.共价键的分类:
非极性键:在同种元素的原子间形成的共价键为非极性键。共用电子对不发生偏移。
极性键:在不同种元素的原子间形成的共价键为极性键。共用电子对偏向吸引能力强的一方。
三.电子式:
定义:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
原子的电子式: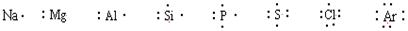
2.阴阳离子的电子式:
(1)阳离子 简单阳离子:离子符号即为电子式,如Na+、、Mg2+等
复杂阳离子:如NH4+ 电子式: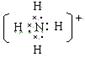
(2)阴离子 简单阴离子: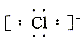 、
、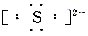
复杂阴离子: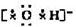
3.物质的电子式:
离子的电子式:阳离子的电子式一般用它的离子符号表示;在阴离子或原子团外加方括弧,并在方括弧的右上角标出离子所带电荷的电性和电量。
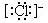
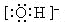
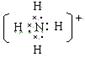
分子或共价化合物电子式,正确标出共用电子对数目。
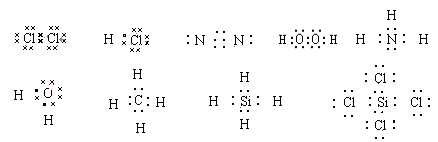
 离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。阴离子电荷总数与阳离子
离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。阴离子电荷总数与阳离子
4.用电子式表示形成过程:
用电子式表示单质分子或共价化合物的形成过程
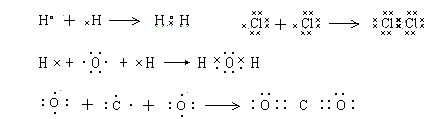
用电子式表示离子化合物的形成过程
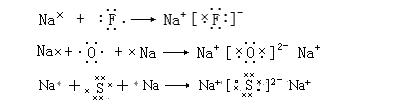
四、分子间作用力和氢键
1、分子间作用力
⑴定义:把分子聚集在一起的作用力,又称范德华力。
⑵特点:①分子间作用力比化学键弱得多;
②影响物质的熔点、沸点、溶解性等物理性质;
③只存在于由共价键形成的多数共价化合物和绝大多数气态非金属单质分子,及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在分子间作用力。
⑶变化规律:一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔沸点也越高。例如,熔沸点:I2>Br2>Cl2>F2。
2、氢键
⑴定义:分子间存在着一种比分子间作用力稍强的相互作用。
⑵形成条件:除H原子外,形成氢键的原子通常是N、O、F。
⑶存在作用:氢键存在广泛,如H2O、NH3、HF等。
分子间氢键会使物质的熔点和沸点升高。
五、化学反应的实质:
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成过程。
离子键、共价键与离子化合物、共价化合物的关系
提高篇:一、化学键与物质类别关系规律
1、只含非极性键的物质:同种非金属元素构成的单质,如:I2、N2、P4、金刚石、晶体硅等。
2、只含有极性键的物质:一般是不同非金属元素构成的共价化合物、如:HCl、NH3、SiO2、CS2等。
3、既有极性键又有非极性键的物质:如:H2O2、C2H2、CH3CH3、C6H6等。
4、只含有离子键的物质:活泼非金属与活泼金属元素形成的化合物,如:Na2S、NaH、K2O、CsCl等。
5、既有离子键又有非极性键的物质。如:Na2O2、Na2S2、CaC2等。
6、既有离子键又有极性键的物质,如NaOH等。
7、由离子键、共价键、配位键构成的物质,如:NH4Cl等。
8、由强极性键构成但又不是强电解质的物质。如HF等。
9、无化学键的物质:稀有气体。
10、离子化合物中并不存在单个的分子,例如:NaCl,并不存在NaCl分子。
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
人教版高一化学必修一知识点总结
一重点聚焦1混合物的分离原理和分离方法2混合物分离方法的操作3离子的检验及检验试剂的选择4物质分离与提纯过程的简单设计5物质的量及…
-
人教版高中化学必修1的每章知识点总结
高中化学必修一知识点总结必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当…
-
人教版高一化学必修一知识点总结
人教版高一化学必修一知识点总结新课标化学必修一第三章金属及其化合物1金属的化学性质1学习方法2研究一种物质的性质的程序观察物理性质…
-
人教版化学必修一第二章知识点总结A4 -终极版
根据分散剂的状态划分液溶胶如AgI胶体FeOH3胶体AlOH3胶体固溶胶如烟水晶有色玻璃合金2FeOH3胶体的制备硅酸胶体的制备碘…
-
高中化学必修二知识点总结ツ寓言
高中化学必修二知识点总结第一章物质结构元素周期律周期同一横行周期序数=电子层数类别周期序数起止元素包括元素种数核外电子层数短周期1…
-
人教版化学必修二第一章 知识点总结提高篇
夯实基础提高能力满分答卷持之以恒嘉祥一中高一化学系列之知识清单第一章物质结构元素周期表提高篇一周期表中特殊的周期和族1没有金属元素…
-
人教版化学必修二第一章知识点总结
第一章物质结构元素周期表第一节元素周期表一、周期表原子序数=核电荷数=质子数=核外电子数1、依据横行:电子层数相同元素按原子序数递…
-
人教版化学必修二第一章知识点总结
第一章物质结构元素周期表第一节元素周期表一、周期表原子序数=核电荷数=质子数=核外电子数1、依据横行:电子层数相同元素按原子序数递…
-
高中化学必修2知识点归纳总结第一章
第一章物质结构元素周期律一原子结构Z个原子核注意N个质量数AZN1原子序数质子数核外电子Z个熟背前20号元素熟悉120号元素原子核…
-
人教版化学必修2有机物知识点总结
一、化石燃料化石燃料:煤、石油、天然气天然气的主要成分:CH4石油的组成元素主要是碳和氢,同时还含有S、O、N等。主要成分各种液态…