【人教版】高中化学必修1知识点总结:第四章非金属及其化合物
第四章 非金属及其化合物
课标要求
1.了解氯、氮、硫、硅等非金属及其重要化合物的主要性质
2.认识其在生产中的应用和对生态环境的影响。
要点精讲
一、本章知识结构框架

二、本章知识结构梳理
(一)硅及其化合物
1、二氧化硅和二氧化碳比较

2、硅以及硅的化合物的用途

(二)氯
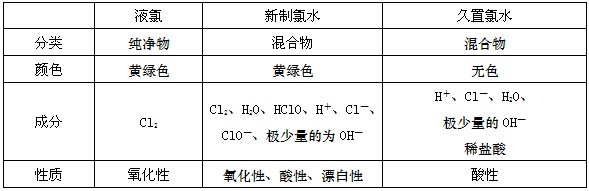
1、液氯、新制的氯水和久置的氯水比较
2、氯气的性质

(三)硫、氮
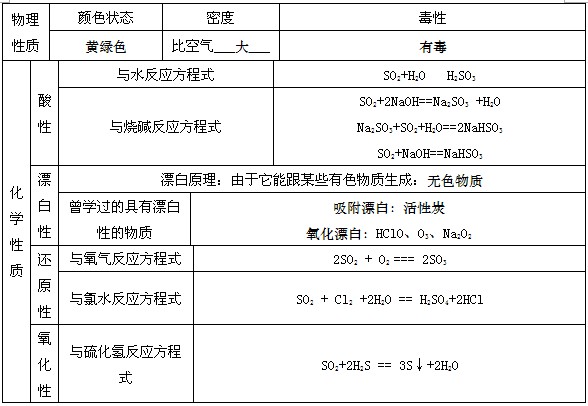
1、二氧化硫的性质
硫
硫黄晶体色黄, 火山口处有埋藏。
二硫化碳去溶解,扔在河中水底淌。
无色有毒味刺激,易溶于水易液化。
二氧化硫
此气无色有毒性,容易液化坏环境。
与水与氧或漂白,反应都可逆进行。
2、浓硫酸和浓硝酸的性质
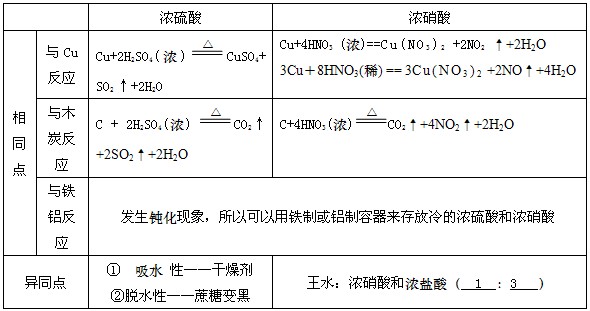
浓硫酸
硫酸稳定沸点高,制酸试剂多奇招。
加热与铜碳反应,强氧化性本领高。
硫酸吸水又脱水,干燥剂中大英豪。
碱性气体需回避,还原物质逃不掉。
硝酸
挥发分解都容易,金属反应无氢气。
能把碳硫来氧化,常温铁铝做容器。
3、氨气、氨水与铵盐的性质

氮气
性质稳定空气中,特殊条件也作用。
放电氧化续二度,有水硝酸也生成,
氨
气轻味臭易液化,液氨气化温骤下。
铵盐与碱共制取,混合一起把热加。
易溶于水成喷泉,氨成氨水弱碱显。
靠近盐酸白烟起,可制氮肥酸式盐。
第二篇:高中化学必修1(人教版)第三章 金属及其化合物知识点讲解
第三章 金属的化学性质
知识点1 对金属的整体把握
1、绝大数金属是以化合物的形式存在于自然界,极少数以游离态存在(Ag 、Cu、 Au) 原因:因为大多数金属单质有较强的还原性,化学性质活泼
2、从原子结构出发,以Na 、Mg 、Al为例说明其化学性质
P.S.活泼金属在空气中易与氧反应,表面形成氧化膜
疏松:Fe
致密:Mg、Al
3、焰色反应:Na(黄色) K(紫色,需透过钴玻璃) Cu(绿色) Ba(黄绿色)
知识点2 钠单质及其化合物
一 、物理性质
金属钠银白色,硬度:软,密度小,熔沸点低,导电性、导热性良好
二 、化学性质
单质
1、与非金属反应(O2、Cl2、S):表现强还原性,被氧化
1)常温下:4Na + O2=== 2Na2O (白色)
常温下金属钠在空气中表面变暗,生成氧化膜,说明钠比Al、Fe活泼得多
(应用)钠保存在石蜡油或煤油中,因为钠易与水或者空气中的氧气反应,而钠
不与煤油反应,且钠的密度大于煤油的密度,所以保存在煤油中。
2)受热时:2Na + O2=== Na2O2 (淡黄色)
(现象)钠在空气中受热后,先熔化成闪亮的小球后剧烈燃烧产生黄色火焰,生成
淡黄色固体
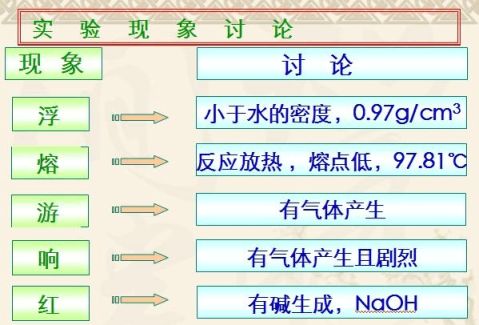
2、与水反应:2Na + 2H2O == 2NaOH + H2↑ (分析电子得失)
现象:
(应用)钠燃烧引起火灾,怎么办?(一般用砂土盖灭)
3、与酸反应:2Na + 2HCl == 2NaCl + H2↑(比水更剧烈)
氧化物
与水:
Na2O + H2O=2NaOH
Na2 与CO2 :Na2O + CO2=Na2CO3 (无O2生成!)
与酸 :Na2O + 2HCl=2NaCl + H2O 与水:2Na2O2 + 2H2O=4NaOH + O2↑
Na2O2 与CO2 :2Na2O2 + 2CO2=2Na2CO3 + O2 (有O2)
与酸 :2Na2O2 + 4HCl=4NaCl + 2H2O + O2↑
(应用)呼吸面具或潜水艇中的氧气来源
碳酸盐及碳酸氢盐
物质 俗名 颜色、状
态 水溶性
易溶于水
溶解度大小比较: Na2CO3 >NaHCO3
溶液与酚
酞
1、 两者的水溶液呈碱性,使酚酞溶液变红
2、 热稳定性:2NaHCO3== Na2CO3+ H2O+ CO2↑ 可用于鉴别Na2CO3和NaHCO3 3、 与酸反应:
变红
颜色深浅比较: Na2CO3 > NaHCO3
变红 能溶于水
Na2CO3 苏打、纯碱 白色固体
NaHCO3 小苏打 白色粉末
小练:
1、将一小块新切的不规则形状的金属钠投入到滴有酚酞溶液的水中,观察到下列现象,
其中可说明钠与水反应放出气体的现象是( )
A、金属钠浮在水面上 B、金属钠形成小球状 C、金属钠在水面上迅速游动 D、反应后的溶液呈现红色 2、将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可以观察到的现象
是 ( )
A.钠浮在煤油层上,不反应 B.钠沉在煤油层下,不反应
C.钠沉在煤油层下,浮在水层上,在交界处剧烈反应 D.钠沉在水层下剧烈反应
3、能正确表示下列反应的离子方程式的是( )
+-
A.钠与水反应:2Na+2H2O===2Na+2OH+H2↑ B.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
C.钠与盐酸反应:Na+2H+===Na++H2↑
D.钠跟氯化钾溶液反应:2Na+2H2O===2Na++2OH-+H2↑
4.下列有关Na2CO3和NaHCO3性质的比较中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.与同浓度的稀盐酸反应的快慢:Na2CO3>NaHCO3
C.等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3
D.常温时溶解度:Na2CO3>NaHCO3
5.下列有关钠的叙述正确的是
①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在石蜡油或煤油中
③钠投入食盐溶液中可以发生反应 ④钠投入硫酸铜溶液中反应生成单质铜
⑤钠在自然界中以化合态形式存在
A.②④⑤ B.①②③ C.②③⑤ D.②③④
知识点3 铝及其化合物
铝单质


与酸:
与碱:
铝制餐具不能用来蒸煮或长时间存放酸性、碱性或咸食物
两性!!!
氧化物
注意看课本48页铝箔的加热试验
与酸:
与碱:
氢氧化物
Al(OH)3,白色胶体物质,不溶于水,可凝聚悬浮物,吸附色素,起净水功能。
制取Al(OH)3:Al(SO4)3+6NH3·H2O=2 Al(OH)3↓﹢3(NH4)2SO4
与酸: 可作医用胃酸中和剂
与碱:
受热分解:
注意:明矾(作净水剂),化学式KAl(SO4)2
6、下列生产、生活中的事例不属于氧化还原反应的是 ...
A.铝的表面生成致密的薄膜 B.大理石雕像被酸雨腐蚀毁坏
C.食物腐败 D.燃放烟花
7、完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓
度的AgNO3溶液的体积比为3∶2∶1,则上述溶液的体积比为( )
A.1∶1∶1 B.3∶2∶1
C.6∶3∶2 D.9∶3∶1
8、若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是( )
3+2--+A.Fe、SO4、Cl、Na
2+2+--B.Ba、Mg、HCO3、AlO2
C.NO3-、Na+、K+、CO32-
-+--D.NO3、K、AlO2、OH
9、如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0 g固体,配成1 L溶液,请计算:

(1)所得氢氧化钠溶液的物质的量浓度?
(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入足量的金属铝,完全反应后,产生的气体在标准状况下的体积?
知识点4 铁及其化合物
单质
铁与稀酸的反应:Fe+2H==Fe
+
2+
+H2↑
氧化物
1、 铁的氧化物(FeO、Fe2O3、Fe3O4) 是否溶于水???

2、 FeO、Fe2O3是碱性氧化物,能与酸反应 FeO+2H+==Fe2++H2O Fe2O3+6H+==2Fe3+ +3H2O
氢氧化物
化 学 式 名 称 溶液颜色
二价铁
三价铁
FeCl2
氯化亚铁 浅绿色
现象:产生白色沉淀,迅速变成灰绿色,最后变成红褐色。
FeCl3
氯化铁 黄色
现象:产生红褐色沉淀
与氢氧化钠
FeCl2+2NaOH ==Fe(OH)2↓+2NaCl FeCl3+3NaOH ==Fe(OH)3 ↓+ 3NaCl 4Fe(OH)2+O2+2H2O ==4Fe(OH)3
产生血红色
与KSCN溶液
无现象
Fe3++3SCN-==Fe(SCN)3
主要表现: 还原性,举例:
氧化(还原性)
表现:氧化性,举例:
2FeCl2+Cl2 ==2FeCl3
FeCl2
3

: 2FeCl2+Cl2 ==2FeCl3
2FeCl3+Fe==3FeCl2
FeClFeCl2: 2FeCl3+Fe==3FeCl2
氢氧化铁
相互转化 名 称 化学式 颜色、状态 水溶性 与酸反应 氢氧化亚铁露置空气中
氢氧化亚铁
Fe(OH)2
白色固体 难溶于水
Fe(OH)3
红褐色固体 难溶于水
Fe(OH)2+2HCl==FeCl2+2H2O Fe(OH)2+2H+==Fe2++2H2O
Fe(OH)3+3HCl==FeCl3+3H2O Fe(OH)3+3H+==Fe3++3H2O
4Fe(OH)2+O2+2H2O ==4Fe(OH)3
Fe(III)的检验:向溶液滴加少量KSCN溶液,若溶液变红色,则存在Fe(III),否则则没有。
小练:
10、能与Fe3+作用,且可证明Fe3+具有氧化性的是
A.SCN B、Fe C、OH D、Cu
11、能正确表示下列化学反应的离子方程式的是
+ 3+- 2+ - A.铁与稀盐酸反应: 2Fe + 6H= 2Fe + 3H2↑
--B.铝粉投入到NaOH溶液中: Al+2OH══ AlO2+H2↑
C.氯化铁溶液中加入铁粉: 2Fe3+ + Fe══3Fe2+
D.AlCl3溶液中加入足量的氨水: Al+ 3OH══ Al(OH)3↓
12、某工厂排放的工业废水中含Fe、Al、Cu,工厂为了减少环境污染,变废为宝,利
用废铁屑和其他化学试剂进行如下操作,得到了铁红、Al2O3和金属Cu,回答下列问题:
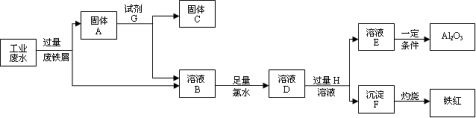
3+3+2+3+-
(1)固体A的成分是 。(用化学式表示)
(2)写出B→D的离子方程式 ;该反应中氧化剂
是 ;2molCl2参加反应转移电子是 mol。溶液D中滴加KSCN
溶液的现象是 。
(3)溶液E焰色反应呈黄色,试剂H是 (用化学式表示);D→E反应的离子
方程式是 。
(4)分别写出铁红和氧化铝在工业上的一种主要用途:铁红 ;氧
化铝 。
13、“服用维生素C可使食物中的三价铁离子变成二价铁离子”这句话说明
A.维生素C本身被还原 B.维生素C具有还原性
C.维生素C具有氧化性 D.维生素C发生了还原反应
14、焰火“脚印”.“笑脸”.“五环”,让北京奥运会开幕式更加辉煌.浪漫,这与高中化学
中“焰色反应”知识相关。下列说法中正确的是
A.非金属单质燃烧时火焰均为无色 B.所有金属及其化合物灼烧时火焰均有颜色
C.焰色反应均应透过蓝色钴玻璃观察 D.NaC1与Na2CO3灼烧时火焰颜色相同
知识点5 合金
记住:金属材料包括纯金属和他们的合金
合金的硬度可大于其纯金属成分,较脆
合金的熔点可低于其成分金属
练习答案
1---6 C C AD D C B
7 解析:选D。等物质的量浓度的AgNO3溶液体积比为3∶2∶1,则消耗Ag+的物质的量为
13∶2∶1,故需NaCl、MgCl2、AlCl3的物质的量之比为:3∶1∶,即为9∶3∶1,则体积比3
为9∶3∶1。
-8、解析:选B。与Al反应放出H2,说明溶液可能呈酸性也可能是碱性,B项中HCO3在酸性、
碱性时均不能存在。
9、解析:n(NaOH)=m(NaOH)24.0 g=0.6 mol, M(NaOH)40 g/moln(NaOH)0.6 molc(NaOH)=0.6 mol/L。 V[NaOH(aq)]1 L
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 mol 22.4 L×3
0.6 mol/L×0.2 L V
0.6 mol/L×22.4 L×3×0.2 LV=4.032 L。 2 mol
答案:(1)0.6 mol/L (2)4.032 L
10 D
11 C
12、
(1)(2分,各1分)Fe Cu
(2)(共5分)2 Fe2+ + Cl2 = 2 Fe3+ + 2 Cl-(2分);Cl2(1分);4(1分);
溶液变红色(1分)
(3)(共3分)NaOH(1分);Al3+ + 4OH- = AlO2-+2 H2O(2分)
(4) (2分,各1分)红色油漆或涂料等;耐火材料
13、B
14、D
-
高中物理必修一知识点系统总结
高中物理必修一知识点系统总结人教版第一章运动的描述考点一时刻与时间间隔的关系时间间隔能展示运动的一个过程时刻只能显示运动的一个瞬间…
-
高中物理知识点总结新人教版必修1
12345补充直线运动的图象1从St图象中可求任一时刻物体运动的位移物体运动速度的大小直线或切线的斜率大小图线向上倾斜表示物体沿正…
-
人教版高中物理必修1知识点系统总结
物理必修一知识考点归纳第一章运动的描述考点一时刻与时间间隔的关系时间间隔能展示运动的一个过程时刻只能显示运动的一个瞬间对一些关于时…
-
高中物理_知识点总结__新人教版必修1(免费下载)
12345补充直线运动的图象1从St图象中可求任一时刻物体运动的位移物体运动速度的大小直线或切线的斜率大小图线向上倾斜表示物体沿正…
-
高中物理知识点总结新人教版必修1
12345补充直线运动的图象1从St图象中可求任一时刻物体运动的位移物体运动速度的大小直线或切线的斜率大小图线向上倾斜表示物体沿正…
-
人教版高中化学必修1前两单元知识点总结
必修1知识点总结从实验学化学一、化学实验安全1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等…
-
高一化学必修一第一章知识总结
高一化学必修一第一章知识总结1.1.化学实验基本方法1.1.1化学实验安全A.常见危险化学品爆炸品:KClO3KMnO4KNO3易…
- 高中化学 必修一第四章知识点总结(详细)
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
- 高中化学__必修一第三第四章知识点总结(详细)
-
人教版必修1高中化学方程式总结知识归纳
化学(必修一)知识归纳一、教材中涉及的离子检验物质检验的一般步骤:取试样———加试剂———观现象———定结论1、SO42-的检验:…