#试做实验报告正文
实验一 分析天平的使用和称量练习
一、实验目的
1. 了解分析天平的构造。
2. 学会用直接法和减量法称量试样。
3. 加深对有效数字的认识。
4. 培养准确、简明地记录实验原始数据的习惯。
二、实验原理
使用杠杆原理制成的分析天平可直接称取某一物体的质量,也可利用减量法称取某些易吸水、易吸收空气中CO2的物质,即两次称重之差就是所要称取物质的质量。
三、仪器与试剂
仪器: 托盘天平,分析天平,称量瓶,小坩埚,
试剂: Na2CO3固体(仅供称量使用)
四、实验步骤
(一) 外观检查
1. 检查砝码是否齐全,各砝码位置是否正确,圈码是否完好并正挂在圈码勾上,读数盘的读数是否在零位。
2. 检查天平是否处于休止状态,天平梁和吊耳的位置是否正常。
3. 检查天平是否处于水平位置,如不水平,可调节天平箱前下方的两个调水平螺丝,使气泡水准器中的气泡位于正中。
4. 天平盘上如有灰尘或其它落入的物体,应该用软毛刷轻扫干净。
(二) 称量练习
1. 直接法称量 用叠好的纸条从干燥器中取出干燥的小坩埚,先在托盘天平上粗称其质量(准确至0.1g)记在记录本上。然后按照粗称质量在分析天平上添加砝码,调节指数盘,精确称量,准确读取砝码质量,指数盘读数及投影屏读数(准确至0.1mg),记录下质量m1。
2. 减量法称量 本实验要求用减量法从称量瓶中准确称量出0.2-0.3g固体试样(精确至0.1mg)。
取1只装有试样的称量瓶,粗称其质量,再在分析天平上精确称量,记下质量m2。然后自天平中取出称量瓶,将试样慢慢倾入上面已称出精确质量的小坩埚中。倾样时,由于初次称量,缺乏经验很难一次倾准,因此要试称,即第1次倾出少一些,粗称此量,根据此质量估计不足的量,继续倾出直至符合要求,准确称量,记下质量m3,则m2 – m3即为试样的质量。
3. 再称出“小坩埚 + 试样”的质量,记为m4。则m4 – m1也为试样的质量。
以同样方法准确称出另一小坩埚的质量m5和“称量瓶+试样”的质量m6。从称量瓶中转移0.2-0.3g试样于小烧杯中,再准确称量出倾出试样后“称量瓶+试样”的质量m7和“小坩埚 + 试样”的质量m8。则m6 – m7和m8 – m5即为试样的质量。
五、原始数据与数据处理

六、思考题
1. 无论把物体或砝码从盘上取下或放上去,为什么必须把天平梁完全托起?
答:保护玛瑙刀口。如果刀刃受到损伤,将影响天平的灵敏度及稳定性。
2. 什么情况下用直接法称量?什么情况下则需要用减量法称量?
答:对于一些性质稳定、不沾污天平的物品如表面皿、坩埚等容器,称量时,直接将其放在天平盘上称量其质量。若称量试样的质量是不要求固定的数值,而只要求在一定质量范围内,这时可采用差减称量法。此法适用于易吸水、易氧化或易与二氧化碳作用的物质。
3. 电光分析天平称量前一般要调好零点,如偏离零点标线几小格,能否进行称量?
答:能,如在零点左边,加上相应的质量,如在右边,减去相应的质量即可得出该物质的正确质量。
实验二 NaOH标准溶液
的标定及铵盐中铵态氮含量的测定
一、实验目的
1.学会用基准物质标定标准碱溶液的方法
2.进一步熟悉滴定操作,正确判断滴定终点
3.巩固用减差法称量的操作
4. 掌握甲醛法测定铵盐中铵态氮含量的原理和方法
二、实验原理
氢氧化钠容易吸收空气中的CO2使配得溶液中含有少量Na2CO3,Na2CO3的存在会使NaOH溶液的标定和对酸样品的测定产生误差,配制不含Na2CO3的NaOH标准溶液最常用的方法是取一定量的NaOH的饱和水溶液稀释制成。Na2CO3在饱和NaOH溶液中很难溶解,待Na2CO3沉降后,量取一定量上层澄清液,稀释至所需浓度,即可得含Na2CO3很少的NaOH溶液。
标定NaOH常用的基准物质有H2C2O4·2H2O、KHC2O4、苯甲酸、邻苯二甲酸氢钾等,但最常用的是邻苯二甲酸氢钾。这种基准物容易用重结晶方法制得纯品,不含结晶水,不吸潮,容易保存,摩尔质量较大,称量误差小。标定反应为:
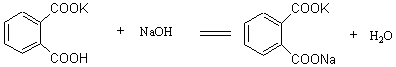
化学计量点时由于弱酸盐的水解,溶液呈微碱性,应采用酚酞为指示剂。
含有铵态氮的氮肥,主要是各类铵盐,如硫酸铵、氯化铵、碳酸氢铵等。除碳酸氢铵可以用标准酸直接滴定外,其他铵盐由于NH4+是一种极弱酸(Ka= 5.6×10-10),不能用标准碱直接滴定。
甲醛法:铵盐与甲醛作用能定量地生成六次甲基四胺酸和强酸,其反应如下:
4 NH4+ + 6HCHO ==== (CH2)6N4H+ + 6H2O +3H+
再以酚酞为指示剂,用NaOH标准溶液滴定反应中生成的酸。
三、仪器及试剂
仪器: 分析天平,50mL滴定管,250mL锥形瓶,称量瓶。
试剂: 酚酞,邻苯二甲酸氢钾(G、R),NaOH溶液(约0.1 mol·L-1),40%甲醛溶液
四、实验步骤
1. 0.1 mol·L-1的NaOH溶液的标定
准确称取已取在105~110℃干燥至恒重的基准邻苯二甲酸氢钾0.4~0.6g,放入250mL锥形瓶中,加入30mL新煮沸刚刚冷却的水使之溶解,加2滴酚酞指示剂,用NaOH准溶液滴定至溶液呈粉红色半分钟内不褪,即为终点。
平行标定三份,计算出NaOH标准滴定溶液的浓度。
2. 铵盐中铵态氮的测定
准确称取1.5~2.0g铵盐试样于100mL烧杯中,加入少量水使之溶解,转入250mL容量瓶中,用水稀释至刻度,摇匀。
用移液管移取25.00mL混匀的试液于250mL锥形瓶中,加入5mL预先用0.1 mol·L-1 NaOH溶液中和(以酚酞为指示剂)的40%甲醛溶液,再加入2滴酚酞指示剂,充分摇匀,静置1min,然后用0.1 mol·L-1的NaOH标准溶液滴定至呈粉红色,即为终点。
平行测定三次,计算出铵盐中铵态氮的含量。
五、原始数据和数据处理
1. NaOH溶液的标定
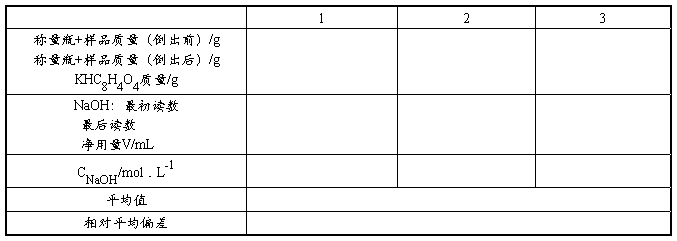
计算公式
 ;
;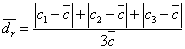
2. 铵盐中铵态氮的测定
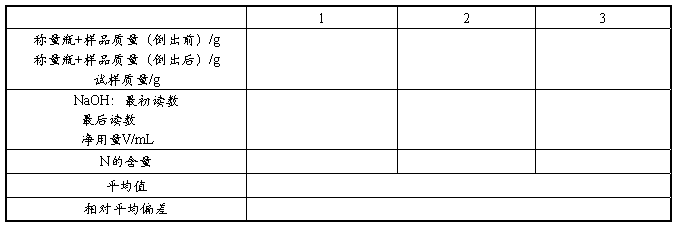
计算公式
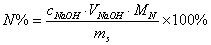 ;
;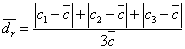
六、思考题
1.滴定管在使用前为什么要用欲盛的标准溶液润洗?加入蒸馏水的量是否要准确?
答:为了防止滴定管中残余的水使标准溶液稀释,产生误差;加入蒸馏水的目的是使基准物溶解,并不影响其物质的量,所以不需准确加入,用量筒量取即可。
2.苯法加入甲醛的作用是什么?
答:铵盐酸性弱,不能用碱直接滴定。加入甲醛使铵盐全部反应
4 NH4+ + 6HCHO ==== (CH2)6N4H+ + 6H2O +3H+
再以NaOH标准溶液滴定反应中生成的四个H+,进行间接测定。
实验三 HCl标准溶液的标定
及混合碱中NaOH和Na2CO3含量的测定
一、实验目的
1.掌握用碳酸钠作基准物标定盐酸标准溶液的原理及方法
2.正确判断甲基橙指示剂的终点
3. 学习用双指示剂法测定混合碱中氢氧化钠及碳酸钠含量的原理和方法
二、实验原理
本实验采用基准无水碳酸钠标定酸液,滴定反应如下:
2HCl+Na2CO3=2NaCl+H2O+CO2
因化学计量点前溶液中碳酸钠与碳酸根组成缓冲体系,不易掌握化学计量点,故近化学计量点时加热煮沸除去二氧化碳,使化学计量点敏锐,选用甲基橙为指示剂,滴定终点时溶液由黄色变成橙色。
混合碱中NaOH和Na2CO3的含量可采用双指示剂法进行测定。所谓双指示剂法,就是利用两种指示剂在不同等量点时颜色变化,得到两个化学计量点,分别根据各化学计量点时所消耗的标准酸溶液的体积,计算各成分的含量。
常用的两种指示剂是酚酞和甲基橙。在含有NaOH和Na2CO3混合碱的试液中,加入酚酞指示剂,用盐酸标准溶液滴定至红色刚刚褪去。由于酚酞的变色范围在pH8~10,此时不仅NaOH完全被中和,Na2CO3也被滴定成NaHCO3,记下此时HCl标准溶液的耗用量V1。再加入甲基橙指示剂,溶液呈黄色,滴定至终点时呈橙色,此时NaHCO3被滴定成H2CO3,HCl标准溶液的耗用量为V2。根据V1、V2可以计算出试液中NaOH及Na2CO3的含量。
三、仪器与试剂
仪器: 分析天平,50mL酸式滴定管,250mL锥形瓶,250mL容量瓶,25mL移液管,电炉。
试剂: 无水碳酸钠(G、R),HCl溶液(0.1 mol·L-1),混合碱试液,0.1%甲基橙水溶液, 0.1%酚酞乙醇溶液。
四、实验步骤
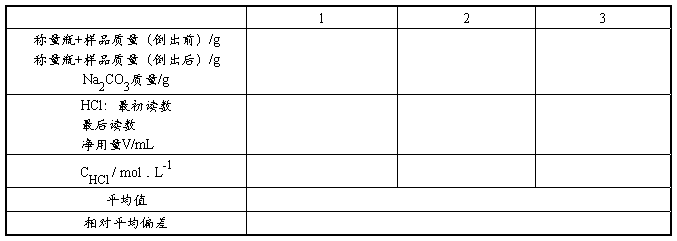
1. 0.1 mol·L-1HCl溶液的标定
准确称取已取在270—300℃干燥至恒重的基准无水碳酸钠约0.11~0.16g,放入250mL锥形瓶中,加入30mL水使之溶解,加1滴甲基橙指示剂,用HCl准溶液滴定至溶液由黄色变为橙色,即为终点。
平行标定三份,计算出HCl标准滴定溶液的浓度。
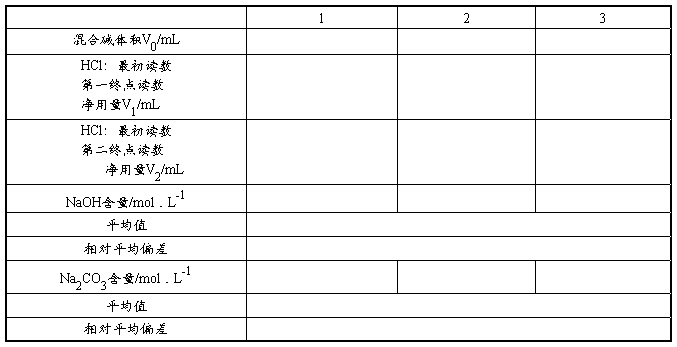
2. 混合碱液中NaOH及Na2CO3含量的测定
准确移取25.00毫升混合碱试液于250毫升锥形瓶中,加1~2滴0.1%酚酞指示剂,用盐酸标准溶液滴定,边滴加边充分摇动,以免局部Na2CO3被直接滴定成H2CO3。慢慢地滴定到酚酞恰好褪色为止。记下所消耗的盐酸标准溶液体积V1。然后再加入1滴甲基橙指示剂,此时溶液呈黄色,继续用盐酸标准溶液滴定到转变为橙色。记下滴定管读数,算出从酚酞褪色到甲基橙变为橙色所消耗的盐酸标准溶液体积V2。
平行测定三份,计算出混合碱液中NaOH及Na2CO3的含量。
五、原始数据及数据处理
1. 0.1 mol·L-1HCl溶液的标定
计算公式
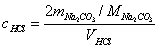 ;
;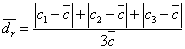
2. 混合碱液中NaOH及Na2CO3含量的测定
计算公式
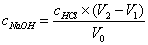 ;
;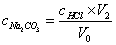
六、思考题
1.硼砂Na2B4O7·10H2O因保存不当,失去部分结晶水,对标定盐酸溶液的浓度有何影响?
答:偏小
2.有一碱液,可能为NaOH、Na2CO3、NaHCO3或它们的混合物。用标准酸滴定至酚酞化学计量点时消耗V1mL,继续以甲基橙为指示剂,滴定又消耗V2mL,若V1小于V2,则此碱液为下列哪一种:
(1) NaOH;(2) Na2CO3;(3)NaHCO3; (4)NaOH+ Na2CO3;(5)Na2CO3+ NaHCO3
答:(5)
实验四 EDTA标准溶液的标定及水硬度的测定
一、实验目的
1. 掌握EDTA标准溶液的配制和标定方法。
2. 掌握配位滴定的原理,了解配位滴定的特点。
3. 了解水的硬度测定方法和常用的硬度表示方法。
4. 掌据EDTA法测定水硬度的原理。
5. 掌握铬黑T和钙指示剂的使用条件和终点变化。了解缓冲溶液的应用。
二、实验原理
配位滴定中通常使用的配位剂是乙二胺四乙酸的二钠盐(Na2H2Y·2H2O,习惯上称作EDTA),其水溶液pH为4.4左右。若pH偏低,应该用NaOH溶液中和到pH=5左右,以免溶液配制后有乙二胺四乙酸析出。通常采用间接法配制标准溶液,然后进行标定。
标定EDTA溶液的基准物常用的有Zn,ZnO,Cu,Pb,CaCO3,MgSO4·7H2O等。选用标定条件应尽可能与测定条件一致,以免引起系统误差。如果用被测元素的纯金属或化合物作基准物就更理想。
用金属锌为基推物,先把Zn溶解制成Zn标难溶液,用铬黑T(EBT)作指示剂,在NH3·H2O-NH4Cl缓冲溶液(pH=l0)中进行标定,其反应如下:
滴定前:
 Zn2+ + In3-
Zn2+ + In3-  ZnIn
ZnIn
(纯蓝色) (酒红色)
 滴定开始至终点前: Zn2+ + Y4-
滴定开始至终点前: Zn2+ + Y4-  ZnY2-
ZnY2-
 终点时: ZnIn + Y4-
终点时: ZnIn + Y4-  ZnY2- + In3-
ZnY2- + In3-
(纯蓝色)
所以终点时溶液从酒红色变为纯蓝色。
用Zn作基准物也可用二甲酚橙为指示剂,六亚甲基四胺作缓冲剂,在PH=5~6进行标定。终点时溶液颜色由紫红色变为亮黄色。
用CaCO3作为基准物时,首先用盐酸把CaCO3溶解制成钙标准液,用K—B指示剂在氨性缓冲溶液中进行标定。用EDTA溶液滴定至溶液由紫红色变为蓝绿色即为终点。
水的总硬度指水中Ca2+、Mg2+的含量,可用物质的量浓度nmol·L-1,表示。也用质量浓度ng·L-1表示,即用度“°”来表示,l L水小含有10 mgCaO时为l°。工农业用水、饮用水对硬度都有一定要求,如硬度大于l0 nmol·L-1,的水就不可饮用.测定水的总硬度有很重要的实际意义。
在pH=10的氨性缓冲溶液中.以铬黑T为指示刘、用EDTA滴定法测定水的总硬度是国际规定的标准方法.适用于生活饮用水、锅炉用水、冷却水、地下水及没有严重污染的地表水的测定。
测定Ca2+、Mg2+总量时,在pH=10的缓冲溶液中,加入铬黑T指示剂,然后用EDTA滴定,铬黑T和EDTA分别都能与Ca2+、Mg2+生成配合物,它们的稳定性有下列次序: CaY2->MgY2->MgIn >CaIn。因此,当加入铬黑T后,铬黑T首先与Mg2+结合生成稳定的紫红色配合物。而当滴入EDTA时,EDTA则先与游离的Ca2+结合,其次与游离的Mg2+结合,最后夺取与铬黑T结合的Mg2+,使铬黑T的阴离子HIn2-游离出来,这时溶液由紫红色变为纯蓝色,即为滴定终点。由EDTA标准溶液的浓度和用量,可计算出水中Ca2+、Mg2+的总量。
再在pH=12的溶液中,将Mg2+沉淀为Mg(OH)2后,以钙红为指水剂,用EDTA滴定,可测得水中Ca2+含量,根据总硬度.就可算出Mg2+含量。
测定时,Fe3+,A13+,Cu2+,Pb2+,Zn2+等有干扰,Fe3+和A13+可用三乙醇胺掩蔽,Cu2+,Pb2+和Zn2+等重金属则可用KCN或Na2S等掩蔽。
如果水样中没有或极少有Mg2+时,终点变色不够敏锐,这时应加入少量的MgNa2Y溶液或改用酸性铬蓝K作指示剂。
三、仪器和试剂
仪器:150mL、250mL和500mL烧杯,250 mL容量瓶,10mL量筒,250mL锥形瓶,25mL移液管,50 mL酸式滴定管。
试剂:
1. 乙二胺四乙酸二钠 (Na2H2Y·2H2O,固体,AR)
2. 氨性缓冲溶液(pH=10):67gNH4Cl溶于300mL蒸馏水中,加入570mL氨水,稀释至1L。
3. 锌粉或锌片(固体.AR)
4. 1:1HCl溶液:一份浓盐酸注入一份纯水中,等体积混匀。
5. 1:1氨水:一份浓氨水与一份纯水等体积混匀
6. 铬黑T:1g铬黑T加100 gNaCl.研细。
四、实验步骤
1. 0.02 mo1·L-1锌标准溶液的配制
准确称取纯金属锌0.33—0.35g,置于150mL烧杯中,盖上表面皿,从杯嘴处缓慢加入10mLl:1HCl溶液,在水浴上加热,使其完全溶解,冷却后,冲洗表面皿及杯壁,定量转移至250 mL容量瓶中,定容后摇匀。计算锌标准溶液的准确浓度。
2. EDTA溶液浓度的标定
以铬黑T为指示剂: 准确移取25.00 mL锌标淮溶液于锥形瓶中,仔细滴加1:1氨水至开始出现白色Zn(OH)2沉淀,经摇动沉淀慢慢消失为止,加入10 mL氨性缓冲溶液和铬黑T3滴,用EDTA溶液滴定,溶液由酒红色变成纯蓝色即为终点,平行测定3次,其体积之差不得超过0.04mL。取平均值,计算EI)TA的准确浓度。
3. 水的总硬度测定
用移液管吸取自来水样100.00 mL于锥形瓶中,加5mL氨性缓冲溶液,再加少量铬黑T至溶液呈紫红色,立即用EDTA标准溶液滴定。要用力摇动,近终点时要慢滴多摇,至溶液由紫红色变为纯蓝色为终点。平行测定3次,所用体积相差不得超过0.04mL。
若水中HCO3-含量较高,加入缓冲溶液后会出现CaCO3等沉淀,使测定无法进行。可事先加入1:1HCl溶液2滴,煮沸,除去CO2,冷却后再进行测定。结果用度(°)表示。
1°=10 mg·L-1CaO
五、原始数据和数据处理
1. EDTA溶液浓度的标定
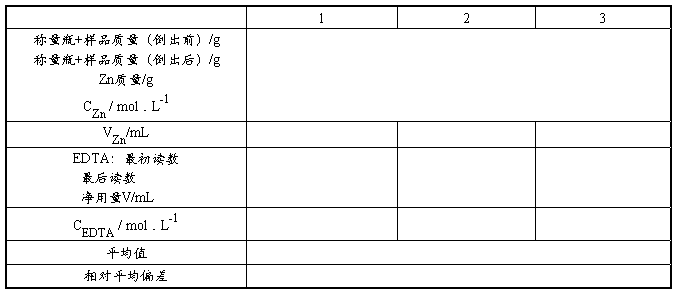
计算公式
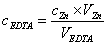
2. 水的总硬度测定
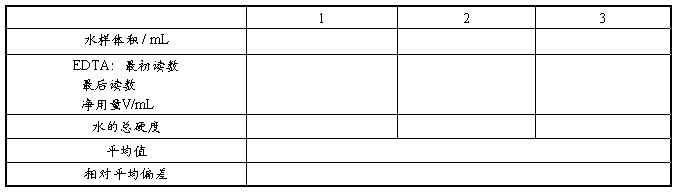
计算公式
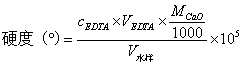
六、思考题
1. 在配位滴定中,指示剂应具备什么条件?
答:(1)指示剂与金属离子形成的配合物的颜色应与指示剂本身的颜色有明显区别;
(2)指示剂与金属离子形成的配合物稳定性要适当。既要保证配合物有足够的稳定性,防止终点提前,又要使其稳定性小于EDTA与金属离子配合物的稳定性,防止指示剂的封闭;
(3)指示剂与金属离子的反应必须进行迅速,且有良好的稳定性。
2. 若调节溶液pH=10的操作中,加入很多氨水后仍不见有白色沉淀出现,是何原因?应如何避免?
答:不见白色沉淀的原因是Zn2+与氨水形成可溶性的配合物,为避免此现象应逐滴加入氨水。
实验五高锰酸钾法测定水样中化学需氧量(COD)
一、实验目的
1. 掌握酸性高锰酸钾法测定水中COD的分析方法
2. 了解测定COD的意义
二、实验原理
化学需氧量(COD)是指在特定条件下,采用一定的强氧化剂处理水样时,水样中需氧污染物所消耗的氧化剂的量,通常以相应的氧量(O2,mg·L-1)来表示。COD是表示水体或污水的程度的重要综合性指标之一,反映了水体受还原性物质污染的程度。水中除含有NO2-、S2-、Fe2+等无机还原性物质外,还含有少量的有机物质。有机物腐烂促使水中微生物繁殖,污染水质。
COD的测定分为酸性高锰酸钾法、碱性高锰酸钾法和重铬酸钾法,一般情况下多采用酸性高锰酸钾法,此法简便、快速,适合于测定地面水、河水等污染不十分严重的水质。工业污水及生活污水中含有较多的成分复杂的污染物质,宜用重铬酸钾法。
本实验采用酸性高锰酸钾法。方法提要是:在酸性条件下,向被测水样中定量加入高锰酸钾溶液,加热使高锰酸钾与水样中有机污染物充分反应,过量的高锰酸钾则加入一定量的草酸钠还原,最后用高锰酸钾溶液返滴定过量的草酸钠。反应方程式如下:
2MnO4- + 5C2O42- + 16H+ ==== 2Mn2+ + 10CO2(g) +8H2O
三、仪器与试剂
仪器: 托盘天平,万分之一电子天平,250mL容量瓶,酸式滴定管
试剂: 0.013mol·L-1 Na2C2O4标准溶液 准确称取基准Na2C2O4 0.42 g左右溶于少量的蒸馏水中,定量转移至250 mL容量瓶中,稀释至刻度,摇匀,计算其浓度
0.005 mol·L-1高锰酸钾溶液,硫酸(1︰2),硝酸银溶液(w 为0.10)
四、实验步骤
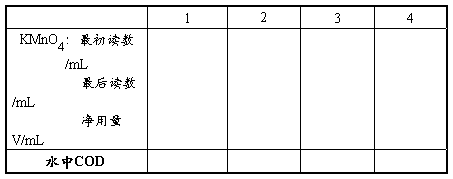
1.取适量水样于250 mL 锥形瓶中,用蒸馏水稀释至100 mL,加1︰2硫酸10 mL,再加入w 为0.10硝酸银溶液5 mL以除去水样中Cl-(当水样中Cl-浓度很小时,可以不加硝酸银),摇匀后准确加入0.005 mol·L-1高锰酸钾溶液10.00mL(V1),将锥形瓶置于沸水浴中加热30 min,氧化需氧污染物。稍冷后(~80℃),加0.013 mol·L-1 Na2C2O4标准溶液10.00 mL,摇匀(此时溶液应为无色),在70~80℃的水浴中用0.005 mol·L-1高锰酸钾溶液滴定至微红色,30 s内不褪色即为终点,记下高锰酸钾的用量为V2。
2.在250 mL锥形瓶中加入蒸馏水100 mL和1︰2硫酸10 mL,移入0.013 mol·L-1 Na2C2O4标准溶液10.00 mL,摇匀,在70~80℃的水浴中,用0.005 mol·L-1高锰酸钾溶液滴定至溶液呈微红色,30 s内不褪色即为终点,记下高锰酸钾的用量为V3。
3. 在250 mL锥形瓶中加入蒸馏水100 mL和1︰2硫酸10 mL,在70~80℃下,用0.005 mol·L-1高锰酸钾溶液滴定至溶液呈微红色,30 s内不褪色即为终点,记下高锰酸钾的用量为V4。
按下式计算化学需氧量COD(Mn)
COD(Mn)=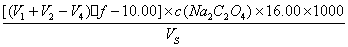
式中f = 10.00/(V3-V4),即每毫升高锰酸钾相当于f mL草酸钠标准溶液,Vs为水样体积,16.00为氧的相对原子量。
五、原始数据和数据处理
六、思考题
1. 哪些因素影响COD测定的结果,为什么?
1.有机物种类:对于主要含烃类、脂肪、蛋白质以及挥发性物质(如乙醇、丙酮等)的生活污水和工业废水,其中的有机物大多数可以氧化90%以上,象吡啶、甘氨酸等有机物则难以氧化。
2.加热方法:本实验在加热氧化有机污染物时,完全敞开,如果废水中易挥发性化合物含量较高时,应使用回流冷凝装置加热,否则结果将偏低。水样中Cl-在酸性高锰酸钾中能被氧化,使结果偏高。
2.水中化学需氧量的测定有何意义?测定水中化学需氧量有哪些方法?
化学需氧量(COD)是指在特定条件下,采用一定的强氧化剂处理水样时,水样中需氧污染物所消耗的氧化剂的量,通常以相应的氧量(O2,mg·L-1)来表示。COD是表示水体或污水的程度的重要综合性指标之一,反映了水体受还原性物质污染的程度。水中除含有NO2-、S2-、Fe2+等无机还原性物质外,还含有少量的有机物质。有机物腐烂促使水中微生物繁殖,污染水质。
COD的测定分为酸性高锰酸钾法、碱性高锰酸钾法和重铬酸钾法,一般情况下多采用酸性高锰酸钾法,此法简便、快速,适合于测定地面水、河水等污染不十分严重的水质。工业污水及生活污水中含有较多的成分复杂的污染物质,宜用重铬酸钾法。
实验六 分光光度法测定水果、蔬菜及药物中的抗坏血酸
一、实验目的
1. 掌握铁(II)-邻菲罗啉配合物测定抗坏血酸的原理与方法;
2. 理解铁(II)-邻菲罗啉配合物测定抗坏血酸的条件;
3. 掌握利用配位掩蔽法消除光还原作用的方法;
4. 掌握用Excel电子表格法绘制吸收曲线及标准曲线的方法;
5. 了解抗坏血酸测定的意义,
6. 了解样品处理与制备、含量测定的全过程。
二、实验原理

+ 2 Fe3+ = + 2 Fe2+ + 2H+
Fe2+ +3 Phen(邻菲罗啉) = Fe (Phen)32+ (红色,λmax =510nm )
Fe3+(剩余) + 3 Phen(邻菲罗啉)= Fe (Phen)33+
Fe (Phen)33+ + hγ = Fe (Phen)32+
Fe (Phen)33++ 6F- = FeF63- + 3 Phen
三、仪器与试剂
仪器: 电子天平;分光光度计(1厘米比色皿);移液管(5、10 mL);比色管或容量瓶(25或50 mL)
试剂: 100 μg/L Fe3+ 标准溶液(用铁铵矾配制,准确称取铁铵矾O.4318 g,置于100 mL烧杯中,加入盐酸(1:1)10 mL和少量水溶解后转移至500 mL客量瓶中,以水定,摇匀。);0.1%(W/V)邻菲罗啉(Phen)溶液;40μg/mL抗坏血酸(内含1%的HAc,现配现用);0.2 mol/L HAc-NaAc缓冲溶液(pH 4.75);1%(W/V) 氟化钠溶液;1% HAc溶液。
四、实验步骤
1. 吸收曲线的绘制
加入准确吸取的40μg/L抗坏血酸标准溶液5.00 mL置于系列洁净50 mL 容量瓶中,依次加入100 μg/L Fe3+ 标准溶液2.0 mL,摇匀;再加入5.0 mL 0.1%(W/V)邻菲罗啉(Phen)溶液,摇匀;加入5.0 mL HAc-NaAc缓冲溶液,摇匀;再加入2.0 mL 1 %(W/V)氟化钠溶液,用水稀释至50 mL,摇匀。同时制作相应的试剂空白。以相应试剂空白作参比,测定不同波长条件下的吸光度A,绘制吸收曲线,选择最大测定波长λmax。
2. 标准曲线的绘制
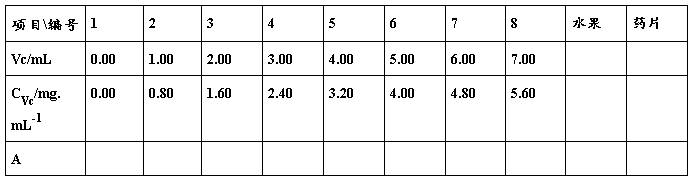
加入准确吸取的40μg/L抗坏血酸标准溶液1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00 mL分别置于系列洁净50 mL 容量瓶中,依次加入100 μg/L Fe3+ 标准溶液2.0 mL,摇匀;再加入5.0 mL 0.1%(W/V)邻菲罗啉(Phen)溶液,摇匀;加入5.0 mL HAc-NaAc缓冲溶液,摇匀;再加入2.0 mL 1 %(W/V) 氟化钠溶液,用水稀释至50 mL,摇匀。以相应试剂空白作参比,在最大测定波长λmax处测定吸光度As, 用Excel电子表格绘制标准曲线,并计算回归方程。
3. 水果或蔬菜汁样品溶液的制备
将水果去皮、去核后(或将蔬菜去根,洗干净,沥干后),准确称重(新上市水果50 g或存放一段时间的水果100 g),在组织捣碎机中捣碎,转移至烧杯中,用50 mL 1 % HAc 溶液浸泡、混匀,先用脱脂棉粗滤,滤液在用滤纸精滤,将精滤液转移至250 mL容量瓶中用1% HAc溶液定容,摇匀。
4. 药片溶液的制备
取VC片1片,准确称重,求平均片重后研细。取适量(相当于VC l00 mg)精确称重后,置1000 mL容量瓶中,加水到刻度,摇匀,并过滤。弃去初滤液,准确吸取续滤液2 mL置50 mL容量瓶中,以下按“标准曲线的绘制”项下操作。
5. 测定
准确吸取样品溶液V mL (苹果3.00 mL或 桔子2.00 mL 或果昧VC冲剂溶液3.00 mL或药片溶液2.00 mL),以下按“标准曲线的绘制”项下操作,测定波长λmax处的吸光度Ax。平行测定三次,计算平均值。根据标准曲线的回归方程及样品量计算样品中的抗坏血酸含量,其单位为 mg/L 或mg/g 。
五、原始数据和数据处理
1. 吸收曲线的绘制

2. 工作曲线
六、思考题
1. 加入氟化钠溶液的作用是什么?能否用其它试剂替代?
答:掩蔽三价铁离子,使其不干扰测定。可用氟化铵替代。
2. 本法测定抗坏血酸时,合适的pH范围在哪里?
答:弱酸性pH = 4-5,用醋酸-醋酸钠缓冲溶液调节。
-
直接凝集反应实验报告
免疫学直接凝集反应实验报告实验一玻片凝集实验1实验原理颗粒性抗原细菌红细胞等与相应的抗体结合在适量电解质通常是085NaCl存在的…
-
细胞凝集试验报告
细胞凝集反应实验报告摘要细胞凝集素可以将不同的细胞粘连在一起在显微镜下可以观察到最终形成大的细胞团块可以观察到细胞的凝集现象通过不…
-
布病试管凝集试验
布病试管凝集试验一实验前准备1试管的准备把试管浸泡于带有洗涤剂的温水中30分钟浸泡后用试管刷将其刷干净先用自来水冲洗10遍再用去离…
-
免疫学实验-凝集试验
实验一凝集试验颗粒性抗原细菌螺旋体红细胞等与相应抗体结合后在有适量电解质存在下抗原颗粒可相互凝集成肉眼可见的凝集块称为凝集反应Ag…
-
布鲁氏菌病虎红平板凝集试验和试管凝集试验的比较
布鲁氏菌病虎红平板凝集试验和试管凝集试验的比较摘要目的对比虎红平板凝集试验和试管凝集试验对布鲁氏菌病检验的敏感性和特异度方法总结我…
-
初中物理实验报告单_人教版
初三物理实验报告单实验一、测固体的密度一、实验目的:掌握测密度的一般方法二、实验器材:托盘天平、滴管、细线、固体、烧杯、量筒、水三…
-
初中物理实验报告单_人教版[1]
安徽省宣城市奋飞中学初三物理实验报告单实验一测固体的密度一实验目的掌握测密度的一般方法二实验器材托盘天平滴管细线固体烧杯量筒水三探…
-
小学科学三年级下册演示实验报告单
小学科学三年级下册演示实验报告单实验内容观察研究土壤年级三年级下册第一单元课题2了解土壤实验器材湿土块含较多腐殖质的土壤餐巾纸烧杯…
-
(人教版)初中化学实验报告
化学实验报告级班号姓名实验日期年月日实验名称用实验证明我们吸入的空气和呼出的气体中的氧气含量有什么不同实验目的氧气可以使带火星的木…
-
(人教版)初中化学实验报告
化学实验竞赛级班号姓名实验日期年月日实验名称用实验证明我们吸入的空气和呼出的气体中的氧气含量有什么不同实验目的氧气可以使带火星的木…
-
纳税实训报告
会计是一个很严谨又很讲究实际操作的的职业,为了积累实际操作经验,这个学期,便有了一门新的课程,纳税实训。纳税实训主要是通过先前给出…