综合化学实验实验一_华南师范大学实验报告
华南师范大学实验报告
姓名: 组员: 课件密码:30620
学号: 实验题目:二茂铁的绿色合成
组别: 第四组 实验时间:2014.03.20
【前言】
1、实验目的
① 了解一些易对环境造成污染的化合物的绿色合成方法,力求把对环境的影响降到最低限度,培养学生在从事科研与生产活动中绿色、环保理念。
② 掌握用微型合成装置合成、提纯二茂铁的操作技术。
③ 学会通过熔点的测定、红外光谱等手段来分析鉴定二茂铁。
2、文献综述与总结
二茂铁(FcH)又名双环戊二烯基铁,学名二环戊二烯基铁,属于金属
有机化合物,它是由两个环戊二烯基阴离子和一个二价铁阳离子组成的具
有夹心形状的化合物(见图),其分子式为(C5H5)2Fe。二茂铁易溶于
甲醇、乙醇、乙醚、石油醚、汽油、二氯甲烷、苯等常用有机溶剂,溶于
浓硫酸,在沸腾的烧碱和盐酸溶液中不溶解、不分解;二茂铁具有高度热
稳定性、化学稳定性和耐辐射性;二茂铁具有芳香性,100℃以上能升华, 不容易发生加成反应,易发生取代反应;此外二茂铁还有低毒性,在溶液中两个环可以自由旋转等特点。正是基于二茂铁的这种稳定性、芳香性、
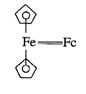 低毒、亲油性、富电性、氧化还原性和易取代等特点,使
低毒、亲油性、富电性、氧化还原性和易取代等特点,使
得自二茂铁出现以来就引起了广大科研工作者极大的兴
趣,对于二茂铁及其衍生物的合成、结构及性质和应用的
研究一直以来都是大家所关注的热点。二茂铁的出现极大
的推动了金属有机化学的发展,被认为是近代化学发展的
里程碑。
2.1二茂铁的发现
1951 年Kealy 及Pauson 利用格氏试剂C5H5MgBr和催化剂FeCl3合成富瓦烯没有成功,但是却意外地得到了一种黄色的晶体,经过一些简单的研究他们得出该物质的分子式为C10H10Fe,并且初步得出该物质的一些物性,如他们测出该物质的熔点172.5~173℃,沸点249℃,不溶于水、10%NaOH 和热的浓盐酸,但易溶于稀硝酸,浓硫酸及二氯甲烷、苯、乙醚、石油谜、甲醇和乙醇等一些常用有机溶剂,比较稳定。几乎同时Miller 等人用环戊二烯和铁在300℃及常压下也制得了该物质。
Fischer 等人通过X射线衍射的研究,提出该物质具有五角反棱柱的结构。通过这些研究确定了该物质是由上下两个带负电的环戊二烯基芳环,中间是一个带二价正电荷的铁离子,形如三明治,因此又将它称为“三明治化合物”,并正式命名为二茂铁。
2.2二茂铁的制备
2.2.1 化学合成法
化学合成法主要有环戊二烯钠法、二乙胺法、相转移催化法、二甲基亚砜法等。
2.2.1.1环戊二烯钠法,反应式为: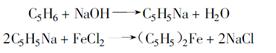
2.2.1.2二乙胺一步法,环戊二烯在二乙胺中与无水三氯化铁直接反,应,环戊二烯使三氯化铁还原为氯化亚铁,再与两个脱去一个氢离子的环戊二烯负离子生成二茂铁。据介绍,在1mOI 三氯化铁和13mOI 二乙胺中加入4mOI环戊二烯,搅拌反应21,再用稀硫酸处理,即得二茂铁,其收率为91%。
2.2.1.3二乙胺二步法,反应式为: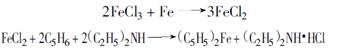
2.2.1.4二甲基亚砜法,在氮气氛、室温、常压下,新蒸馏的环戊二烯与碱反应,生成环戊二烯负离子,再将其与亚铁离子反,应生成二茂铁,用水蒸汽蒸馏即得精制二茂铁。据介绍,将环戊二烯和FeCl2·4H2O 连续添加到有KOH的二甲基亚砜中进行反应,在"5. 333Kpa 的条件下,蒸馏所生成的混合物,可得二茂铁和二甲基亚砜混合物,再用环己烷萃取,即得二茂铁,其收率为90%。
2.2.1.5四水氯化亚铁法在强碱作用下,以四氢呋喃和二甲基亚砜为溶剂,环戊二烯和亚铁离子反应得粗产品,再经水蒸汽蒸馏得产品,产品收率为75% ~ 80%,该法原料易得,反应在有水(氯化亚铁结晶水)存在下也可进行,且溶剂可循环使用。
2.2.1.6相转移催化法在室温下,向环戊二烯的四氢呋喃溶液中加入相转移催化剂18 - 冠- 6 和氢氧化钾,然后再加入氯化亚铁进行反应得到二茂铁。
2.2.2电解合成法
在直流电的作用下,用恒电流法或恒电压法,以铁板和镍板作电极,电解体系中的阳离子Na+ 在阴极上被还原,与环戊二烯反应生成环戊二烯钠和氢分子;由阳极反应产生的Fe2 + 向阴极转移,与阴极的环戊二烯基钠作用生成二茂铁,并置换出Na+ 。电极反应式如下:

Na+ 反复进行这系列反应,在阴极上不断生成二茂铁。将暗红色的电解液用石油醚提取,再将抽提液浓缩,冷却至0℃,即可析出橙红色的二茂铁。总反应方程式为:
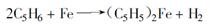
【实验部分】
1、实验仪器与药品
1.1实验仪器
氮气袋、磁力搅拌子、磁力加热搅拌器、真空干燥箱、微型实验装置一套、显微熔点测定仪
1.2实验药品
N2钢瓶、乙二醇二甲醚(C.P)、二甲基亚砜(DMSO,C.P)、氢氧化钾(A.R)、环戊二烯二聚体(工业级)、FeCl2﹒4H2O(A.R),HCl(A.R)
2、实验原理
制取二茂铁的方法很多, 但最一般的方法是用碱金属环戊二烯基衍生物同氯化铁反应。本实验就是采用该方法: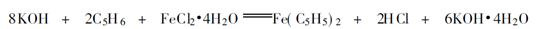 该方法的优点是环戊二烯脱质子的方法简单化了, 氢氧化钾在本法中不仅做脱质子剂, 而且也是一种脱水剂, 也可用乙二胺代替氢氧化钾制取二茂铁:
该方法的优点是环戊二烯脱质子的方法简单化了, 氢氧化钾在本法中不仅做脱质子剂, 而且也是一种脱水剂, 也可用乙二胺代替氢氧化钾制取二茂铁: 
3、实验步骤
(1) 二茂铁的制备
安装好实验装置,在一只25ml三颈烧瓶里放入磁子,一侧与氮气袋相连,另一侧与装有硅油的锥形瓶相连。先在烧瓶中加入10ml乙二醇二甲醚和4.5g研磨细的KOH粉末,在通入氮气并缓慢搅拌的情况下缓慢加入1.3ml环戊二烯。继续通入氮气,并控制氮气的通入量(在硅油中氮气泡一个接一个匀速放出),以赶走烧瓶中的空气。同时将1.5g四水合氯化亚铁溶在8ml二甲基亚砜(DMSO),并转入分液漏斗中。
将混合物猛烈搅拌10min后,打开分液漏斗,控制适当的滴加速度使氯化亚铁的DMSO溶液在45min左右加完。滴加完毕后,关闭分液漏斗,在氮气保护下继续搅拌反应30min。
(2)二茂铁的分离与提纯
将混合液倒入100ml烧杯内,缓慢加入15mL体积比为1:1HCl,再加入 20ml水,继续搅拌悬浮液15min,然后用玻璃砂漏斗抽滤产物,并用少 量水洗涤产物3~4次,收集产物,放在坩埚中并置于真空干燥箱内烘干,称重并计算产率。
(3)产物熔点的测定
用熔点仪测定产物二茂铁的熔点。
4、实验现象与结果
?无产物。
【结果与讨论】
根据文献可知,其分子式为(C5H5)2Fe,分子量为186,外观为橙黄色针状或粉末状结晶,具有类似樟脑的气味,熔点173~174℃。而本次实验中,没有制得产品。出现这个现象的原因可能与反应的条件有关系,因为该反应需在无水无氧的条件下进行,但是在实验室条件下无水条件非常难保证,因为反应中有反应物KOH,易吸水潮解,在空气中很快与水反应,加上实验期间恰逢阴雨天,天气潮湿,所以比较难控制。
此外,反应需无氧条件,而在实验过程中放氮气的速度过慢,有空气不能及时排除,会对产物有所影响。另外,在加入四水合氯化亚铁溶于二甲基亚砜这个东西时,由于一开始溶解得很慢,因为加入的的固体本身比较大块,用了一定的时间去溶解它,在这个过程中,有不少的氧气已经把氯化亚铁氧化了,使得该颜色本来为绿色变为了橙色,并且在加入分液漏斗后出现了分层,这些细节方面都对该实验产生了一定的影响。
另外,文献当中也提到了,二茂铁在100℃时容易发生升华,必须在石蜡密封的管子里面测定,而这个实验条件是当时没有给的,因此在测定熔点的时候,发现薄的地方熔得较快,而稍微厚点的地方则一直保持着未能在一定温度范围内熔完,所以实验中熔点测定有所误差。
【参考文献】
[1] 任红艳,李广洲.二茂铁化学的半个世纪历程.大学化学.2003,(18):(6)
[2] 肖陆飞.二茂铁的发现、制备及其应用.滁州职业技术学院学报.2009,(8):(1)
[3] 张术兵, 韩相恩.二茂铁及其衍生物的合成与应用进展.甘肃石油和化工.2006:(3)
[4] 崔小明. 二茂铁的合成及应用. 化学工业与工程技术.2000,(21):(6)
第二篇:华南师范大学本科生实验报告
华南师范大学本科生实验报告
姓名____ 学号
院系_____ 专业____
年级 班级____
小组实验任务分工_______
实验时间 __年__月__日
实验名称___________
指导老师及职称________
华南师范大学教务处编印
华南师范大学本科生实验报告



-
大学化学实验报告模板
物理化学实验报告院系班级学号姓名实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成…
- 大学化学实验报告格式
-
浙江大学化学实验报告模板
实验报告课程名称指导老师成绩实验名称实验类型同组学生姓名一实验目的和要求必填三主要仪器设备必填五实验数据记录和处理七讨论心得一实验…
-
无机化学实验报告格式
无机化学实验报告格式无机化学实验一般都被设置成大学一年级的课程对于新入大学的学生要想完成一份满意的实验报告真是有一定的难度另外由于…
-
西安交通大大学 化学实验报告模板
西安交通大学化学实验报告第页共页课程实验日期年月日专业班号组别交报告日期年月日姓名学号报告退发订正重做同组者教师审批签字实验名称化…
-
大学生物化学实验报告标准格式汇总
生物化学实验报告班级姓名实验一血清蛋白质醋酸纤维薄膜电泳目的原理仪器组成操作与结果结果粘贴实验二酶的特异性目的原理操作与结果将以上…
- 大学化学实验报告格式
-
大 学 化 学 实 验 报 告
大学化学实验报告综合性实验学院班级学号姓名扬州大学化学实验教学中心20xx年9月综合性实验报告班级姓名组别实验名称实验日期实验目的…
-
大学化学实验报告模板
物理化学实验报告院系班级学号姓名实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成绩实验名称姓名日期成…
-
大学化学实验报告
大学化学实验报告专业班级学号姓名基础化学实验中心实验名称实验时间年月日学生姓名同组人姓名第一部分实验预习报告一实验目的二实验原理三…
-
优秀的近代物理实验总结 报告
20xx-20xx学年第一学期——近代物理实验总结哈萨克族时间过得真快啊!我以为自己还有很多时间,只是当一个睁眼闭眼的瞬间,一个学…