物质的分离和提纯知识点总结及练习
物质的分离和提纯
知识点总结
物质的分离是把原混合物中各成份一一分开,并恢复原样品。
物质的提纯(除杂)就是除去物质中混有的杂质,从而得到纯净的某物质。
1、 原则:
①“不增、不减、易分”:
不增即最终不能引入新的杂质; 不减是除杂结果不应使所需物质减少;
易分是加入试剂后,使杂质转化为沉淀、气体和水等与所需物质易于分离。
②先除杂后干燥。
2、 方法:(以下括号里的均为杂质)
① 吸收法:CO(CO2) 可将气体通入 ;化学方程式 。
② 沉淀法:KCl (Mg Cl2 )可加 溶液,再 ;化学方程式 。
③ 溶解法:Cu(CuO)可加入过量 ,再 ;化学方程式 。
④ 转化法:Cu(Zn)可加 溶液再 ;化学方程式 。
⑤ 气化法:KCl (K2CO3 )可加入过量 ,再 ;化学方程式 。
⑥ 加热法:CaO(CaCO3)可 ;化学方程式 。
⑦ 综合法:当含有多种成分的杂质时,分离提纯往往不仅仅使用一种方法,而是几种方法交替使用。
练习题
1 下列除杂方法中,正确的是 ( )
A. 用灼烧法除去二氧化锰中混有的炭粉 B. 用点燃法除去CO2中混有的少量CO
C. 将H2和O2混和气体通过炽热的CuO以除去氧气中的氢气 D. 干燥O2中的水蒸气,将混合气通过盛有NaOH溶液的洗气瓶
2 下列实验方案或操作中,正确的是 ( )
A. 用稀硫酸除去铁粉中的铜粉 B. 用稀盐酸洗涤试管内壁的油污
C. 实验时多取的白磷可以放回原瓶 D.按溶解、过滤、洗涤、蒸发结晶的操作顺序可以分离氯化钾、二氧化锰的混合物
3.能用溶解、过滤、蒸发、结晶分离的一组混合物是 ( )
A.酒精和水 B.氯化钠和碳酸钠 C.碳酸钙和二氧化锰 D.碳酸钙和氯化钠
4.除去混入下列各组物质中的杂质,选择试剂(括号内为试剂)合理的是 ( )
A.氯化钠溶液中混有碳酸钠溶液(稀盐酸) B.氢氧化钠溶液中混有碳酸钠(盐酸)
C.硫酸亚铁溶液中混有硫酸铜(锌粉) D.氧气中混有氮气(浓硫酸)
5.欲除去混入CO中的少量H2O、O2、CO2,所用试剂为:①热的铜网;②浓硫酸;③NaOH溶液。正确的顺序是 A.①②③ B.②③① C.③②① D.①③② ( )
6.为了除去KCl固体中少量MgSO4和CaCl2杂质,须进行下列六项操作,正确的次序是( )
①加水溶解; ②加热蒸发得到晶体; ③加入过量BaCl2溶液;
④加入过量盐酸; ⑤加入过量K2CO3; ⑥过滤。
A.①⑤③⑥④② B.①⑤③④⑥② C.①③④⑥⑤② D.①③⑤⑥④②
7.除去下列物质中的杂质(括号内为杂质)所选的试剂及操作方法均正确的一组是( )

8.用实验方法除去下列①—④各物质中的少量杂质,限从A—D提供的试剂及操作方法中进行选择,并将其序号填在相应的短线上。
A.加适量的稀盐酸、搅拌、蒸发、结晶 B.加适量的稀盐酸、搅拌、过滤、洗涤沉淀
C.加适量水溶解、过滤、洗涤沉淀 D.加适量水溶解、过滤、蒸发
①CaCO3中含有少量杂质Na2CO3 ;②Cu粉中含有少量杂质Fe粉 ;
③CaCl2中含有少量CaCO3 ;④NaCl中含有少量杂质MnO2 。
9.某废液中含有ZnCl2、FeCl2、CuCl2,要全部回收铜,某同学先向其中加入过量的铁粉,充分反应后过滤,滤渣中含有 ,这位同学需要继续完成的实验是
。
10.下列各物质都含有少量杂质(括号内的物质为杂质),写出除去杂质的简要操作步骤和有关化学方程式。
(1)CO2(CO) ;
(2)Na2SO4溶液(CuSO4) ;
(3)NaCl溶液(NaOH) ;
(4)ZnSO4溶液(CuSO4) 。
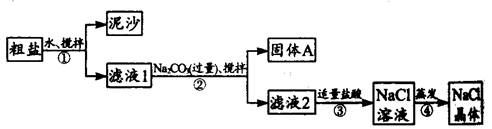 27.一同学用某种粗盐(主要含有泥沙、CaCl2、MgCl2等物质)进行提纯实验,步骤如下图所示。
27.一同学用某种粗盐(主要含有泥沙、CaCl2、MgCl2等物质)进行提纯实验,步骤如下图所示。
请回答下列问题:
(1)步骤①和②的操作名称是 。
(2)步骤②中加入过量Na2CO3的目的是 ,
步骤②中发生反应的化学方程式是 、 。
固体A中含有的固体是 (写物质的化学式)
(3)步骤③中加入适量盐酸的目的是 ,判断加入盐酸“适量”的方法是 。
(4)步骤④蒸发液体时要用玻璃棒不断搅拌液体,目的是 。
第二篇:-物质的分离和提纯知识点小结
物质的分离和提纯知识小结
一、分离或提纯时,若需要加入试剂,试剂的选择应遵循以下五个原则:
(1)所选试剂一般只和杂质反应。 (2)操作不应引入新的杂质。
(3)不减,即不减少欲被提纯的物质。 (4)易分,即欲被提纯的物质与杂质应容易分离。
(5)易得,试剂应尽可能容易获得,且价格低廉。
二、还必须做到以下“三必须”:
(1)所加除杂质的试剂必须“过量”,只有过量才能除尽欲除杂质。
(2)由过量试剂引入的新的杂质必须除尽。
(3)分离和除杂质的途径必须选择最佳方案。
三、物质分离和提纯的方法:
1、固-固混合分离型:加热(包括灼烧、热分解和升华)、结晶(重结晶);
2、固-液混合分离型:过滤、盐析、蒸发;
3、液-液混合分离型:萃取、分液、蒸馏、渗析;
4、气-气混合分离型:洗气,包括(1)采用液体净化剂时——用洗气瓶;
(2)采用固体净化剂时——用干燥管或反应管。
物质的分离和提纯常用方法如下表:
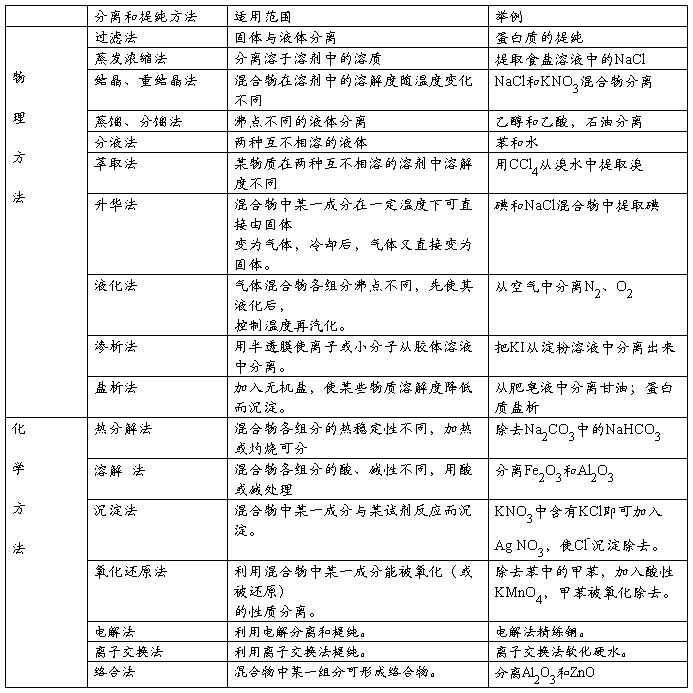
常见的物质除杂

www.ks5u.com
-
物质的分离与提纯知识总结
高考化学实验专题复习二常见物质的分离提纯和鉴别1常用的物理方法根据物质的物理性质上差异来分离混合物的物理分离方法i蒸发和结晶蒸发是…
-
常见物质的分离、提纯和鉴别方法总结
金太阳新课标资源网常见物质的分离提纯和鉴别方法总结一物质的分离与提纯方法1混合物的物理分离方法2混合物的化学分离法第1页共13页金…
-
物质的分离和提纯知识点总结及练习
物质的分离和提纯知识点总结和平中学20xx411姓名物质的分离是把原混合物中各成份一一分开并恢复原样品物质的提纯除杂就是除去物质中…
-
物质的分离和提纯知识点总结及练习
物质的分离和提纯知识点总结物质的分离是把原混合物中各成份一一分开并恢复原样品物质的提纯除杂就是除去物质中混有的杂质从而得到纯净的某…
-
物质分离与提纯的常用方法小结
20xx年中考考点点拨之物质分离与提纯的常用方法小结物质的分离是将几种物质通过物理或化学方法分开提纯则要求把不纯物质中的杂质除去提…
-
初三化学物质的分离和提纯知识点总结
初三化学物质的分离和提纯知识点总结化学常用的物质的分离方法是:1.溶解过滤法:一种物质易溶于水,另一种物质难溶于水,可以将这两种物…
-
物质的分离与提纯知识总结
高考化学实验专题复习二常见物质的分离提纯和鉴别1常用的物理方法根据物质的物理性质上差异来分离混合物的物理分离方法i蒸发和结晶蒸发是…
-
常见物质的分离、提纯和鉴别方法总结
金太阳新课标资源网常见物质的分离提纯和鉴别方法总结一物质的分离与提纯方法1混合物的物理分离方法2混合物的化学分离法第1页共13页金…
-
-物质的分离和提纯知识点小结
物质的分离和提纯知识小结一分离或提纯时若需要加入试剂试剂的选择应遵循以下五个原则1所选试剂一般只和杂质反应2操作不应引入新的杂质3…
-
物质的分离和提纯知识点总结及练习
物质的分离和提纯知识点总结和平中学20xx411姓名物质的分离是把原混合物中各成份一一分开并恢复原样品物质的提纯除杂就是除去物质中…