物化实验报告 六
物理化学实验报告
姓名:王军利
班级:材料卓越
学号:11031020115
教师:李慎新
学院:材料化学与工程学院
实验六 电导法测定乙酸电离平衡常数
一、 实验目的
1、 掌握电导、电导率、摩尔电导率的概念以及他们之间的联系。
2、 掌握由电导法测定弱电解质电离平衡常熟的原理。
二.实验原理:
1.电离平衡常数Kc的测定原理
在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为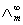 ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率
,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m与无限稀释的溶液的摩尔电导率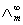 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系:
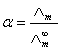 (1)
(1)
式中为弱电解质的电离度。
对AB型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数Kc与浓度c和电离度α的关系推导如下:
CH3COOH →CH3COO- + H+
起始浓度 c 0 0
平衡浓度 c(1-α) ca ca
则
 (2)
(2)
以式(1)代入上式得: (3)
(3)
因此,只要知道∧m∞和∧m就可以算得该浓度下醋酸的电离常数Kc。
将式(2)整理后还可得:
 (4)
(4)
由上式可知,测定系列浓度下溶液的摩尔电导率∧m,将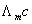 对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内
对1/Λm作图可得一条直线,由直线斜率可测出在一定浓度范围内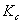 的平均值。
的平均值。
2.摩尔电导率∧m的测定原理
电导是电阻的倒数,用G表示,单位S(西门子)。电导率则为电阻率的倒数,用k表示,单位为G·m-1。
摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m的两个电极之间,这时所具有的电导称为摩尔电导率。摩尔电导率与电导率之间有如下的关系。
∧m= κ/c (5)
式中c为溶液中物质的量浓度,单位为mol·m-3。
在电导池中,电导的大小与两极之间的距离l成反比,与电极的面积A成正比。
G = κA/ l (6)
由(6)式可得
κ=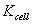 G (7)
G (7)
对于固定的电导池,l和A 是定值,故比值l/A为一常数,以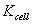 表示,称为电导池常数,单位为m-1。为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数
表示,称为电导池常数,单位为m-1。为了防止极化,通常将铂电极镀上一层铂黑,因此真实面积A无法直接测量,通常将已知电导率κ的电解质溶液(一般用的是标准的0.01000mol·L-1KCl溶液)注入电导池中,然后测定其电导G即可由(7)式算得电导池常数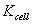 。
。
当电导池常数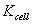 确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率。
确定后,就可用该电导池测定某一浓度c的醋酸溶液的电导,再用(7)式算出κ,将c、κ值代入(5)式,可算得该浓度下醋酸溶液的摩尔电导率。
在这里的求测是一个重要问题,对于强电解质溶液可测定其在不同浓度下摩尔电导率再外推而求得,但对弱电解质溶液则不能用外推法,通常是将该弱电解质正、负两种离子的无限稀释摩尔电导率加和计算而得,即:
 (8)
(8)
不同温度下醋酸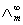 的值见表1。
的值见表1。
表2.5 不同温度下醋酸的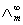 (S·m2·mol-1)
(S·m2·mol-1)

二、 实验器材
DDBJ-350便携式电导率仪,电导电极,恒温槽,烧杯、锥型瓶,移液管(25mL);
0.0200 mol·L-1  标准溶液,0.1779 mol·L-1
标准溶液,0.1779 mol·L-1 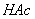 标准溶液
标准溶液
四、实验步骤
1、 调节恒温水槽水浴温度为25°C,将实验中要测定的溶液和一定量的蒸馏水恒温。
2、 校准便携式电导率仪的电导常数:量取一定量0.2mol/L的 溶液于小烧杯中,并放置于恒温水槽中恒温至25°C。用滤纸将两电极擦拭干净并测出
溶液于小烧杯中,并放置于恒温水槽中恒温至25°C。用滤纸将两电极擦拭干净并测出 溶液的电导率;并与0.276s/m相比,若差很多,重新调节。
溶液的电导率;并与0.276s/m相比,若差很多,重新调节。
3、 测量醋酸溶液的电导率:
(1)、取50ml0.1779mol/L的醋酸溶液于小锥形瓶中并置于恒温水槽中至温度升到25°C,两电极洗净擦干,用电导率仪测出其电导率,每隔一两分钟测一次,测三次。
(2)、用移液管吸取锥形瓶中醋酸25ml,再加入25ml水稀释醋酸,并测其电导率。重复该操作,依次稀释四次。
(3)记录实验数据。
(4)将电导电极、温度传感器洗净,依然将电导电极泡在蒸馏水中。收拾好实验桌。
五、数据处理
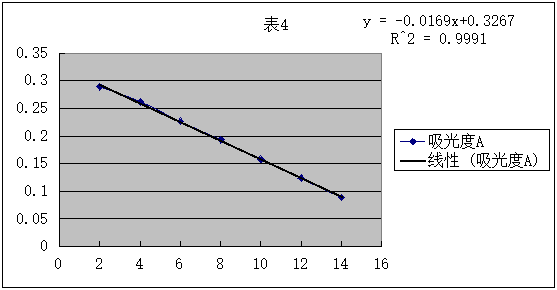
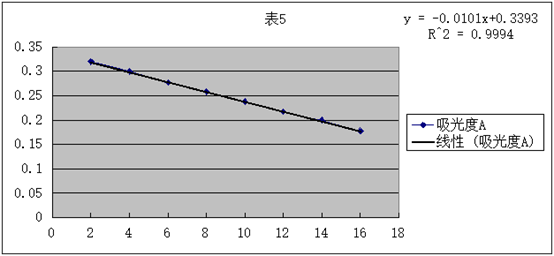
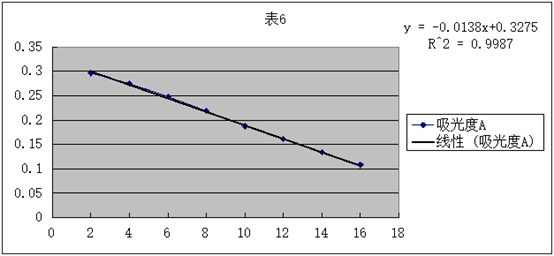
1.将原始数据及处理结果填入下表:
2.根据测得的各种浓度的醋酸溶液的电导率,求出各相应的摩尔电导率∧m和电离度a及电离平衡常数Kc。
实验温度: 25℃

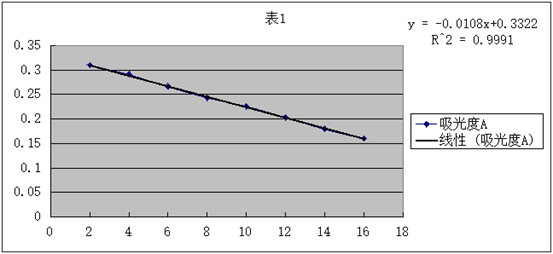
3.用 对1/∧m作图或进行线性回归,求出相应的斜率和截距,求出平均电离常数Kc。
对1/∧m作图或进行线性回归,求出相应的斜率和截距,求出平均电离常数Kc。
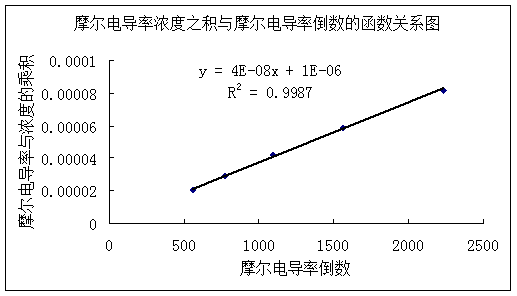
直线斜率为2.9× ,又因为斜率表示为
,又因为斜率表示为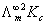 所以可得:
所以可得: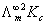 =2.9×
=2.9× ,得
,得 =1.87×
=1.87×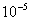
六、思考题:
1.电导池常数是否可用测量几何尺寸的方法确定?
答:不能。测定电导池常数可以用标准溶液测定法,用氯化钾为标准物质;还可以用与标准电极比较法测定。
2.实际过程中,若电导池常数发生改变,对平衡常数测定有何影响?
答:溶液电导一经测定,则?正比于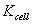 。即电导池常数测值偏大,则算得的溶液的溶解度、电离常数都偏大,反之,电导池常数测值偏小,则电离常数偏小。
。即电导池常数测值偏大,则算得的溶液的溶解度、电离常数都偏大,反之,电导池常数测值偏小,则电离常数偏小。
七、误差分析
1、所取溶液浓度的准确性。
2、读数过程中,温度是否达到25℃;读数间隔时间是否够。
3、稀释过程的准确性。
4、电导仪校准时也可能未达要求。
第二篇:物化实验报告之一
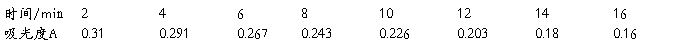


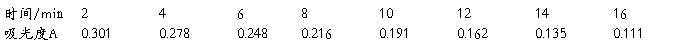



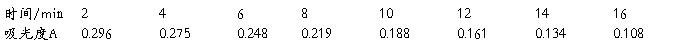
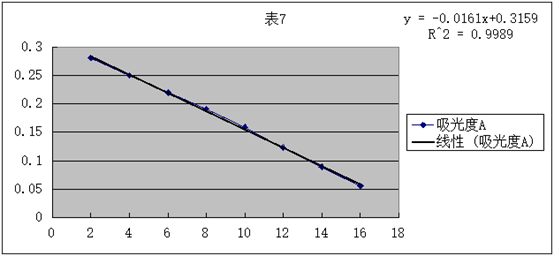




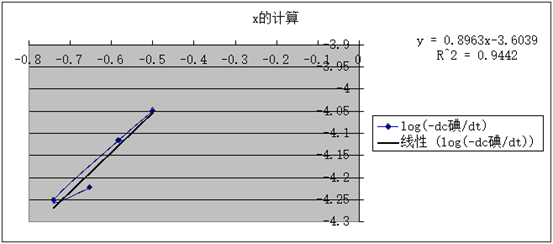

查表可得:25℃k标=1.72L·mol-¹·min-¹
所以:相对误差为d=(1.72-1.2)/1.72×100%=30%
-
物化实验实验报告
粘度法测定高聚物相对分子质量一实验目的1掌握用乌氏粘度计测定高聚物溶液粘度的原理和方法2测定线型聚合物聚乙二醇的粘均相对分子质量二…
-
物化实验报告6-最大气泡压力法测定溶液的表面张力
一实验目的1掌握最大气泡压力法测定表面张力的原理和技术2通过对不同浓度乙醇溶液表面张力的测定加深对表面张力表面自由能表面张力和吸附…
-
物化实验总结
物化实验总结10环科林泽震120xx1202126大二的生活已经临近尾声了,伴随着我们走完一学期的物化实验也结束了。通过这一学期来…
-
物化实验报告5-电导的测定及其应用
一实验目的1测量KCl水溶液的电导率求它的无限稀释摩尔电导率2用电导法测量醋酸在水溶液中的解离平衡常数3掌握恒温水槽及电导率仪的使…
-
物化实验报告
双液系的气液平衡相图一实验目的1绘制在P下环己烷乙醇双液系的气液平衡相图了解相图和相律的基本概念2掌握测定双组分液体的沸点及正常沸…
-
物理化学实验结课总结
物理化学实验总结报告物理化学实验结课了,在本学期中,我们总共做了8个实验,应当说收获颇丰。首先由于实验室条件所限,所以我们采用了两…
-
物理化学实验总结
闽江学院化学与化学工程系10级应化(2)班柳泽玲120xx1202240通过这个学期的大学物化实验,我体会颇深。首先,我通过做实验…
-
高中物理实验方法总结
1.平衡法物理学中常常利用一个量的作用与另一个(或几个)量的作用相同、相当或相反来设计实验,制作仪器,进行测量。例如基本测量工具弹…
-
物化实验总结
物化实验总结10环科林泽震120xx1202126大二的生活已经临近尾声了,伴随着我们走完一学期的物化实验也结束了。通过这一学期来…
-
物理化学实验心得
物理化学实验心得09级化学师范朱健这次的实验都是以我们学生自己为核心,强调的是学生的主动性,我们的每一个实验都是认认真真的完成,一…
-
物化实验心得
物理化学实验心得应化11123211111李彪时光荏苒白驹过隙转眼间大二的上学期即将要过去然而在短短的几个月里面依旧有值得我们回味…