盐类水解应用总结(学生)
盐类水解应用总结
盐类水解是中学化学教学中的重点和难点,也是历年来高考考查的热点之一。但是同学们在实际应用中却往往不知何时考虑有关盐类的水解。现将常见的盐类水解的应用作如下归纳。
1、 判断盐溶液的酸碱性时应考虑盐类水解:
强酸弱碱盐溶液水解显酸性,强碱弱酸盐水解显碱性。弱酸弱碱盐溶液的酸碱性要分析二者的水解程度,溶液可能显酸性碱性或者是中性。
例如:下列盐溶液因水解而显酸性的是( )。
A.Na2S B.NaHCO3 C.Na2HPO4 D.NH4Cl
2、 判断离子共存问题时应考虑盐类水解:
弱碱阳离子(如Al3+、Cu2+、Fe3+、NH4+等)与弱酸阴离子(如HCO3-、CO32-、 〔Al(OH)4〕— 、F-等)在溶液中不能同时大量共存。因为两种离子都水解,分别和水电离出的H+、OH—结合互相促进水解,使两种离子数目减少。
例如:Al3+不能与〔Al(OH)4〕—,HCO3-,CO32-等大量共存于同一溶液,这是因为Al3+水解显酸性,而〔Al(OH)4〕— , HCO3-,CO32-水解显碱性,相遇会发生双水解反应。
3、 根据盐溶液的PH判断相应酸的相对强弱时应考虑盐类水解:
如物质的量浓度相同的三种钠盐NaX、NaY、NaZ的PH依次为7、8、9,则相应的酸HX、HY、HZ的相对强弱为HX>HY>HZ(酸越弱,其强碱盐就越易水解,故溶液的碱性就越强)。
4、 比较溶液中离子浓度的相对大小时应考虑盐类水解:
(1)弱电解质的电离
弱电解质在水溶液中是少部分发生电离,多元弱酸如H2CO3还要考虑分步电离:
H2CO3
(2) 盐类水解
强酸弱碱盐如NH4Cl、Al2(SO4)3等水解后溶液呈酸性;
强碱弱酸盐如CH3COONa、Na2CO3等水解后溶液呈碱性。
多元弱酸盐还要考虑分步水解,
如CO32-+H2OHCO3-+OH-、 HCO3-+H2OH2CO3+OH-
所以Na2CO3溶液中c(Na+)> c(CO32-) >c(OH-) >c (HCO3-) > c (H2CO3)
(3)电解质溶液中的守恒关系
电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。
如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)
推出:c(Na+)+c(H+)=c (HCO3-) +2c(CO32-) +c(OH-)
物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。
如NaHCO3溶液中n(Na):n(C)=1:1,
推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
质子守恒:(不要求掌握)电解质溶液中分子或离子得到或失去质子(H+)的物质的量应 H++HCO3- ; HCO3- H++CO32- 所以碳酸溶液中c(H+)>c(HCO3-)> c(CO32-) 1
相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:
c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)
即c(H+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)
如Na3PO4晶体中Na+和PO43-的物质的量之比为3:1,在其溶液中PO43-水解,则[Na+]:
[PO43-]>3:1。
例如: 20 mL 1mol/L的HAc与40 mL 0.5mol/L的NaOH混合后,所得溶液中离子浓度由大到小的顺序为( )
在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+) B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≥20mL D.V总≤20mL
5、比较溶液中离子种类多少时应考虑盐类水解:
如Na2S、Na2CO3、Na3PO4的溶液中哪种溶液中含阴离子种类最多?三种酸根均要水解,且Na3PO4的溶液中含有的阴离子种类最多。
例如:下列物质的溶液中所含离子种类最多的是( )。
A.Na2S B.Na3PO4 C.Na2CO3 D.AlCl3
5、 强酸弱碱盐、强碱弱酸盐的配制时应考虑盐类水解:
如实验室配置FeCl3溶液,由于FeCl3溶于水要发生水解反应:
Fe3++3H2OFe(OH)3+3H+,因此为了抑制其水解保持溶液澄清,应将盐先溶解于稀盐酸中,再加水稀释。同样的方法可配置CuSO4溶液等。
例如:实验室在配制Na2S溶液时,为了防止发生水解反应加入少量的NaOH;在配制FeCl3溶液时,应加入少量盐酸。
6、 中和滴定指示剂的选择时应考虑盐类水解:
若用强碱滴定弱酸,反应达到终点后,因生成强碱弱酸盐溶液显碱性,所以选择在碱性范围内变色的指示剂----酚酞。若用强酸滴定弱碱,反应达到终点后,溶液显酸性,故要选择在酸性范围内变色的指示剂----甲基橙。
7、 部分活泼金属和盐溶液的反应时应考虑盐类水解:
某些活泼金属(如 Mg、Al、Zn等)溶于盐溶液中产生氢气。如Mg条在常温下与水无明显反应,但是放入氯化铵溶液中有气体产生。同样NH4Cl用于焊接金属是因为它能够水解产生HCl,盐酸溶解金属氧化物,从而达到除去焊接金属表面的氧化物的目的。
例如:将镁条插入NH4Cl溶液中,会产生H2和NH3,这是因为NH4Cl发生水解: NH4+ + H2O NH3·H2O +H+,使溶液显酸性;镁可置换出氢:Mg +2H+ =Mg2+ +H2,同时促进NH4+水解,生成大量NH3·H2O,于是有部分NH3逸出。
8、 强酸弱碱盐与强碱弱酸盐混合时应考虑盐类水解:
如果有难溶于水的物质生成,则发生完全双水解,例如AlCl3和Na2CO3溶液混合后,发生完全双水解:2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑;如果没有难溶于水的物质生成,则会发生不完全水解,例如NH4Cl和NaAC溶液混合:NH4++Ac—+H2O
应: Al3+ +3HCO3-=Al(OH)3↓+3CO2↑ HAc+NH3·H2O。 例如:泡沫灭火器只所以能灭火,就是因为NaHCO3与Al2(SO4)3相遇发生双水解反
2
10、弱酸弱碱盐的制取时应考虑盐类水解:
由于弱酸弱碱盐强烈的水解,因此对应的溶液的制备不能溶液之间的反应得到,如Al2S3的制取,若在溶液中则会双水解生成Al(OH)3和H2S。
11、加热蒸干溶液后产物的判断时应考虑盐类水解:
加热蒸干Al2(SO4)3[或Fe2(SO4)3、KAl(SO4)2、CuSO4]溶液和碳酸钠[或Na3PO4、Na2SiO3]溶液,在加热时会促进盐类的水解,使得最终会得到原溶质(因为它们水解的产物会重新反应生成原物质)。而加热AlCl3(或Al(NO3)3等)溶液,盐类的水解也会受到促进,但因为水解产物之一为挥发性物质,便得到另一种水解产物,此时要考虑得到的该水解产物的热稳定性。加热蒸干FeSO4溶液时,溶液中的Fe2+被氧化生成Fe3+,而Fe3+水解生成Fe(OH)3,等物质的量的Fe(OH)3不能被硫酸中和,故最后的产物为Fe2(SO4)3和Fe2O3的混合物。
12、强酸弱碱盐、强碱弱酸盐的保存时应考虑盐类水解:
如碳酸钠溶液在储存时不能使用玻璃瓶塞。
例如:Na2CO3溶液不应贮存在玻璃塞试剂瓶中,这是由于Na2CO3水解生成,使玻璃塞胶结。FeCl3溶液放置久了会产生浑浊现象,这是由于FeCl3水解生成了Fe(OH)3的缘故。
13、热纯碱的去污原理时应考虑盐类水解:
加热可以使CO32-水解程度增大,因而使溶液碱性增强,去污能力增强。
14、净水剂的净水原理时应考虑盐类水解:
明矾净水是因为明矾在水中发生如下水解反应:Al3++3H2OAl(OH)3+3H+,生成的Al(OH)3胶体有较强的吸附性,可以吸附杂质。明矾、FeCl3(氯化铁溶液的止血原理也是如此)都是净水剂,这与Al3+、Fe3+水解生成具有强吸附作用的胶体有关。
15、泡末灭火器的灭火原理应考虑盐类水解:
泡末灭火器内装的是饱和硫酸铝溶液和碳酸氢钠溶液,它们分别装在不同容器中。当两种溶液混合时,它们相互促进水解(具体的双水解反应见第9点中的Al3+和CO32-的反应),从而生成大量的CO2,导致灭火器内的压强增大,CO2、H2O、Al(OH)3一起喷出覆盖在着火物质上使火焰熄灭。
16、肥料的使用时应考虑盐类水解:
长期使用(NH4)2SO4的土壤因NH4+的水解而使土壤的酸性增强;另外草木灰(K2CO3)和氨态氮肥(如硝酸铵)混合使用时,由于CO32-和NH4+的水解相互促进,使NH4+ 变为NH3而降低了氮肥的肥效;同样草木灰(K2CO3)和过磷酸钙混用也会降低磷肥的肥效。
例如:同时对农作物施用含N、P、K的三种化肥,对给定下列化肥:
①K2CO3 ②KCl ③Ca(H2PO4)2 ④ (NH4)2SO4 ⑤氨水。其中最合理的组合方式是( )。
A.①③④ B.②③④ C.①③⑤ D.②③⑤
17、物质鉴别:
例如用简单的方法区别NaCl、NH4Cl、Na2CO3三种溶液。可以根据盐类水解后溶液的酸碱性的不同,即通过测定等浓度三种溶液的PH或用紫色石蕊进行检测。
例如:现有Al2(SO4)3、HAc、NaCl、BaCl2四种溶液,可以将它们区别开的一种试剂是( )。
A.H2SO4 B.AgNO3 C.Na2CO3 D.NaHCO3
3
1. 浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值
由小到大排列的顺序是 ( )
A. ①②③④ B.④③①② C.③④①② D.②①④③
2. 用一价离子组成四种盐,AC、BD、AD、BC的1mol·L-1 溶液,在室温下前两种溶液的
pH=7,第三种溶液的pH >7,最后一种溶液的pH< 7,则( )
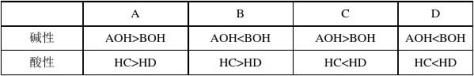
3.下列说法与盐的水解无关的是 ( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,溶液时往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与氨态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性
A. ① ③ ⑥ B. ② ③ ⑤ C. ③ ④ ⑤ D.全有关 4.有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是 ( )
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
5.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是 ( )
2?A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO3和OH-
B.NaHCO3溶液中:c (H+)+c (H2CO3)=c (OH-)
C.10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓
度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
6.在25 ℃时,将pH = 11的NaOH溶液与pH = 3的CH3COOH溶液等体积混合后,下列关系式中正确的是 ( )
A.c(Na) = c(CH3COO)+c(CH3COOH) B.c(H) = c(CH3COO)+c(OH)
C.c(Na)>c(CH3COO)>c(OH)>c(H)
D.c(CH3COO)>c(Na)>c(H)>c(OH) -++-+--++--+-
4
第二篇:盐类水解专题总结
盐类水解专题总结

- 1 -

- 2 -

- 3 -
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点(学生版)
盐类的水解知识大复习一探究盐溶液的酸碱性结论强酸弱碱盐显酸性强碱弱酸盐显碱性强酸强碱盐显中性二盐溶液呈现不同酸碱性的原因三盐的水解…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点总结
盐类的水解知识点总结1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一盐的水解实质H2OHOHnnn当盐AB…
-
化学选修4第四章第三节《盐类的水解》知识总结
化学选修四第四章第3节《盐类的水解》知识总结一、探究盐溶液的酸碱性强碱弱酸盐的水溶液,呈碱性;强酸弱碱盐的水溶液,呈酸性;强酸强碱…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类水解知识点总结
盐类水解基础知识点在溶液中盐的离子跟水所电离出来的H或OH生成弱电解质的过程叫做盐类的水解盐类的水解所条件盐必须溶于水盐必须能电离…
-
盐类的水解知识点总结
1盐类的水解1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐AB能电…
-
盐类的水解知识点总结
盐类的水解知识点总结1复习重点1盐类的水解原理及其应用2溶液中微粒间的相互关系及守恒原理2难点聚焦一H2OH盐的水解实质nnn当盐…