第三单元 盐类的水解教案
专题3 溶液中的离子反应
第三单元 盐类的水解(第一课时)
【教案背景】盐类水解属于化学基础理论知识,涉及的知识面比较广,综合性比较强,是前面已学过的电解质的电离、水的电离平衡、水的离子积以及平衡移动原理等知识的综合应用。学生理解起来比较困难,所以配有实验,再结合网络资源,容易引起学生的兴趣。在校级的公开课上,本人讲了《盐类的水解》这节课,汇总了这份教案。
【教学课题】苏教版 选修4《化学反应原理》专题3第三单元盐类的水解(第一课时)
【教材分析】由于盐类的水解是一种特殊的化学平衡,有关化学平衡的建立和移动的原理同样适用于盐类的水解。先引导学生运用化学平衡与电离平衡的理论推测各种因素对盐类水解的影响,然后再通过实验加以证明,进而总结出如何改变温度、浓度等外界条件,使水解向人们需要的方向移动。本节课可采取边看、边想、边讨论、边巩固运用的学习方法。通过观察、分析、比较、演绎、推理等手段,促使学生掌握盐类水解的概念、规律以及盐类水解方程式的正确书写。
【教学目标】
1、知识与技能
认识盐类水解的原理、盐类水解的规律。
2、过程与方法
⑴通过实验并运用归纳法分析盐类的组成与盐溶液酸碱性的对应关系。
⑵以水的电离平衡为基础,认真分析盐类电离出的阴、阳离子与水电离出的或结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因。
3、情感、态度与价值观
通过探究不同盐溶液呈现不同酸碱性的本质原因,学会透过现象看本质。
【教学重点】盐类水解的本质,理解强酸弱碱盐和强碱弱酸盐的水解的规律。
【教学难点】盐类水解方程式的书写和分析。
【教学方法】启发式实验引导法
【教学过程】
【问题导入】生活中常用的盐除NaCl外,还有谷氨酸钠(味精)和Na2CO3 、NaHCO3等。 NaCl和谷氨酸钠主要用于食品调味,而Na2CO3 、NaHCO3被视作“碱”用于油污清洗和面食制作,特别是Na2CO3 ,俗称纯碱。明明是盐,为什么叫“碱”呢?
实验是我们探求未知问题的好方法,下面我们做一个实验来看看,将盐溶于水后,溶液的酸碱性到底如何呢?
【科学探究】分组实验:对盐溶液进行酸碱性测定,并填写下表:
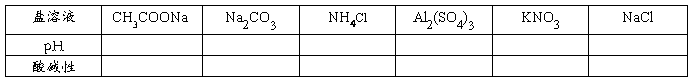
【学生观察现象、讨论、归纳】
【屏幕展示】实验结果:CH3COONa 、Na2CO3的水溶液:显碱性
NH4Cl 、Al2(SO4)3的水溶液:显酸性
NaCl 、KNO3溶液:显中性
【结论】盐溶液不一定都是中性,有的呈酸性,有的呈碱性
【讨论】由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系?
【讲述】下面我们分别来研究不同类盐的水溶液酸碱性不同的原因。
思考:溶液呈酸、碱性取决于溶液中с(H+)和с(OH-)的相对大小。我们知道在任何物质的水溶液中有水电离出的H+和OH-的量总是相等的,而盐本身又不能电离出H+ 或OH-,那么是谁打破了这一等量关系呢?为什么也会显示出酸碱性?
【思考与交流】
交流问题如下:
(1)盐溶液中存在哪些粒子?
(2)哪些离子间可以相互结合?
(3)对水的电离平衡有何影响?
(4)溶液中的H+ 和OH- 的浓度如何变化?
【学生活动】第一小组以NH4Cl溶液为例,讨论:为什么强酸弱碱盐显酸性?选择一名中心发言人宣读讨论结果。其他组员补充。
第二小组以CH3COONa为例,讨论:为什么强碱弱酸盐显碱性?选择一名中心发言人宣读讨论结果。其他组员补充。
第三小组以NaCl为例,讨论:为什么强碱强酸盐显中性?选择一名中心发言人宣读讨论结果。其他组员补充。
【板书】一、盐类的水解
【讲述】CH3COONa溶于水之后,完全电离。(因为CH3COONa是强电解质。)CH3COONa ═ CH3COO- + Na+ ………⑴
把CH3COONa溶于水之后,溶液中存在哪些电离平衡?
【板书】H2O H+ + OH-………⑵
H+ + OH-………⑵
我们知道,CH3COOH是一种弱酸,促进了水的电离。使得溶液中的OH-的浓度大于H+的浓度。
【板书】CH3COO- + H+ CH3COOH………⑶
CH3COOH………⑶
讲解:把⑴⑵⑶式联立,可得到:
水解方程式:
【板书】CH3COONa + H2O  CH3COOH + NaOH
CH3COOH + NaOH
这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。
【学生活动】把上述化学方程式改写成离子方程式。
【板书】CH3COO- + H2O  CH3COOH + OH-
CH3COOH + OH-
【讨论】试从CH3COONa的水溶液显碱性的原因分析:为什么NH4Cl的水溶液显酸性?
【屏幕展示】 氯化铵在溶液中的变化:
NH4+ + H2O 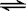 NH3.H2O + H+
NH3.H2O + H+
NH4Cl + H2O 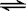 NH3.H2O + HCl
NH3.H2O + HCl
【板书】1、盐类水解的定义:在溶液中盐电离出来的离子跟水所电离出来的H+ 或 OH-结合生成弱电解质的反应,叫做盐类的水解。
【板书】2、盐类水解的本质:弱酸的阴离子和弱碱的阳离子和水电离出的H+或OH-离子结合生成弱电解质,破坏了水的电离平衡,促进了水的电离。
【说明】1、只有弱酸的阴离子或弱碱的阳离子才能与H+ 或 OH-结合生成弱电解质。
2、盐类水解使水的电离平衡发生了移动,并使溶液呈酸性或碱性。
3、盐类水解反应是酸碱中和反应的逆反应。
【讲解】CH3COONa可以看作是弱酸CH3COOH和强碱NaOH生成的盐,这种盐叫做强碱弱酸盐。
【板书】二、盐类水解的类型
1、 强碱弱酸盐水解
【讲解】由强碱和弱酸反应生成的盐,称为强碱弱酸盐,含有以上弱酸根的盐,常会发生水解。
【讨论】分析Na2CO3的水解过程,写出有关反应的离子方程式。
【板书】 Na2CO3的水解
第一步: CO32-+H2O HCO3-+OH- (主要)
HCO3-+OH- (主要)
第二步: HCO3- +H2O  H2CO3 +OH- (次要)
H2CO3 +OH- (次要)
【分析】对于多元弱酸来说,水解要分步写。
【板书】2、强酸弱碱盐
【练习】写出Al2(SO4)3水解的离子方程式。
Al3+ + 3H2O Al(OH)3 + 3H+
Al(OH)3 + 3H+
【讨论】以NaCl为例,说明强酸强碱盐能否水解。
【小结】由于NaCl电离出的Na+和Cl-都不能与水电离出来的H+ 或 OH-结合生成弱电解质,所以强碱强酸盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。
【板书】3、强酸强碱盐、难溶于水的盐不水解
【练习】盐类水解离子方程式的书写
FeCl3 CuSO4 NaClO K2CO3
【小结】盐类水解离子方程式书写注意事项
(1)盐类水解是可逆反应,反应方程式和离子方程式要写“ ”号
”号
(2)一般盐类水解的程度很小,水解产物也很少,通常不生成气体或沉淀,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式。
⑶ 多元弱酸的酸根离子水解是分步进行的,水解时以第一步为主。
【小结】盐的组成与盐溶液酸碱性的关系:
强碱弱酸盐的水溶液显碱性;
强酸弱碱盐的水溶液显酸性;
强酸强碱盐的水溶液显中性。
【结论】
有弱才水解,无弱不水解--条件
越弱越水解,都弱都水解--程度
谁强显谁性.同强显中性--结果
【课堂小结】
【作业布置】
【板书设计】
第三节 盐类的水解(第一课时)
一、 盐类水解
1、定义:在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2、实质: 破坏水的电离平衡.
3、水解反应与中和反应的关系::酸 + 碱 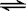 盐 + 水
盐 + 水
4、条件:①盐中必须有弱根 ②盐必须溶于水
5、规律:有弱才水解;无弱不水解;
谁弱谁水解;谁强显谁性。
【教学反思】
从宏观现象过渡到微观本质的分析,有一定难度。因为,创设一个激发学生学习兴趣的情境,设计一组学生实验,在教师的启发下,引导学生从观察到的现象去探究隐藏在这些实验表象背后的实质,从而初步建立盐类水解的概念;然后分析几种盐和水的电离之间的关系,认识盐水解的实质,理解水溶液的酸碱性,并运用归纳法总结出几类盐水解的一般规律和特点。
【教师情况简介】
刘学明,女,1981年生。江苏省新海高级中学化学教师。20##年参加工作至今,中教一级。20##年获江苏省化学学科基本技能大赛一等奖。多次在省级刊物中发表文章,多次获得省师陶杯、五四杯论文奖。曾发表的教案获得国家级一等奖。
第二篇:第三单元_盐类的水解教案 1(1)
专题3 溶液中的离子反应
第三单元 盐类的水解(第一课时)
云霄一中 何少华
【教案背景】盐类水解属于化学基础理论知识,涉及的知识面比较广,综合性比较强,是前面已学过的电解质的电离、水的电离平衡、水的离子积以及平衡移动原理等知识的综合应用。学生理解起来比较困难,所以配有实验,再结合网络资源,容易引起学生的兴趣。
【教学课题】苏教版 选修4《化学反应原理》专题3第三单元盐类的水解(第一课时)
【教材分析】由于盐类的水解是一种特殊的化学平衡,有关化学平衡的建立和移动的原理同样适用于盐类的水解。本节课可采取边看、边想、边讨论、边巩固运用的学习方法。通过观察、分析、比较、演绎、推理等手段,促使学生掌握盐类水解的概念、规律以及盐类水解方程式的正确书写。
【教学目标】
1、知识与技能
认识盐类水解的原理、盐类水解的规律。
2、过程与方法
⑴通过实验并运用归纳法分析盐类的组成与盐溶液酸碱性对应关系。
⑵以水的电离平衡为基础,认真分析盐类电离出的阴、阳离子与水电离出的或结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因。
3、情感、态度与价值观
通过探究不同盐溶液呈现不同酸碱性的本质原因,学会透过现象看本质。
【教学重点】盐类水解的本质,理解强酸弱碱盐和强碱弱酸盐的水解的规律。
【教学难点】盐类水解方程式的书写和分析。
【教学方法】启发式实验引导法
【教学过程】
【问题导入】生活中常用的盐除NaCl外,还有谷氨酸钠(味精)和Na2CO3 、NaHCO3等。 NaCl和谷氨酸钠主要用于食品调味,而Na2CO3 、NaHCO3被视作“碱”用于油污清洗和面食制作,特别是Na2CO3 ,俗称纯碱。明明是盐,为什么叫“碱”呢? 实验是我们探求未知问题的好方法,下面我们做一个实验来看看,将盐溶于水后,溶液的酸碱性到底如何呢?
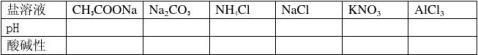
【屏幕展示】实验结果:
1
CH3COONa 、Na2CO3的水溶液:显碱性
NH4Cl 、AlCl3的水溶液:显酸性
NaCl 、KNO3溶液:显中性
【结论】盐溶液不一定都是中性,有的呈酸性,有的呈碱性
【讨论】由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系?
【讲述】下面我们分别来研究不同类盐的水溶液酸碱性不同的原因。
思考:溶液呈酸、碱性取决于溶液中с(H+)和с(OH-)的相对大小。我们知道在任何物质的水溶液中有水电离出的H+和OH-的量总是相等的,而盐本身又不能电离出H+ 或OH-,那么是谁打破了这一等量关系呢?为什么也会显示出酸碱性?
【思考与交流】
交流问题如下:
(1)盐溶液中存在哪些粒子?
(2)哪些离子间可以相互结合?
(3)对水的电离平衡有何影响?
(4)溶液中的H+ 和OH- 的浓度如何变化?
【学生活动】第一小组以NH4Cl溶液为例,讨论:为什么强酸弱碱盐显酸性?第二小组以CH3COONa为例,讨论:为什么强碱弱酸盐显碱性?第三小组以NaCl为例,讨论:为什么强碱强酸盐显中性?
【板书】一、盐类的水解
【讲述】CH3COONa溶于水之后,完全电离。(因为CH3COONa是强电解质。)CH3COONa ═ CH3COO- + Na+ ………⑴
把CH3COONa溶于水之后,溶液中存在哪些电离平衡?
【板书】H2O H+ + OH-………⑵
我们知道,CH3COOH是一种弱酸,促进了水的电离。使得溶液中的OH-的浓度大于H+的浓度。
【板书】CH3COO- + H+

CH3COOH………⑶
讲解:把⑴⑵⑶式联立,可得到:
水解方程式:
【板书】CH3COONa + H2

O CH3COOH + NaOH
这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。
【学生活动】把上述化学方程式改写成离子方程式。
【板书】CH3COO- + H2O

CH3COOH + OH-
【讨论】试从CH3COONa的水溶液显碱性的原因分析:为什么NH4Cl的水溶液显酸
性?
【屏幕展示】 氯化铵在溶液中的变化:
NH4+ + H2O
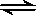
NH3.H2O + H+
NH4Cl + H2
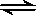
O NH3.H2O + HCl
+-【板书】1、盐类水解的定义:在溶液中盐电离出来的离子跟水所电离出来的H 或 OH
结合生成弱电解质的反应,叫做盐类的水解。
【板书】2、盐类水解的本质:弱酸的阴离子和弱碱的阳离子和水电离出的H+或OH- 2
离子结合生成弱电解质,破坏了水的电离平衡,促进了水的电离。
【说明】1、只有弱酸的阴离子或弱碱的阳离子才能与H+ 或 OH-结合生成弱电解质。
2、盐类水解使水的电离平衡发生了移动,并使溶液呈酸性或碱性。
3、盐类水解反应是酸碱中和反应的逆反应。
【讲解】CH3COONa可以看作是弱酸CH3COOH和强碱NaOH生成的盐,这种盐叫 做强碱弱酸盐。
【板书】二、盐类水解的类型
1、强碱弱酸盐水解
【讲解】由强碱和弱酸反应生成的盐,称为强碱弱酸盐,含有以上弱酸根的盐,常会发生水解。
【讨论】分析Na2CO3的水解过程,写出有关反应的离子方程式。
【板书】 Na2CO3的水解
第一步: CO32-+H2OHCO3-+OH- (主要)
第二步: HCO3- +H2

O H2CO3 +OH- (次要)
【分析】对于多元弱酸来说,水解要分步写。
【板书】2、强酸弱碱盐
【练习】写出AlCl3水解的离子方程式。
Al3+ + 3H2O

Al(OH)3 + 3H+
【讨论】以NaCl为例,说明强酸强碱盐能否水解。
【小结】由于NaCl电离出的Na+和Cl-都不能与水电离出来的H+ 或 OH-结合生成弱电解质,所以强碱强酸盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。
【板书】3、强酸强碱盐、难溶于水的盐不水解
【练习】盐类水解离子方程式的书写
FeCl3 CuSO4 NaClO K2CO3
【小结】盐类水解离子方程式书写注意事项
(1)盐类水解是可逆反应,反应方程式和离子方程式要写“ ”号
(2)一般盐类水解的程度很小,水解产物也很少,通常不生成气体或沉淀,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式。
⑶ 多元弱酸的酸根离子水解是分步进行的,水解时以第一步为主。
【小结】盐的组成与盐溶液酸碱性的关系:
强碱弱酸盐的水溶液显碱性;
强酸弱碱盐的水溶液显酸性;
强酸强碱盐的水溶液显中性。
【结论】 有弱才水解,无弱不水解--条件
越弱越水解,都弱都水解--程度
谁强显谁性.同强显中性--结果
【课堂小结】
【作业布置】
3
【板书设计】
第三节 盐类的水解(第一课时)
一、盐类水解
1、定义:在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
2、实质: 破坏水的电离平衡.
3、水解反应与中和反应的关系::酸 + 碱

盐 + 水
4、条件:①盐中必须有弱根 ②盐必须溶于水
5、规律:有弱才水解;无弱不水解;
谁弱谁水解;谁强显谁性。
4
【教学反思】
从宏观现象过渡到微观本质的分析,有一定难度。因为,创设一个激发学生学习兴趣的情境,设计一组学生实验,在教师的启发下,引导学生从观察到的现象去探究隐藏在这些实验表象背后的实质,从而初步建立盐类水解的概念;然后分析几种盐和水的电离之间的关系,认识盐水解的实质,理解水溶液的酸碱性,并运用归纳法总结出几类盐水解的一般规律和特点。
5
-
盐类的水解教学反思
盐类的水解教学反思倪维能准备这次集体备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员的帮…
-
盐类水解教学反思
盐类水解教学反思盐类水解这个知识点既是高考的重点又是高考的难点本节教材涉及的知识面较宽综合性较强是前面已学过的离子反应电解质的电离…
-
盐类的水解教学反思
盐类的水解教学反思安丰中学化学组准备这次备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员…
-
盐类的水解教学设计与反思
盐类的水解教学设计与反思一设计理念以合作学习小组为单位采取活动探究与理论探究结合的形式使学生体验知识的生成过程让学生真正动起来积极…
-
盐类的水解教学设计与反思
盐类的水解片段的教学设计与反思杨梓劲电白汉山学校环节一明确本课学习目标1知识与技能学生理解强酸弱碱盐和强碱弱酸盐的水解原理本质水解…
- 公开课--盐类的水解_教学设计
-
盐类的水解教学反思
盐类的水解教学反思倪维能准备这次集体备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员的帮…
-
盐类水解教学反思
盐类水解教学反思盐类水解这个知识点既是高考的重点又是高考的难点本节教材涉及的知识面较宽综合性较强是前面已学过的离子反应电解质的电离…
-
盐类的水解教学反思
盐类的水解教学反思安丰中学化学组准备这次备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员…
-
盐类的水解教学设计与反思
盐类的水解教学设计与反思一设计理念以合作学习小组为单位采取活动探究与理论探究结合的形式使学生体验知识的生成过程让学生真正动起来积极…
-
化学选修4第四章第三节《盐类的水解》知识总结
化学选修四第四章第3节《盐类的水解》知识总结一、探究盐溶液的酸碱性强碱弱酸盐的水溶液,呈碱性;强酸弱碱盐的水溶液,呈酸性;强酸强碱…