物质的量知识点总结
物质的量知识点复习
1、 摩尔
物质的量是国际规定的七个基本物理量之一,用来表示含一定数目粒子的集体,符号是n,单位是mol。
摩尔是计量原子、分子、或离子等微观粒子的物质的量的单位。 阿伏伽德罗常数是任何粒子的粒子数,符号是NA,常用6.02×1023
这个近似值。
2、 摩尔质量
1mol任何粒子或物质的质量以克为单位时,在数值上都与相对原子质量或相对分子质量相等。
摩尔质量是指单位物质的量的物质所具有的质量,符号是M,常用单位是g〃mol-1
3、 使用摩尔这个概念时应注意的事项
(1) 摩尔是物质的量单位,每摩尔物质含有阿伏伽德罗常数个粒子,
摩尔简称摩,符号mol。
(2) 摩尔的量度对象是构成物质的基本粒子,这里的“粒子”是指
“基本单元”,这个基本单元可以是分子、原子、离子、电子、质子、中子等单一粒子,也可以是这些粒子的特定组合。如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴、阳离子,或
含54mole-等。
(3) 摩尔概念只适用微观不适用于宏观。
(4) 使用摩尔表示物质的量时,应该用化学式指明粒子种类,而不
是使用该粒子的中文名称。
4、 气体摩尔体积
当分子数目相同时,气体体积大小主要决定于气体分子间的距离。要比较一定质量的气体体积,必须在相同温度和压强下进行。
气体摩尔体积:单位物质的量气体所占的体积,符号为Vm,单位是L/mol或m3/mol。
标准状况下气体的摩尔体积:标准状况下,即温度为0℃,压强为101Kpa时,1mol任何气体所占的体积都约是22.4L。
5阿伏伽德罗定律及推论:
根据气体状态方程PV=nRT=mRT可以得到以下定律和推论: M
(1) 同温同压下,相同体积的任何气体都含有相同数目的分子。(阿
伏伽德罗定律)
(2)同温同压下的不同气体,其体积之比等于物质的量之比,等于所含粒子数目之比。V1n1N1?? V2n2N2
(3) 同温同压下的不同气体,其密度之比等于相对分子质量之比,等于相对密度。M1?1==D12 (4)同温同压下同质量的不同气体,M2?2
其密度之比等于物质的量的比。=n1
n2?1 ?2
(5)同温同压下同质量的不同气体,其体积之比等于相对分子质量的反比。V1M2= V2M1
(6)同温同体积的不同气体,其压强之比等于物质的量之比(微粒
个数比)。P1n1N1== P2n2N2
(7)同温同压同体积的不同气体,其质量之比等于相对分子质量之比(密度之比)m1M1?1== m2M2?2
重点讲解
一、 物质的量常用的计算公式和注意问题
1、m、n、N之间的计算公式
(1)计算关系:n=mN=(2)适用范围:只要物质组成不变,无论MNA
是何种状态都可使用
2、V、n、N之间的计算关系
(1)计算关系:n=VNV== NA22.4Vm
(2)适用范围:①适用于所有气体,无论是纯净气体还是混合气体 ②当气体摩尔体积用22.4L/mol时必须是标准状况
3、混合气体平均分子量的有关计算
(1)计算依据:
①1mol任何物质的质量(以g为单位时)在数值上与其式量相等 ②1mol任何气体体积(以L为单位)在数值上与气体摩尔体积相等
(2) 基本计算关系:M=m n
m总
n总=M(A)?n(A)+M(B)?n(B)+?? ② M=n(A)+n(B)+??(3)变换计算关系:①M=
M(A)〃n(A)%+M(B)n(B)%+… ③ M =M(A)〃V(A)%+M(B)〃V(B)%+……
(4)使用说明:①(2)的计算式适用于所有的混合物计算 ②(3)
中的计算式只是用于混合气体的计算 ③(3)中的计算式之间应用了阿伏伽德罗定律
4、密度与相对密度
①计算表达式:?=m ②使用说明:A、适用于所有物质,不受物V
质状态限制,也适用于所有混合物 ;B、所有气体物质M=Vm?,标准状况下气体M=22.4?
(2)相对密度
①计算表达式:D=?1/?2=M1/M2 ②使用说明:A、相对密度是
同温同压下两种气体密度之比;B、既可以用于纯净气体之间的计算,也可用于混合气体之间的计算。
第二篇:物质的量总结
化学计量在实验中的应用——物质的量
一、知识网络:
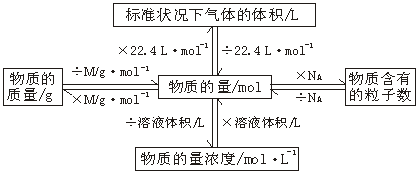
二、基本公式:
(1) 物质的量与微粒个数的关系:n=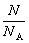
(2) 物质的量与质量的关系: n=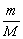 M=
M= m=M·n
m=M·n
(3) 气体物质的量与体积的关系:n=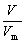 n=
n=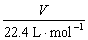 (标准状况) Vm =
(标准状况) Vm =  V=
V=
(4) 物质的量浓度:c=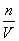 n=c·V
n=c·V
(5) 溶液物质的量浓度与质量分数的关系: c =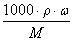 (密度的单位:g/cm3 ) n=
(密度的单位:g/cm3 ) n=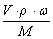
(6) 溶液稀释: c1V1=c2V2
三、物质的量的相关知识和概念:
1、物质的量:是表示大量粒子集体的一个物理量,符号为n,单位是摩尔(mol)。
2、摩尔:是物质的量的单位;
国际上规定, 1摩尔粒子集体所含的粒子数与0.012 kg C中所含的碳原子数相同,约为6.02×1023
3、阿伏加德罗常数:1摩尔的任何粒子的粒子数,即1摩尔粒子数的准确值,用符号NA表示,NA的近似值为6.02×1023mol-1。
计算公式:n=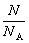
4、使用摩尔这个单位时要注意:①使用范围,只能用于微观(原子、离子等),不适用于宏观
②使用时应该用化学式指明粒子的种类,而不使用该粒子的中文名称。
5、物质的量与物质质量的关系:
1任何粒子或物质的质量以克为单位,其数值都与该粒子的相对原子质量或相对分子质量相等。
6、摩尔质量:单位物质的量的物质所具有的质量叫做~ ,用符号M表示,单位是g.mol-1。
计算公式:M=
注意:摩尔质量与相对分子质量、相对原子质量的关系:摩尔质量以g?mol-1为单位,数值上与相对分子质量或相对原子质量相等,相对原子质量或相对分子质量无单位。
7、气体摩尔体积:单位物质的量的气体所具有的体积叫做~ ,用符号Vm表示,单位是L.mol-1。
计算公式:Vm =  此概念要具备的要点:①必须是气体(可以是混合气体)②要看气体的状况
此概念要具备的要点:①必须是气体(可以是混合气体)②要看气体的状况
例如:①气体(可以是混合气体)②在标准状况下 ③物质的量为1mol ④则体积约为22.4L。
如果是气体但不在标准状况下,物质的量即使是1mol,体积也不等于22.4L。
8、阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的分子。(T、p恒定时:V1/V2=n1/n2=N1/N2)
9、阿伏加德罗定律推论: PV=nRT
(1)T、p恒定时:V1/V2=n1/n2=N1/N2 (2)T、p恒定时:ρ1/ρ2=M1/M2
(3)T、p、V恒定时:m1/m2=M1/M2 (4)T、p、m恒定时:V1/V2=M2/M1
(5)T、V恒定时:p1/p2=n1/n2=N1/N2 (6)T、V、m恒定时:p1/p2=M2/M1
10、决定物质体积的三因素:
(1)微粒(分子)的数目;(2)微粒(分子)本身的大小;(3)微粒与微粒之间的距离。
A、对于固体和液体,由于他们的分子是紧密堆积的,所以他们分子之间的距离视为零。
决定固体和液体体积的因素:微粒的数目和微粒本身的大小
B、对于气体,分子之间的距离很远,分子的直径(本身的大小)与分子之间的距离比起来是很小很小的,所以分子的直径(本身的大小)可视为零。
决定气体体积的因素:微粒的数目和微粒之间的距离
11、物质的量浓度:表示单位体积溶液里所含溶质B的物质的量。符号cB ,单位: mol?L-1
12、溶液的稀释:溶液稀释的总原则:溶质的量不变
对于质量分数的溶液:溶质的质量不变,m1W1==m2W2
对于物质的量溶液:溶质的物质的量不变,c1V1==c2V2
13、物质的量浓度c与质量分数W之间的关系:c ==1000ρW/M (密度的单位:g/cm3 )
14、一定物质的量浓度溶液的配制:容量瓶
(1)步骤:计算、称量(量取)、溶解、冷却、移液、洗涤、定容、摇匀、装入试剂瓶备用。
(2)误差分析:A、仰视、俯视 B、未冷却
●习题训练
1、下列关于物质的量的叙述,错误的是( )
A.1 mol任何物质都含有6.02×1023个分子 B.0.012 kg 12C中含有约6.02×1023个C
C.1 mol水中含有2 mol氢原子和1 mol氧原子 D.1 mol Ne中含有6.02×1024个电子
2、对于物质的量相同的硫酸和磷酸,下列说法不正确的是( )
A.分子个数相等 B.含有的氧原子数相等 C.含有的氢原子数相等 D.质量相等
3、科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列
说法不正确的是( )
A.该原子的摩尔质量是aNA B.Wg该原子的物质的量一定是 
C.Wg该原子中含有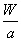 个该原子 D.由已知信息可得:
个该原子 D.由已知信息可得: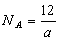
4、若某原子的摩尔质量是 g·mol-1,则一个该原子的真实质量是( )
g·mol-1,则一个该原子的真实质量是( )
A. g B.
g B.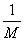 g C.
g C.
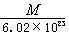 g D.
g D.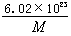 g
g
5、若50滴水正好是 mL,则1滴水所含的分子数是( )
mL,则1滴水所含的分子数是( )
A. ×50×18×6.02×1023 B.
×50×18×6.02×1023 B.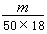 ×6.02×1023
×6.02×1023
C.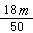 ×6.02×1023 D.
×6.02×1023 D.
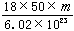
6、n g O2中有m个O原子,则阿伏加德罗常数NA的数值可表示为( )
A.32m/n B.16m/n C.n/32m D.n/16m
7、已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A.16g B.32g C.64g /mol D.32g /mol
8、与标准状况下V L CO2所含氧原子数目相同的水的质量是( )
A.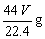 B.
B.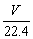 g C.
g C.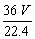 g D.
g D.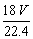 g
g
9、NA为阿伏加德罗常数,下列叙述正确的是( )
A..40 g NH4NO3中含有氮原子NA个 B.标准状况下,22.4 L H2和N2的混合气体中,H2和N2分子数之和为2NA
C.标准状况下,22.4 L CCl4所含分子数为NA D.在Fe与Cl2反应中,1 mol Fe与1 mol Cl2恰好反应
10、已知m g气体A和n g气体B所含分子数相等,下列说法不正确的是( )
A.标准状况时,相同体积的气体A和气体B的质量之比为m∶n
B.25 ℃时,相同质量的气体A和气体B的分子数之比为n∶m
C.同温、同压下,气体A和气体B的密度之比为n∶m
D.通常状况下,相同质量的气体A和气体B的体积之比为n∶m
11、在一个密闭容器中盛有11 g X气体(X的摩尔质量为44 g·mol-1)时,压强为1×104 Pa。如果在相同温度下,把更多的气体X充入容器,使容器内压强增至5×104 Pa,这时容器内气体X的分子数约为( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
12、在相同状况下,质量为Wg的测量瓶,充满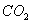 后称量其质量为124.4g;改为充满氧气时其质量为123.2g;改
后称量其质量为124.4g;改为充满氧气时其质量为123.2g;改
为充满气体X,其质量为122.8g,则充入的可能为( ) A.CO B.NO C.SO2 D.CH4
13、同温同压下的两个体积相同的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶中的气体一定具有相同的( )
A.质量 B.原子总数 C.碳原子数 D.密度
14、在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.cba D.abcd
15、将4 g NaOH溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度为( )
A.1 mol·L-1 B.0.1 mol·L-1 C.0.01 mol·L-1 D.10 mol·L-1
16、取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( ) A.0.21 mol·L-1 B.0.56 mol·L-1 C.0.42 mol·L-1 D.0.26 mol·L-1
17、相同体积的Na2SO4、MgSO4、Al2(SO4)3溶液分别加入过量的BaCl2溶液,得到沉淀的物质的量之比为1∶1∶3,这三种溶液的物质的量浓度之比为( )
A.2∶2∶3 B.1∶1∶3 C.1∶1∶1 D.3∶3∶1
18、向密度为d g·cm-3的盐酸中逐滴加入硝酸银溶液到过量,生成沉淀的质量与原盐酸的质量相等,原盐酸的物质的量浓度为( ) A.25.4d mol·L-1 B.12.7d mol·L-1 C.6.97d mol·L-1 D.6.35d mol·L-1
19、将标准状况下的a L氨气溶于1000 g水中,得到氨水的密度为b g·cm-3,则该氨水的物质的量浓度为( )
A.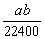 mol·L-1 B.
mol·L-1 B.  mol·L-1 C.
mol·L-1 C.  mol·L-1 D.
mol·L-1 D. 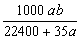 mol·L-1
mol·L-1
20、将质量分数为2 w,物质的量浓度为c1的H2SO4溶液加水稀释,使质量分数变为w,物质的量浓度变为c2,则c1和c2之间关系正确的是
A.c1>2c2 B.c2=2c1 C.c1<2c2 D.c1=2c2
21、设NA为阿伏加德罗常数。下列关于0.2 mol ·L-1 Ba(NO3)2溶液的说法不正确的是(忽略水的电离)( )
A.1 L溶液中含阴、阳离子总数是0.6 NA B.500 mL溶液中Ba2+的浓度是0.2 mol·L-1
C.500 mL溶液中NO-3的浓度是0.4 mol·L-1 D.1 L溶液中含有0.2 NA个NO-3
22、将a g锌加到V L c mol·L-1的盐酸中,共放出n L氢气(标准状况下),则被还原的HCl的物质的量是( )
A. mol B.
mol B.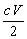 ×10-3 mol C.
×10-3 mol C.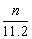 mol D. cV mol
mol D. cV mol
23、配制100 mL 1 mol·L-1氢氧化钠溶液,下列操作错误的是( )
A.在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上进行称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯、玻璃棒2~3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,到离刻度线2~3 cm时改用胶头滴管滴加,直到溶液凹面恰好与刻度相切
24、在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
A.用量筒量取浓盐酸时俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
25、配制500 mL 1 mol·L-1 NaCl溶液时,下列操作会使实验结果偏高的是______________,偏低的是______________,无影响的是______________。
A.振荡、摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未用游码)
C.原容量瓶洗涤后未干燥
D.移液时,未洗涤烧杯和玻璃棒
E.定容时,俯视刻度线
-
物质的量知识点总结
物质的量知识点复习1摩尔物质的量是国际规定的七个基本物理量之一用来表示含一定数目粒子的集体符号是n单位是mol摩尔是计量原子分子或…
-
物质的量单元知识点复习小结
物质的量单元知识点复习小结一有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微…
-
高一化学物质的量知识点归纳2
化学计量在实验中的应用考点一物质的量与摩尔质量1物质的量1定义表示物质所含微粒多少的物理量也表示含有一定数目粒子的集合体2物质的量…
-
物质的量知识点小结
物质的量知识点小结有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微观粒子群的…
-
物质的量知识点整理
第六讲物质的量1.复习重点1.理解质量守恒定律的涵义。2.明确摩尔的概念,掌握摩尔质量与相对分子质量、相对原子质量之间的区别与联系…
-
物质的量相关知识点总结
一、物质的量及单位——摩尔1.物质的量以________中所含的_________数为标准来衡量其他微粒集体所含微粒数目多少的物理…
-
盐类的水解知识点总结
盐类水解的应用考点1判断或解释盐溶液的酸碱性例如正盐KXKYKZ的溶液物质的量浓度相同其pH值分别为789则HXHYHZ的酸性强弱…
-
物质的量单元知识点复习小结
物质的量单元知识点复习小结一有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微…
-
高一化学物质的量知识点归纳2
化学计量在实验中的应用考点一物质的量与摩尔质量1物质的量1定义表示物质所含微粒多少的物理量也表示含有一定数目粒子的集合体2物质的量…
-
物质的量知识点小结
物质的量知识点小结有关概念1物质的量n物质的量是国际单位制中七个基本物理量之一用物质的量可以衡量组成该物质的基本单元即微观粒子群的…
-
工程质量监督员年终总结
建设工程质量监督员年终工作总结20xx年本人在住建局和建设工程质量管理站的正确领导下,立足本职工作,认真完成了领导交待的各项任务,…