药品生产过程质量风险评估报告
XXXX胶囊生产过程质量风险管理报告
质量风险管理号:QRM-
起草人: 起草日期: 年 月 日
审核人: 审核日期: 年 月 日
审核人: 审核日期: 年 月 日
批准人: 批准日期: 年 月 日
XXXX药业有限公司
目录
XXXX胶囊生产过程质量风险管理报告
1、简介
2、目的
3、范围
4、引用资料
5、风险管理小组组员及职责分工
6、质量风险管理流程
7、风险管理过程
8、风险管理总结及结论
9、风险管理回顾审核
XXXX胶囊生产过程质量风险管理报告
1.简介:
1.1产品概述:XXXX胶囊为以化学原料药XXXX和适量等辅料制成的化学药胶囊剂制剂,为耳鼻喉科及皮肤科用药类非处方药药品。用于缓解过敏性鼻炎有关的症状,如喷嚏、流涕、鼻痒、鼻塞以及眼部痒及灼烧感。口服药物后,鼻和眼部症状及体征得以迅速缓解。亦适用于缓解慢性荨麻疹、瘙痒性皮肤病及其他过敏性皮肤病的症状和体征。规格为10 毫克;贮藏:遮光,密闭保存;包装:铝塑泡罩包装。每板6粒,每盒1板;每板6粒,每盒2板;每板12粒,每盒1板,每板4粒,每盒1板。有效期:30个月。
1.2生产批量:35万粒,140万粒。
1.3主要生产工艺过程及参数:
1.3.1过筛:取XXXX、乳糖、硬脂酸镁及羟丙纤维素分别过100目筛。
1.3.2预混合:批量为35万粒用SYH-200型三维运动混合机进行,混合速度900转/分,混合时间20分钟;批量为140万粒的预混合和35万粒相同,但原辅料均分4等分进行4次混合。
1.3.3 粘合剂15%聚维酮K30的乙醇溶液的配制:按聚维酮K30:95%乙醇量=1.5:8.5(重量比)进行配置,溶解完全100目滤布过滤。
1.3.4制软材:上述预混合好的细粉,用GHL-250型高效混合制粒机中(每次35万粒量),设定混合I和切割I开动设备混合10分钟后,徐徐加入粘合剂(15%聚维酮K30的乙醇溶液),加完后继续混合3-4分钟,收集软材。
1.3.4制粒:用YK-160型摇摆式颗粒机制粒,筛网目数为 24目。
1.3.5干燥:湿颗粒用GFG-120型高效沸腾干燥机干燥,每次干燥量为35万粒胶囊的颗粒量,控制干燥温度为50℃~70℃,干燥时间20分钟。
1.3.6整粒:干燥好的颗粒用YK-160型摇摆式颗粒机整粒,筛网目数为 24目。
1.3.7总混:批量为35万粒的总混:用SYH-200型三维运动混合机进行,混合速度900转/分,混合时间20分钟;批量为140万粒的总混:用EYH-1000型二维运动混合机进行,混合时间35分钟(此设备无速度调节)。
1.3.8充填、抛光:根据对总混颗粒XXXX的含量、总颗粒量、规格计算胶囊充填量。用NJP-1200C-1型全自动胶囊充填机,二号胶囊充填模具,用二号空心胶囊进行充填,装量差异控制在充填量的±8%范围内,充填速度为800~1200粒/分。充填过程中,每20分钟检查一次装量。将充填好的胶囊用HTP-Ⅱ型胶囊、片剂抛光机抛光。
1.3.8铝塑泡罩包装:用DPP-138A型平板式铝塑泡罩包装机或DPP-250型平板铝塑泡罩包装机进行泡罩包装,同时产品冲印批号、有效期。按4粒/板、6粒/板或12粒/板泡罩规格采用相应的二号胶囊泡罩模具,上、下封温度约为120℃,热封温度为160℃。
1.3.9外包装:每盒一张说明书,每个盒子及纸箱均打印产品批号、生产日期、有效期,电子监管码?;按6粒/板×1板/盒×200盒/箱或12粒/板×1板/盒×200盒/箱或6粒/板×2板/盒×200盒/箱或4粒/板×1板/盒×200盒/箱的包装规格进行包装。
1.4中间产品的贮存要求:XXXX胶囊颗粒(总混后)用洁净塑料袋盛装,扎紧袋口置洁净的不锈钢桶中密闭,在口服制剂车间中间站贮存,贮存期:天;XXXX胶囊(内包前)用洁净塑料袋盛装,扎紧袋口置洁净的不锈钢桶中密闭,在口服制剂车间中间站贮存,贮存期:天;XXXX胶囊待包装半成品在口服制剂车间中间站或外包间暂存区暂存,贮存期:天。
1.5生产环境条件:整个生产过程中外包装工序在一般生产区,称量、筛粉、预混合、配粘合剂、制粒、干燥、整粒、总混、充填、抛光、铝塑泡罩包装工序D级洁净区。
XXXX胶囊作为公司的主要产品,自20##年正式生产以来,生产产品 批,产品均符合标准规定,未产生过质量事故,也发生过严重的毒副作用及不良反应。
2、目的:
2.1通过对XXXX胶囊生产过程质量风险管理,对其带来的质量风险进行有效控制,保证产品质量。
2.2为确定XXXX胶囊生产工艺、操作规程及生产过程涉及的厂房设施、设备等的确认和验证的范围和限度提供风险分析评估的参考依据。
3、范围:适用于XXXX胶囊生产过程质量风险管理。
4、引用资料:
4.1《药品生产质量管理规范》(2010版);《药品GMP指南》2011
4.2《质量风险管理规程》;
4.3相关的资料:《XXXX胶囊生产工艺规程》
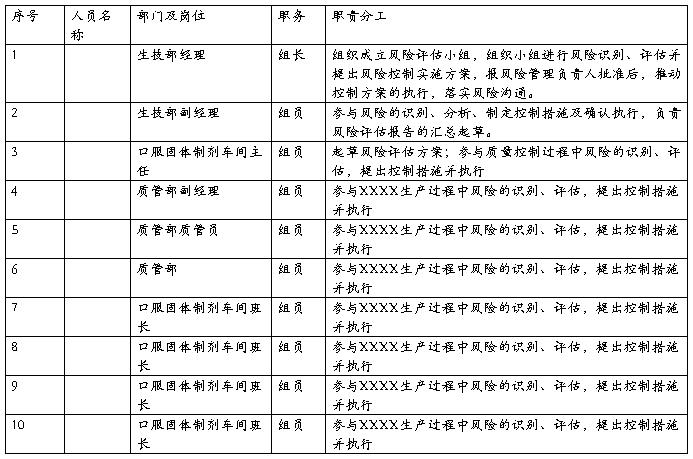
5、风险管理小组成员及职责分工
风险管理小组成员及职责分工表
6、质量风险管理流程:执行公司制定的《质量风险管理规程》
7、风险管理过程
7.1风险评估与控制
7.1.1使用的方法和工具:使用失效模式效果分析(FMEA)法进行
7.1.2风险的评估及控制措施
7.1.2.1风险识别:通过对该产品的整个生产过程所涉及到的人、机、料、法、环等各方面进行风险梳理识别。
7.1.2.2风险分析、评价及控制措施
(1)风险严重程度、发生几率、发现的可能性评分标准及风险级别评判标准及风险控制措施:见下表1. 表2. 表3.表4.
表1.严重程度

表中的“顾客”一词,可以是内部顾客,例如一下工序,也可以是最终用户。
表2.发生几率

表3.发现的可能性

表4.不同风险得分值划定风险等级及风险控制措施

注:风险可接受标准的制定:
严重程度:结果的严重性:中等,对生产线造成较小的破坏,可能有部分产品需报废(但无需挑选)或需对100%产品进行返工。顾客感觉到不方便或有些不满。得分:3分;
发生几率:中等:偶尔发生的失败。得分:3分;
发现的可能性:中等可能性:目前的方法有中等的可能性可以检测出失败模式,得分:3分;
最低可接受标准:3×3×3=27分
(2)风险评价及控制措施:
通过检索资料、产品质量回顾与总结历史经验等方法识别确定潜在的失效模式,列出每个失效模式的潜在结果,对每一个失效模式给出严重性分数,识别每个失效模式的原因,给出每个原因的发生几率分数,识别用于发现失效模式的当前控制手段,对每一个原因和控制手段给出发现的可能性分数。
计算FMEA中每一条风险分值:风险分值=严重性分数×发生几率分数×发现的可能性分数。
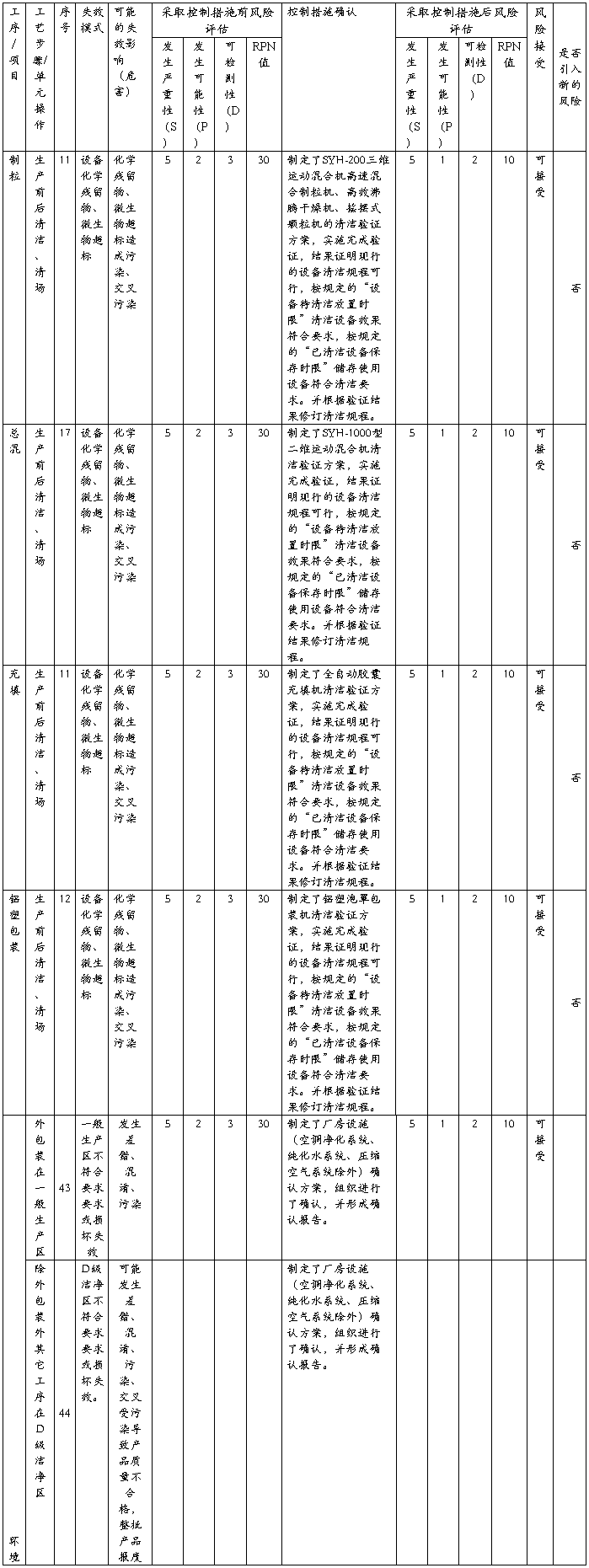
根据风险分值对照上表4. 风险级别评判标准及风险控制措施的要求制定风险预防控制措施,具体见后附的《XXXX胶囊生产过程质量风险评估与控制表》。
从后附的《XXXX胶囊生产过程质量风险评估与控制表》可见,从XXXX胶囊生产过程所涉及到的人、机、料、法、环等各方面进行风险源梳理识别,对XXXX生产工艺、操作规程及生产过程涉及的人员、厂房设施、设备等等45项风险进行评估。39项风险按现行控制措施进行管理其风险属于低风险级别,可以接受,只需按现行控制措施控制,不需要采取新的更多的控制措施。6项风险属于中等风险,需要采取有效措施控制解决,控制措施见该表。
7.1.3风险控制措施实施计划制定审核批准
根据《XXXX胶囊生产过程质量风险评估与控制表》制定风险预防控制措施制定的口服固体制剂车间空调净化系统风险控制实施计划交相关责任人审核批准,见后附的《XXXX胶囊生产过程质量风险控制实施计划表》。
7.1.4风险控制措施实施计划实施、落实跟踪
XXXX胶囊生产过程质量风险控制实施计划实施情况及跟踪检查确认,见后附的《XXXX胶囊生产过程质量风险控制实施计划落实跟踪记录表》及后附的文件:
7.2风险控制执行完毕后的风险再评估
风险控制措施实施计划完成后对其效果进行评估,见后附的《XXXX胶囊生产过程质量风险采用控制措施后的风险再分析与评价表》,从《XXXX胶囊生产过程质量风险采用控制措施后的风险再分析与评价表》可见,风险控制措施计划均规定实施完成,风险均已降低到接受标准,风险得到有效控制,未产生新的风险。
8、风险管理总结及结论
8.1本次按公司质量风险管理规程进行了XXXX胶囊生产过程质量风险管理。对XXXX胶囊生产过程质量风险进行了调查研究讨论,从XXXX胶囊生产过程所涉及到的人、机、料、法、环等各方面进行风险源梳理识别,对XXXX胶囊生产工艺、操作规程及生产过程涉及的人员、厂房设施、设备等45项风险进行评估。从评估结果来看,39项风险按现行控制措施进行管理其风险,属于低风险级别,可以接受,只需按现行控制措施控制,不需要采取新的更多的控制措施。6项风险属于中等风险,制定风险控制措施及实施计划,落实实施完成,并进行实施效果评估,风险均已降低到接受标准,风险得到有效控制,未产生新的风险。通过此次质量风险的管理,使XXXX胶囊生产过程质量风险将得到更有效的控制,保证产品质量。
8.2以后在XXXX胶囊生产过程要继续严格执行好现行控制措施,有效的控制质量风险,确保产品质量
9、风险管理回顾审核
9.1对XXXX胶囊生产过程风险管理的过程、结果应进行定期回顾评估:对风险控制措施的有效性等进行再评估,风险审核每年一次。
9.2XXXX胶囊生产过程风险管理回顾评估审核应同时结合最新的知识和经验进行,质量风险管理结果应根据新知识、新环境而更新,通过回顾评估审核确认是否达到可接受标准。
9.3在相关法律、法规变更或XXXX胶囊生产过程对产品质量产生影响的物料、生产工艺、操作规程及生产过程涉及的人员、厂房设施、设备等改造、变更、或重要部件维修更换时等情况下,要及时进行风险评估,是否产生新的风险,风险是否均能接受,如不能接受应按要求制定控制措施,并实施控制。
XXXX生产过程质量风险评估与控制表(采用FMEA)

XXXX胶囊生产过程风险控制实施计划表 RD-

XXXX胶囊生产过程质量风险采取控制措施后风险再评估表(采用FMEA)
第二篇:药品经营企业质量风险评估报告
XXXX医药有限公司
20##年一季度质量风险管理评估报告
报告编制部门:质管部
编制:20##年3月30日
目 录
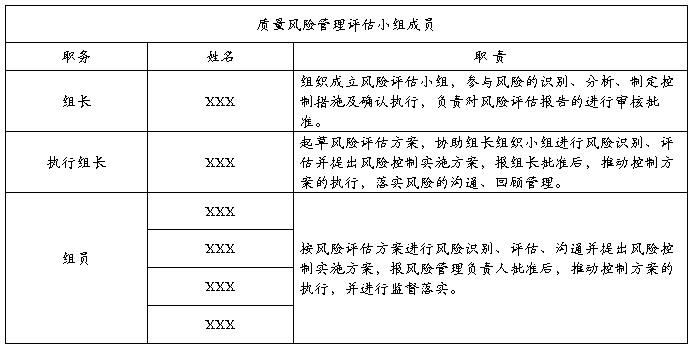
1.风险评估小组成员:
2.概述
2.1公司基本经营情况简介
2.2评估原则
2.3本次风险评估的目的
2.4本次风险评估的范围
3.内容
3.1风险的评价
3.2风险的控制
3.3风险的分析评价结果
4. 做好整改、控制风险
5.风险回顾
6.评估总结与建议
1.风险评估小组成员:
2、概述:
2.1公司基本经营情况简介
公司经营范围包括中药材、中药饮片、中成药、化学原料药、化学药制剂、抗生素制剂、生物制品(除疫苗)、蛋白同化制剂、肽类激素、医疗器械及保健品等6870个品种,20##年销售总额12098万元。
公司秉承“质量缔造品牌 品牌提升效益”的质量方针,依据质量方针,制定年度质量目标并按部门按岗位逐级展开,实行季度考核与年度评比相结合的方式,将质量目标层层落实到各基层岗位。公司董事长(法定代表人)本科学历,从事药品经营管理工作24年;公司质量负责人本科学历,从事药品经营管理工作12年,熟悉药品经营相关法律法规,能够保证质量管理部门有效履行职责;具备丰富的药品质量管理工作经验,能独立履行质量管理职责。
公司设置人力资源部、采供部、质管部、财务部、营销部、信息部、仓储部、运输部,质量管理部负责从事质量管理、验收、养护等工作,现在员工12人,其中执业药师5人。公司成立专项小组开展质量管理体系内部评审、质量风险评估以及供货企业质量管理体系评审、购货企业质量管理体系评审等活动。
风险无处不在,在药品流通过程中,以下环节可能存在风险点:人员、质量体系、质量管理文件、采购、收货、验收、储存、销售、配送、退货、计算机系统、设施与设备。依据风险的识别、分析、评价、控制和回顾,我公司成立了以公司质量负责人为组长的质量风险管理领导小组,并对质量风险管理工作进行了管控。
2.2评估原则
风险评估是在风险识别的基础上,运用概率论或数理统计方法,对已经被识别的风险及其问题进行分析,通过分析确认将会出现问题的可能性有多大,出现的问题是否能够被及时地发现以及造成的后果等,参照预先确定的风险标准对风险进行评价。
在评估中应公平、公正、公开、客观、真实、全面,保障评估的有效性。
2.3本次风险评估的目的
建立有效的质量风险管理,及时解决公司经营过程中的各种药品质量风险、经营质量风险,减少质量风险带来的损失,以最小的成本和风险,获得最大的收益和安全保障,确保公司各项业务经营的持续、稳定、安全运行。
2.4本次风险评估的范围
本次风险评估的范围是对公司组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统等各要素的质量风险进行识别、评估、控制、沟通、回顾,覆盖药品采购、收货、验收、储存、销售、出库、运输配送、退货、售后各个环节。
3.内容
3.1、风险评价
风险评价是在一个风险管理过程中,对支持风险决策的资料进行组织的系统过程。它包括风险分析和风险评估两个部分。
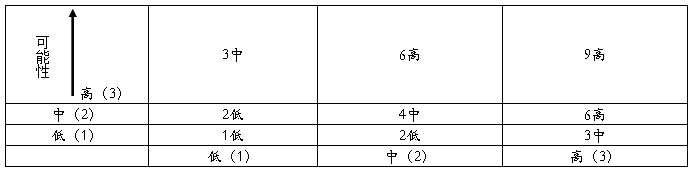
风险分析就是对风险的严重性和可能性进行分析判段。严重性(S)就是对风险源可能造成的后果的衡量,可能性(P)就是有害事件发生的频率或可能性。它们分别分三级,分级标准如下

风险评估是使用下图,以确定风险的严重性。根据风险严重程度,确定风险可接受性,低风险是可接受风险,可不必主动采取风险干预措施;中等风险是合理风险,通过实施风险控制措施,风险得以降低,效益超过风险,达到接近可接受水平;高风险是不可接受风险,指风险可能导致的伤害严重,必须采取有效干预措施,以规避风险。

对风险识别的各风险点进行逐一分析,经过质量风险评估小组评估、审定,最终确定本次评估后需要重点关注的质量风险有:
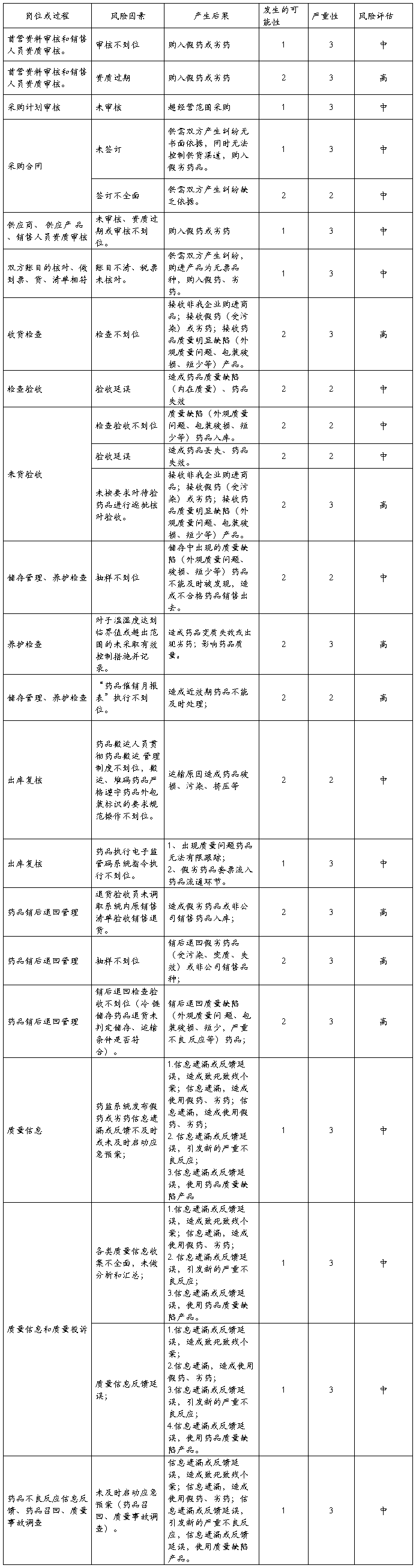
3.2、风险控制
风险控制是采取措施,其目的是将风险降低到一个可以接受的水平。针对经营过程各环节进行的质量风险评价,为减少人为因素引发的经营环节高风险,采取相应的质量风险控制措施。
岗位风险控制表
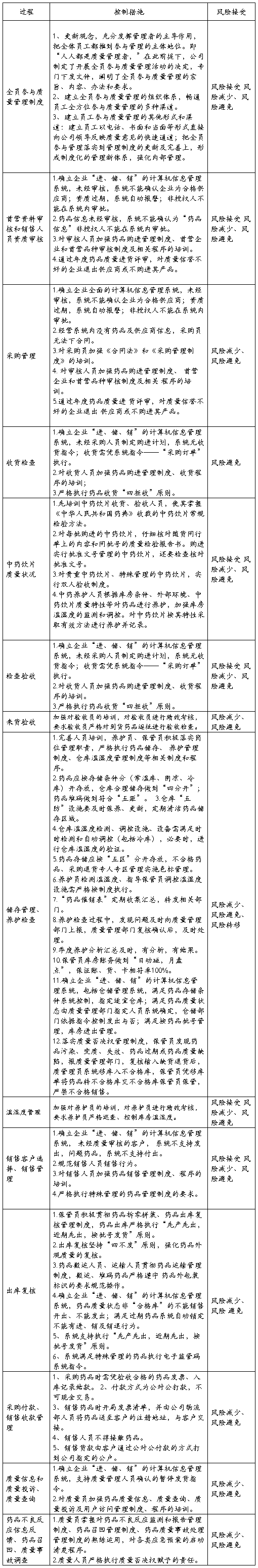
通过分析,公司的质量工作措施基本全面,不需要再增加新的控制措施。
但是药品经营全过程中,环节众多,过程复杂,因此必须加强预先防范、同步控制、重视事后反馈控制(质量风险控制策略包括事前控制、事中控制、事后反馈等步骤。事前控制, 即在质量风险发生前对其采取的预防性控制措施,以避免各种失误、浪费和损失的发生。具体措施包括风险避免、风险减弱、风险转移、风险自留等方法。事中控制,即指药品质量风险发生后,公司应主动运用质量风险管理方案, 积极、科学、快速地做出应对措施,将损失降低至最小。事后反馈,是指药品质量事故发生后,对整个事件本身进行总结分析,并据此提出今后的改进方案,为今后质量安全防范措施的制定和实施提供科学依据。),从而将质量风险降至可接受的水平。
有效发现和控制对质量有重大影响的关键控制点,从而降低质量管理中的漏洞或者盲点。具体措施包括加强企业负责人的质量风险意识,,建立质量风险管理组织机构,确立质量风险管理制度,定期开展质量风险管理活动;加强全员质量风险管理制度培训,培养全员质量风险管理意识。
3.3风险的分析评价结果
在药品经营过程中,质量风险的确认、风险评估、严重程度、风险控制、处理等信息都需要充分交流,通过质量风险沟通的形式,完整记录书面结果。开展质量风险管理,并将质量风险管理实施过程通过文件的形式固定下来。
4.做好整改、控制风险:
对于已经评定为风险级别高的风险点,公司重新强化主管人员和岗位人员责任意识,人员相对固定。加强各岗位人员培训工作,使各岗位人员能充分掌握相应的专业知识和操作技能,正确履行岗位职责。对购销方资质档案进行严格审核,对个别资质不齐全或是到期的企业,立即联系索要最新资质。GSP 要求全员参加质量管理,所有人员上岗前均应进行培训,人员调整到新岗位时,也要进行上岗前培训,重点是与新岗位有关的内容,目前,公司制定了教育培训计划,下一步将抓好计划的落实。
整改后进行再次评定,风险综合指数降低到低风险标准,为可接受的水平。
5.风险回顾
通过其他公司所已发生的质量风险案例,开展风险回顾活动,对风险管理效果的评估和总结,为启动新一轮风险管理循环提出建设性意见。
6.评估总结与建议
综合评估分析,公司20##年一季度各环节在经营销售过程中质量风险比较小,完全可接受,但建议做好如下管理:
加强本风险评估确定存在的主要缺陷和关键缺陷风险项目管理,保证各项措施落实到位、有效执行,同时兼顾本风险回顾确定的一般缺陷风险,若企业重复出现一般缺陷或存在多项关联缺陷时,则证明风险级别提高一级,所以不应忽视一般缺陷风险,需持续改进。
XXXX医药有限公司
二〇##年三月
-
产品质量风险评估报告
复方氨酚那敏颗粒质量风险评估报告报告起草:年月日报告审核:年月日报告批准:年月日有限公司二〇##年八月目录1.复方氨酚那敏颗粒注册…
-
质量风险评估报告
同仁堂LQA70150第1页共7页生产质量管理文件同仁堂LQA70150第2页共7页生产质量管理文件同仁堂LQA70150第3页共…
-
产品风险评估报告一览表
香港泰成玩具有限公司ProductRiskAssessmentForm产品风险评估一览表DepartmentInvolvedRam…
-
质量风险评估报告
年月质量风险评估应用质量风险管理的方法确定质量风险管理模式图一风险识别确定事件并启动质量风险管理需要做什么风险评估为什么做成立由验…
-
生产部质量风险评估报告
部门质量风险评估报告备注:1级为严重,造成产品质量不可控。2级为较严重,产品质量可控但不稳定。3级为较轻,产品偶尔出现问题。
- 生产设备风险评估报告
- 生产设备风险评估报告
-
FGJ-300高效粉碎机设备风险评估报告121120
FGJ300高效粉碎机设备风险评估报告编号制订人日期审核人日期日期日期批准人日期设备名称高效粉碎机制造厂商温州市制药设备厂使用部门…
-
JSH-400三维运动混合机设备风险评估报告121120
JSH400三维运动混合机设备风险评估报告编号制订人日期审核人日期日期日期批准人日期设备名称三维运动混合机制造厂商温州健牌药业机械…
-
20xx前处理车间设备设施风险评估报告
FX20xx101第1页共13页1概述根据药品生产质量管理规范20xx年修订第二章第十四条规定应当根据科学知识及经验对质量风险进行…
-
药品贴标包装风险评估报告
文件标题药品贴标包装质量风险评估报告文件编号SORQR00101药品贴标包装质量风险评估报告1概述根据药品生产质量管理规范20xx…