实验四 重结晶及熔点的测定
实验四 重结晶及熔点的测定
预习内容:实验教材P48~53,P54~58。
一、实验目的:
1. 学习通过重结晶提纯固体有机物的原理和方法;
2. 掌握折叠滤纸、热过滤、抽滤等基本操作;
3. 学习并掌握毛细管法测熔点的方法。
二、仪器和药品
仪器:烧杯(250mL)、表面皿、无颈漏斗、烘箱(公用)、减压水泵(公用)、熔点管、水银温度计等;
药品:粗苯甲酸、活性炭、液体石蜡等;
其他:滤纸(热过滤用,抽滤用)、玻棒、沸石等。
三、实验原理及教师讲解要点:
1.重结晶的基本原理:
重结晶是纯化固体物质的一种方法。它是利用在不同温度下被提纯物质与杂质在溶剂中的溶解度不同,将杂质分离出去的提纯方法。
大多数有机物的溶解度都随着温度的升高而增大。选择溶剂,在较高温度(接近溶剂的沸点)下,制成被提纯有机物的饱和或接近饱和的浓溶液,趁热过滤后,让被提纯物从过饱和溶液中的以结晶析出,而杂质则全部或大部分仍留在溶液中,或者在热过滤时被分离出去。
重结晶只适用于提纯杂质含量在5%以下的固体有机物。(Why?)
重结晶时,应根据下列条件选择溶剂:
(1) 不与被提纯物质起化学反应;
(2) 对被提纯物质的溶解度随温度变化较大;(Why?)
(3) 对杂质的溶解度非常大或非常小;(Why?)
(4) 易挥发,易除去;
(5) 能给出较好的结晶。
在实际的选择过程中,主要是根据相似相溶原理,查阅数据手册,选出几种溶剂用试管进行实验观察,选出符合上述五个条件的溶剂。必要时,可使用混合溶剂。
2.折叠滤纸的折叠:(略)
3.热过滤的操作和技巧:准备充分,快速协调,趁热过滤。
4.测熔点的原理和方法:
一般认为固态物质受热后变为液体时的温度,就是该物质的熔点。实验证明,同一物质在不同的压力下,熔化温度并不完全相同。熔点的严格定义为:物质的固液两态在大气压力下达到平衡状态时的温度。
有机物的熔点通常用毛细管法来测定。实际上由此法测得的熔点数据不是一个温度点,而是一个熔程,即样品从开始熔化到完全熔化为液体的温度范围。
纯的固态物质通常都有固定的熔点(熔程约0.5°C)。如有其他物质混入,则对其熔点有显著的影响:熔点降低,熔程拉长。因此,可借助熔点的测定来定性地判断固体样品的纯度。
四、仪器装置:
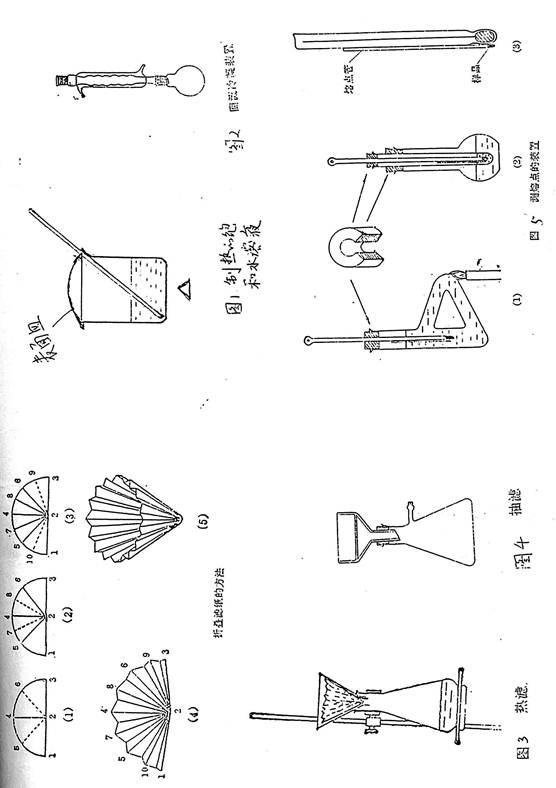
重结晶各种装置如图1,图2,图3,图4所示。
图1适用于用水做溶剂的情况,图2适用于用其他低沸点有机溶剂。
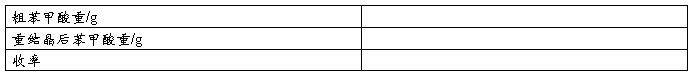
测熔点的装置见图5。
五、操作步骤:
(一)重结晶的简单过程为:
溶解®脱色®热过滤®冷却®抽滤,洗涤®干燥®称重,计算产率。
最后,还要用测熔点的方法检查产品纯度是否达到要求。
1.溶解:
250mL烧杯中:3g粗苯甲酸+80mL水+2粒沸石,盖上表面皿,用小火加热至沸,其间可用玻棒搅动。观察样品是否完全溶解,若有未完全溶解的样品,则需补加水(记下补加水的体积),直到样品完全溶解为止。再加入总用水量12%的水[1],加热至沸。移去火源,稍冷,加入适量活性炭[2],搅拌,沸煮5~10min,待热过滤。对易挥发性溶剂要用回流装置。
2.热过滤:
从烘箱中取出预热好的无颈漏斗,将事先叠好的折叠滤纸放入其中,并用少量热水润湿[3],将上述热溶液趁热过滤。
热过滤时,无颈漏斗上可加盖表面皿,以防止溶剂挥发,并有保温作用。使用有机溶剂重结晶时,周围火源要熄灭。
3.结晶:
骤冷得小颗粒,自然冷却得大颗粒。有时有油状物或胶状物存在,结晶不易析出,可采用搅拌、加入晶种、磨擦仪器内壁、过滤等办法使晶体析出。
4.抽滤,干燥。
5.称重,计算收率。
数据记录:
(二)测熔点:
毛细管法测熔点的主要过程为:准备热浴®装样®加热,观察®读数。
1.准备热浴:
设计熔点浴的原则是使样品受热均匀,通常有b形管和双浴式,本实验采用双浴式。
首先,选择大小合适的橡皮塞,在中心处用打孔器打孔以插入温度计,并在边缘开一小槽以接通大气。然后,在b形管中倒入适量的浴液。常用的浴液有:浓硫酸、液体石蜡、甘油、机油、硅油等。本实验采用腐蚀性小的液体石蜡做浴液。
2.装样:
将0.1g样品在表面皿上研细[4],堆起来,将事先准备好的熔点管的管口朝下,插入样品粉未中,然后管口朝上利用自由落体运动使样品粉未落入并填实管底[5],如此反复几次,装样高度为2~3mm。最后擦去管外粘附的粉未,将熔点管固定在水银温度计上,注意使样品处于水银球的中部。
3.测定熔点:
将带有样品的温度计插入b形管中,其水银球位于b形管上、下两叉口的中间。用小火加热b形管远离样品的一端,浴液开始对流循环,温度计读数上升。加热速度开始可稍快,接近熔点时必须调整火焰,放慢升温速度(约每分钟上升1°C),直到样品全部熔化。
记录样品的萎缩温度、初熔温度、全熔温度。平行两次实验[6]。
对未知样品,先要进行粗测,以知道样品的大致熔点,再按已知样进行两次平行实验。
数据记录:
六、注释:
[1]为了防止热过滤时,样品过早析出而造成损失,又不至于由于溶剂用量过多而造成溶解损失,经验结果表明,溶剂的实际用量应为理论用量的120%。
[2]活性炭用量过少时脱色效果不好,但用量过大时,会吸附样品,损失收率。一般活性炭用量为样品量的1~5%。
[3]使用有机溶剂时,则要用相应的热溶剂润湿滤纸。
[4]样品一定要研细,否则装样时不易填紧。
[5]若装样时未填紧,会在样品中产生小的空气室,使样品受热不均匀,熔程拉长。
[6]每次测定都必须用新的熔点管重新装样测定;每次测定时浴液温度都要降至熔点30°C以下。
七、回答思考题:
1.重结晶一般包括哪几个操作步骤?各步操作的目的是什么?
答:重结晶一般包括:溶解、脱色、热过滤、冷却结晶、抽滤、干燥等操作步骤。各步操作的目的如下:
熔解:配制接近饱和的热溶液;
脱色:使样品中的有色杂质吸附于活炭上,便于在热过滤时将其分离;
热过滤:除去样品中的不溶性杂质;
冷却结晶:使样品结晶析出,而可溶性杂质仍留在溶液中;
抽滤:使样品可溶性杂质与样品分离。
干燥:使样品结晶表面的溶剂挥发。
2.在什么情况下需要加活性炭?应当怎样加活性炭?
答:样品颜色较深时,需要加入活性炭进行脱色。为了防止爆沸,加活性炭时应将热溶液取下稍冷后再加。
3.为什么热过滤时要用折叠滤纸?
答:增大过滤面积,加快过滤速度。
4.为什么利用重结晶只能提纯杂质含量低于5%的固体有机物?
答:如果样品中杂质含量大于5%,则可能在样品结晶析出时,杂质亦析出,经抽滤后仍有少量杂质混入样品,使重结晶后的样品纯度仍达不到要求。
第二篇:苯甲酸的重结晶及测熔点

-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
- 熔点的测定实验报告
-
有机化学实验报告实例熔沸点的测定
有机化学实验报告姓名班级学号郑州轻工业学院化工系实验名称熔点沸点的测定姓名班级学号实验日期实验目的1掌握用齐列管法测定有机化合物熔…
-
熔点.沸点的测定实验报告(4)沈杰
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程学院化学工程与工艺化工114班沈杰学号114020…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工101班郭了了学号104020xx114…
-
有机化学实验报告实例熔沸点的测定
有机化学实验报告姓名班级学号郑州轻工业学院化工系实验名称熔点沸点的测定姓名班级学号实验日期实验目的1掌握用齐列管法测定有机化合物熔…
-
有机化学实验-----蒸馏及沸点的测定技术
实验报告姓名班级同组人项目蒸馏及沸点的测定技术课程学号一实验目的1了解蒸馏和沸点测定的基本原理和意义2掌握蒸馏和沸点测定的操作技术…
- 熔点的测定实验报告
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工101班郭了了学号104020xx114…
-
有机化学实验报告 苯甲酸的重结晶
苯甲酸的重结晶一、实验目的:1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。二、基本原理:1…