实验1 粗盐提纯实验报告
实验1 粗盐提纯
实验目的
1、了解如何除去粗盐中的不溶性杂质和可溶性杂质(硫酸盐、镁离子、钙离子)
2、通过实验进一步巩固溶解、过滤、蒸发等基本操作
实验仪器和药品
药品:粗盐、水、BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸、
仪器:烧杯、玻璃棒、漏斗、滤纸、蒸发皿、酒精灯、铁架台(带铁圈)、坩埚钳、胶头滴管、剪刀、火柴
实验操作
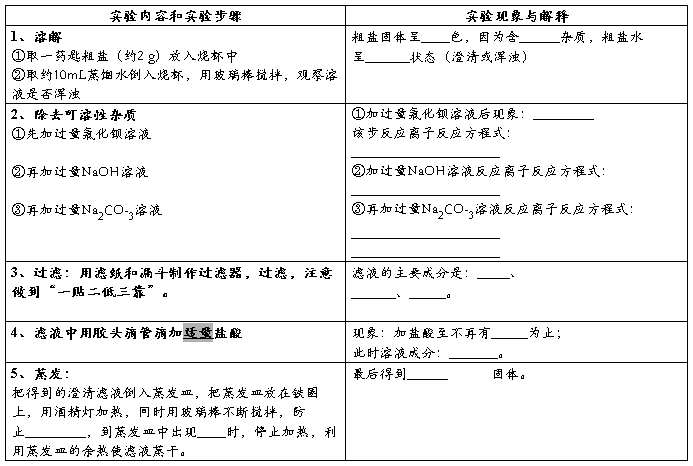
问题与交流
1、如何检验BaCl2溶液已经加过量?具体操作?
2、过滤后滤液仍然浑浊的原因有哪些?
第二篇:九年级下化学实验报告
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:金属活动性的探究
实验目的:
1、比较几种金属活动性大小。
2、理解置换反应概念。
实验器材:
试管4支、小木条、稀HCl、镁带、锌粒、铁屑、铜丝、稀H2SO4
实验步骤:
1、分别在4支试管中装入5ml稀盐酸。
2、分别投入少量的Mg、Zn、Fe、Cu。
3、用燃着的木条放于试管口。
4、用稀H2SO4代替稀HCl重作以上实验。
现象:
1、第1支试管反应最剧烈,产生大量的气泡。
第2支试管反应适中,气泡较多。
第3支试管反应较慢,气泡较小。
第4支无任何现象。
2、点火后,可见前3支试管口瞬间出现浅蓝色火焰。
分析及结论:
1、Mg+2HCl=MgCl2+H2↑ Fe+2HCl=FeCl=FeCl2+H2↑
Zn+2HCl=ZnCl2+H2↑ Cu与稀HCl,稀H2SO4不反应,四种金属活动性顺序为Mg>Zn>Fe>Cu。
2、如以上反应,由一种单质和一种化合物生成另一种单质和另一种化合物的反应,叫置换反应。
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:配制一定浓度的溶液
实验目的:
掌握配制某A%溶液的方法
实验器材:
天平、药匙、烧杯、量筒(50ml)、细口瓶、食盐
实验步骤:
1、计算:算出配制50g,6%的NaCl深液中NaCl和H2O的质量。
2、称量,溶解:用天平称出所需NaCl倒入烧杯中。用量筒量取所需的水,倒入盛有NaCl的烧杯中,搅拌。
3、装瓶:把溶液装入细口瓶中,盖上瓶塞,贴上标签。
现象:
1、m(NaCl)=3g m(水)=47g V(水)=47ml
2、标签应包括药品名称和溶液中溶质的质量分数。
分析及结论:
m(NaCl)=50×6%=3g
V(水)=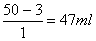
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:酸的化学性质
实验目的:
由HCl、H2SO4归纳酸的通性
实验器材:
点滴板、滴管、试管2支、稀HCl、稀H2SO4、石蕊、酚酞试液、锈铁钉
实验步骤:
1、在点滴板上分别滴2d稀HCl、稀H2SO4,在其中滴入石蕊、酚酞试液。
2、写出Mg、Zn、Fe与稀H2SO4,投入锈铁钉,1分钟后取出,用水洗净铁钉。
现象:
1、

2、投入锈铁钉后,溶液呈浅黄色,铁钉变得光亮洁净。
分析及结论:
1、酸性溶液遇石蕊变红,遇酚酞不变色。
2、Mg+H2SO4=MgSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
3、Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe(SO4)3+3H2O
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:碱的化学性质
实验目的:
由NaOH、Ca(OH)2学习碱的通性
实验器材:
点滴板、滴管、NaOH、 Ca(OH)2、石蕊、酚酞试液
实验步骤:
1、在点滴板上分别滴入2dNaOH溶液和Ca(OH)2溶液,往其中滴入石蕊,酚酞试液。
2、回忆检验CO2的反应。
3、NaOH在空气中不仅会吸水还能与CO2反应,写出方程式。
现象:

分析及结论:
1、碱性溶液遇石蕊变蓝,遇酚酞变红。
2、CO2+ Ca(OH)2=CaCO3↓+H2O
3、CO2+ 2NaOH=Na2CO3+H2O
从本实验可归纳出碱的通性:1、显色反应。2、+非金属氧化物。
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:中和反应
实验目的:
1、学习判断酸碱反应完全的方法。
2、认识中和反应。
实验器材:
烧杯、滴管、酚酞试液、稀HCl、NaOH
实验步骤:
1、在小烧杯中加入10ml NaOH溶液,滴入几滴酚酞溶液。
2、再慢慢滴入稀HCl,并不断搅拌,至溶液颜色恰好变成无色为止。
现象:
1、溶液变成红色。
2、红色逐渐减退,直至呈无色。
分析及结论:
1、碱性溶液遇酚酞变红。
2、NaOH被HCl中和,溶液碱性减弱故红色逐渐减退。
NaOH被完全中和时,溶液不再呈碱性,故变为无色。
NaOH+HCl=NaCl+H2O
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:测量溶液的PH
实验目的:
1、学习使用PH试纸。
2、了解某些溶液的酸碱度。
实验器材:
玻璃片、玻璃棒、PH试纸、稀HCl、5%NaOH、5%氨水、橘子汁等物质
实验步骤:
1、在玻璃片上放一小片PH试纸,用玻璃棒滴1d待测液到试纸上。
2、与标准比色卡比较,即得出被测液大致的PH。
3、测定以下物质的PH,认识它们的酸碱性,橘子汁、肥皂水、草木灰水、唾液。
现象:
1、 2、

分析及结论:
1、NaOH为强碱,氨水为弱碱,因此,同浓度的NaOH溶液的PH大于氨水。
2、PH<7 呈酸性 PH=7 呈中性 PH>7 呈碱性
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:粗盐的提纯
实验目的:
1、掌握粗盐提纯的方法。
2、了解混合物分离的概念。
实验器材:
天平、烧杯2个,玻璃棒、量筒、泥坑斗、铁架台、滤纸、酒精灯、蒸发皿、粗盐
实验步骤:
1、溶解:用天平称取粗盐5g,投入到10ml水的烧杯中,搅拌,称出剩余粗盐的质量。
2、过滤:过滤食盐水1~2次,直到滤液澄清。
3、蒸发:将滤液倒入蒸发皿中,加热,结晶。
4、计算产率。
现象:
1、搅拌,促进粗盐进中NaCl的溶解。
2、滤纸上有不溶的杂质。
3、加热时搅拌防液滴飞溅,待有较多NaCl出现时停止加热,用余热蒸干。
分析及结论:
1、

2、精盐产率=
化学科学生实验
班级 姓名 同组人 指导教师 白老师
日期: 实验题目:初步区分氮肥、磷肥、钾肥的方法的探究
实验目的:
探究氮肥、磷肥、钾肥的区别方法
实验器材:
烧杯、研钵、NH4HCO3、NH4Cl、磷矿粉、K2SO4、KCl
实验步骤:
1、比较NH4HCO3等5种化肥的外观,气味和在水中的溶解性。
2、在研钵中分别倒入少量的NH4Cl、K2SO4、KCl分别加入少量的熟石灰,混合,研磨,嗅气味。
现象:

分析及结论:
区别氮、磷、钾肥的方法
1、首先从外观、气味上区别。
2、然后从溶解性方面区别。
3、最后可通过化学方法如加碱的方法区别。
-
粗盐的提纯实验报告
粗盐提纯实验报告一、实验目的:1.掌握溶解、过滤、蒸发等实验的操作技能.2.理解过滤法分离混合物的化学原理.3.体会过滤的原理在生…
-
粗盐提纯实验报告
一实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理二实验原理粗盐中含有泥沙等不溶性杂质不溶性杂质可以用溶…
-
粗盐提纯实验报告
化学实验报告姓名班级日期实验名称粗盐中难溶性杂质的去除实验目的1学会除去粗盐中的少量难溶性杂质的方法2初步学会使用过滤蒸发的方法对…
-
粗盐的提纯_实验报告单
粗盐的提纯实验报告班级姓名一实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理二实验原理粗盐中含有泥沙等不…
-
粗盐提纯实验报告
粗盐提纯实验报告实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理3体会过滤的原理在生活生产等社会实际中的…
-
粗盐的提纯实验报告
粗盐提纯实验报告一、实验目的:1.掌握溶解、过滤、蒸发等实验的操作技能.2.理解过滤法分离混合物的化学原理.3.体会过滤的原理在生…
-
粗盐提纯实验报告
一实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理二实验原理粗盐中含有泥沙等不溶性杂质不溶性杂质可以用溶…
-
粗盐提纯实验报告单
化学实验报告班级姓名桌号日期年月日实验名称粗盐中难溶性杂质的去除一实验目的1体验固体混合物初步提纯的实验过程2学习蒸发操作技能巩固…
-
粗盐提纯实验报告
初中化学实验粗盐提纯练习过滤和蒸发操作班级姓名组员日期一实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理…
-
粗盐提纯实验报告
化学实验报告姓名班级日期实验名称粗盐中难溶性杂质的去除实验目的1学会除去粗盐中的少量难溶性杂质的方法2初步学会使用过滤蒸发的方法对…
-
粗盐提纯实验报告
实验一氯化钠的提纯一实验目的1学会化学方法提纯粗盐同时进一步精制成试剂级纯度的氯化钠提供原料2练习天平的使用以及加热溶解过滤蒸发和…