原子吸收光谱实验报告
原子吸收光谱定量分析实验报告
班级:环科10-1 姓名:王强 学号:2010012127
一、实验目的:
1.了解石墨炉原子吸收分光光度计的使用方法。
2.了解石墨炉原子吸收分光光度计进样方法及技术关键。
3. 学会以石墨炉原子吸收分光光度法进行元素定量分析的方法。
二、实验原理:
在原子吸收分光光度分析中,火焰原子吸收和石墨炉原子吸收是目前使用最多、应用范围最广的两种方法。相对而言,前者虽然具有振作简单、重现性好等优点而得到广泛应用,但该法由于雾化效率低、火焰的稀释作用降低了基态原子浓度、基态原子在火焰的原子化区停留时间短等因素限制了测定灵敏度的提高以及样品使用量大等方面的原因,对于来源困难、鹭或数量很少的试样及固态样品的直接分析,受到很大的限制。石墨炉原子化法由于很好地克服了上述不足,近年来得到迅速的发展。
石墨炉原子吸收方法是利用电能使石墨炉中的石墨管温度上升至2000 ~ 3000 ℃的高温,从而使待测试样完全蒸发、充分的原子化,并且基态原子在原子化区停留时间长,所以灵敏度要比火焰原子吸收方法高几个数量级。样品用量也少,仅5 ~ 100 uL。还能直接分析固体样品。该方法的缺点是干扰较多、精密度不如火焰法好、仪器较昂贵、操作较复杂等。
本实验采用标准曲线法,待测水样品用微量分液器注入,经过干燥、灰化、原子化等过程对样品中的痕量镉进行分析。
三、仪器和试剂:
1.仪器
由北京瑞利分析仪器公司生产的WFX-120型原子吸收分光光度计。
镉元素空心阴极灯
容量瓶 50 mL(5只) 微量分液器 0.5 ~ 2.5 mL及5 ~ 50 uL
2.试剂
100 ng/mL镉标准溶液(1%硝酸介质)
2 mol/L硝酸溶液
四、实验步骤:
1.测定条件
分析线波长:228.8 nm
灯电流:3 mA 狭缝宽度:0.2 nm
干燥温度、时间:100℃、15 s 灰化温度、时间:400℃、10 s
原子化温度、时间:2200℃、3 s 净化温度、时间:2200℃、2 s
保护气流量:100 mL/min
2.溶液的配制
取4只50 mL容量瓶,分别加入0 mL、0.125 mL、0.250 mL、0.500 mL浓度为100 ng/mL的镉标准溶液,再各添加2.5 mL硝酸溶液(2 mol/L),然后以Milli-Q去离子水稀释至刻度,摇匀,供原子吸收测定用。
取水样500 mL于烧杯中,加入5 mL浓硝酸溶液,加热浓缩后转移至50 mL容量瓶,以Milli-Q去离子水稀释至刻度,摇匀,此待测水样供原子吸收测定用。
3.吸光度的测定
设置好测定条件参数,待仪器稳定后,升温空烧石墨管,用微量分液器由稀到浓向石墨管中依次注入40 uL标准溶液及待测水样,测得各份溶液的吸光度。
五、数据记录:
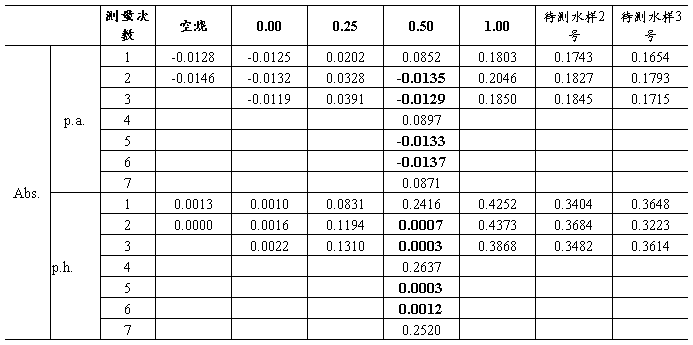
注:黑体字为失败实验数据
六、数据处理:
以面积法和高度法的吸光度分别绘制标准曲线,并由待测水样的相应吸光度值从标准曲线上查得待测水样中的镉浓度,并计算该水样的原始浓度。
(1)面积法:
首先计算得空烧平均值为:(-0.0128-0.0146)/2=0.0137

得面积曲线图:
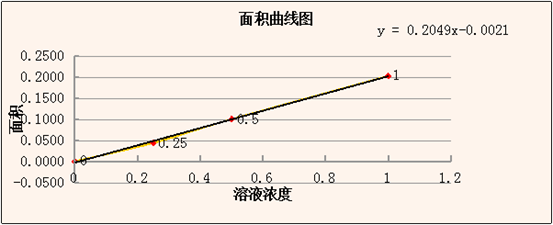
计算得2号水样平均面积为:(0.1743+0.1827+0.1854)/3-(-0.0137)=0.1945 根据曲线公式可得水样中镉元素浓度为:0.9595ng/mL
计算得3号水样平均面积为:(0.1654+0.1793+0.1715)/3-(-0.0137)=0.1858 根据曲线公式可得水样中镉元素浓度为:0.9170ng/mL
(2)高度法:
首先计算得空烧平均值为:(0.0013+0.0000)/2=0.0007

得曲线图:

计算得2号水样平均高度为:(0.3404+0.3684+0.3482)/3-(0.0007)=0.3516 根据曲线公式可得水样中镉元素浓度为:0.8131ng/mL
计算得3号水样平均高度为:(0.3648+0.3223+0.3614)/3-(0.0007)=0.3488 根据曲线公式可得水样中镉元素浓度为:0.8063ng/mL
七、思考题:
1.在实验中能Ar气的作用是什么?为什么有时候可以用N2替换Ar?
答:实验中Ar气的作用作为保护气体,防止石墨管氧化。因为N2同样是惰性气体,不与石墨反应,所以可以用N2替换Ar。
2.考察该测定条件下面积法和高度法的分析结果的差异,并试叙述分析结果的可能误差来源。
答:面积吸收与单位体积原子蒸汽中吸收辐射的原子成简单线性关系。这种关系与频率无关。但是由于原子吸收线的板宽度很小,要测量这样一条半宽度很小的吸收线的积分吸收值,就要需要有分辨率高达五十万的单色器,在目前的技术的情况下还难以做到。因此,面积法对仪器的精度的要求很高,所以,仪器的精度有可能不够,而导致分辨率低造成误差。而测量峰值吸收则对锐线光源的要求很高,只有当使用很窄的锐线光源时,测得的吸光度与原子吸收待测元素的基态原子数成线性关系。此外,还必须使通过原子蒸汽的发射线中心频率恰好与吸收线的中心频率重合。所以,光源的不准确这也能造成一定误差。
第二篇:原子吸收实验报告
原子吸收光谱法
原子吸收光谱法是基于含待测组分的原子蒸汽对自己光源辐射出来的待测元素的特征谱线(或光波)的吸收作用来进行定量分析的。由于原子吸收分光光度计中所用空心阴极灯的专属性很强,所以,原子吸收分光光度法的选择性高,干扰较少且易克服。而且在一定的实验条件下,原子蒸汽中的基态原子数比激发态原子数多的多,故测定的是大部分的基态原子,这就使得该法测定的灵敏度较高。由此可见,原子吸收分光光度法是特效性、准确性和灵敏度都很好的一种金属元素定量分析法。
一.实验目的
1.熟悉原子吸收光度计的基本构造及使用方法。
2.掌握原子吸收光谱仪中的石墨炉原子化法和火焰原子化法。
二.实验原理
原子光谱是由于其价电子在不同能级间发生跃迁而产生的。当原子受到外界能量的激发时,根据能量的不同,其价电子会跃迁到不同的能级上。电子从基态跃迁到能量最低的第一激发态时要吸收一定的能量,同时由于其不稳定,会在很短的时间内跃迁回基态,并以光波的形式辐射现同样的能量。根据△E=hυ可知,各种元素的原子结构及其外层电子排布的不同,则核外电子从基态受激发而跃迁到其第一激发态所需要的能量也不同,同样,再跃迁回基态时所发射的光波频率即元素的共振线也就不同,所以,这种共振线就是所谓的元素的特征谱线。加之从基态跃迁到第一激发态的直接跃迁最易发生,因此,对于大多数的元素来说,共振线就是元素的灵敏线。在原子吸收分析中,就是利用处于基态的待测原子蒸汽对从光源辐射的共振线的吸收来进行的。
三 火焰原子化器与石墨炉原子化器
原子化系统的作用是将待测试液中的元素转变成原子蒸汽。具体方法有火焰原子化法和无火焰原子化法两种,前者较为常用。
1.火焰原子化器
火焰原子化器由雾化器、混合室和燃烧器组成。
雾化器是关键部件,其作用是将试液雾化,使之形成直径为微米级的气溶胶。混合室的作用是使较大的气溶胶在室内凝聚为大的溶珠沿室壁流入泄液管排走,使进入火焰的气溶胶在混合室内充分混合均匀以减少它们进入火焰时对火焰的扰动,并让气溶胶在室内部分蒸发脱溶。燃烧器最常用的是单缝燃烧器,其作用是产生火焰,使进入火焰的气溶胶蒸发和原子化。因此,原子吸收分析的火焰应有足够高的温度,能有效地蒸发和分解试样,并使被测元素原子化。此外,火焰应该稳定、背景发射和噪声低、燃烧安全。
原子吸收测定中最常用的火焰是乙炔-空气火焰,。乙炔-空气火焰燃烧稳定,重现性好,噪声低,燃烧速度不是很大,温度足够高(约23000C),对大多数元素有足够的灵敏度。
2.管式石墨炉原子化器
管式石墨炉原子化器由加热电源、保护气控制系统和石墨管状炉组成。加热电源供给原子化器能量,电流通过石墨管产生高热高温,最高温度可达到3000℃。保护气控制系统是控制保护气的,仪器启动,保护气Ar流通,空烧完毕,切断Ar气流。外气路中的Ar气沿石墨管外壁流动,以保护石墨管不被烧蚀,内气路中Ar气从管两端流向管中心,由管中心孔流出,以有效地除去在干燥和灰化过程中产生的基体蒸气,同时保护已原子化了的原子不再被氧化。在原子化阶段,停止通气,以延长原子在吸收区内的平均停留时间,避免对原子蒸气的稀释。
石墨炉原子化器的操作分为干燥、灰化、原子化和净化四步,由电脑控制实行程序升温。
石墨炉原子化法的优点是,试样原子化是在惰性气体保护下于 强还原性介质内进行的,有利于氧化物分解和自由原子的生成。用样量小,样品利用率高,原子在吸收区内平均停留时间较长,绝对灵敏度高。液体和固体试样均可直接进样。缺点是试样组成不均匀性影响较大,有强的背景吸收,测定精密度不如火焰原子化法。
四 实验结果分析
1.标准曲线法
配制一组浓度由低到高、大小合适的标准溶液,依次在相同的实验条件下喷入火焰,然后测定各种浓度标准溶液的吸光度,以吸光度A为纵坐标,标准溶液浓度C为横坐标作图,则可得到A~C关系曲线(标准曲线)。在同一条件下,喷入试液,并测定其吸光度Ax值,以Ax在A~C曲线上查出相应的浓度Cx值。
2.标准加入法
在正常情况下,我们并不完全知道待测试液的确切组成,这样欲配制组成相似的标准溶液就很难进行。而采取标准加入法,可弥补这种不足。
取相同体积的试液两份,置于两个完全相同的容量瓶(A和B)中。另取一定量的标准溶液加入到B瓶中,将A和B均稀释到刻度后,分别测定它们的吸光度。若试液的待测组分浓度为Cx,标准溶液的浓度为C0,A液的吸光度为Ax,B液的吸光度为A0,则根据比耳定律有:
Ax =k·Cx
A0 =k (C0 + Cx )
所以 Cx = Ax·C0 (A0 - Ax)
实际工作中,多采用作图法。即:取若干份(至少四份)同体积试液,放入相同容积的容量瓶中,并从第二份开始依次按比例加入待测试液的标准溶液,最后稀释到同刻度。若原试液中待测元素的浓度为Cx,则加入标准溶液后的试液浓度依次为:Cx +C0、Cx +2C0、Cx +4C0 ……,相应地吸光度得:Ax、A1 、A2、A3……。以A对标准溶液的加入量作图,则得到一条直线,该直线并不通过原点,而是在纵轴上有一截距b,这个b值的大小反映了标准溶液加入量为零时溶液的吸光度,即:原待测试液中待测元素的存在所引起的光吸收效应。如果外推直线与横轴交于一点b’,则ob’= Cx。
-
化工原理实验报告吸收实验
广西大学实验报告姓名专业月实验内容吸收实验指导教师一实验名称吸收实验二实验目的1学习填料塔的操作2测定填料塔体积吸收系数KYa三实…
- 实验报告_吸收实验
-
吸收实验实验报告
广西大学实验报告姓名专业月实验内容吸收实验指导教师一实验名称吸收实验二实验目的1学习填料塔的操作2测定填料塔体积吸收系数KYa三实…
-
填料塔吸收实验报告
实验6填料吸收塔实验报告第四组成员王锋郑义刘平吴润杰一实验名称填料吸收塔实验二实验目的1了解填料吸收塔的构造并实际操作2了解填料塔…
-
吸收实验报告
吸收实验专业环境0901学号姓名一实验目的1了解填料吸收塔德基本构造吸收过程的基本流程及操作2掌握吸收总传质系数Kya的测定方法二…
-
实验31 原子发射光谱观测分析(实验报告)
实验31A原子发射光谱观测分析实验目的1学会使用光学多通道分析器的方法2通过对钠原子光谱的研究了解碱金属原子光谱的一般规律3加深对…
-
氢原子光谱实验报告
氢原子光谱摘要本实验用光栅光谱仪对氢原子光谱进行测量测得了氢原子光谱巴尔末线系的波长求出了里德伯常数最后对本实验进行了讨论关键词氢…
-
氢原子光谱实验报告_-_完成版
南京理工大学大学生物理实验研究论文氢原子光谱中文摘要本实验用三棱镜对汞原子光谱进行测量得出定标曲线再对氢原子光谱进行测量测得了氢原…
-
南京大学-氢原子光谱实验报告
氢原子光谱一实验目的1熟悉光栅光谱仪的性能和用法2用光栅光谱仪测量氢原子光谱巴尔末系数的波长求里德伯常数二实验原理氢原子光谱是最简…
-
氢、氘光谱实验报告
实验一A氢氘光谱实验目的要求1测定氢原子与氘原子的巴耳末系发射光谱的波长和氢原子与氘原子的里德伯常数2了解WGD8A型组合式多功能…
-
原子吸收光谱实验报告
原子吸收光谱实验报告一基本原理1原子吸收光谱的产生众所周知任何元素的原子都是由原子核和绕核运动的电子组成原子核外电子按其能量的高低…