分析化学实验报告
分析化学实验报告
20##-02-18 20:08:58| 分类: 理工类 | 标签: |字号大中小 订阅
盐酸和氢氧化钠标准溶液的配制和标定
时间:12月15号 指导老师:某某
—、实验目的
1. 熟练减量法称取固体物质的操作,训练滴定操作并学会正确判断滴定终点。
2. 掌握酸碱标准溶液的配制和标定方法。
3.通过实验进一步了解酸碱滴定的基本原理。
二.实验原理
有关反应式如下:
Na2CO3 + 2HCL == 2NaCL + CO2 + H2O
KHC8H4O4 + NaOH ==KNaC8H4O4 + H2O
三.实验步骤
1、 0.1.mol/L HCL溶液的配制
用小量筒量取浓盐酸42mL,倒入预先盛有适量水的试剂瓶中(于通风柜中进行),加水稀释至500mL,摇匀,贴上标签。
2、 0.1mol/L NaOH溶液的配制
用烧杯在台秤上称取2g固体NaOH,加入新鲜的或新煮沸除去CO2的冷蒸馏水,溶解完全后,转入带橡皮塞的试剂瓶中,加水稀释至500ml,充分摇匀,贴上标签。
3、 0.1 mol/L HCL标准溶液浓度的标定
用差减法准确称取 0.15 ~ 0.20 g无水Na2CO3 三份,分别置于三个250mL锥形瓶中,加20~30 ml蒸馏水使之溶解,再加入1~2滴甲基橙指示剂,用待标定的HCL溶液滴定至溶液由黄色恰变为橙色即为终点。平行标定三份,计算HCL溶液的浓度。
4、0.1mol/L NaOH标准溶液浓度的标定
(1) 用基准物邻苯二甲酸氢钾标定 在称量瓶中以差减法称取KHC8H4O4 0.4~0.5 g三份,分别置于三个250ml 锥形瓶中,加20~30ml蒸馏水,溶解。加入2~3 滴酚酞指示剂,用待标定的NaOH 溶液滴定至溶液由无色变为微红色并持续30s 不褪色,即为终点,平行标定三份,计算NaOH 溶液的浓度。
(2)与已标定好的盐酸溶液进行比较 用移液管移取25.00ml NaOH 溶液于洗净的锥形瓶中,加甲基橙指示剂1~2 滴,用HCL 溶液滴定至溶液刚好由黄色转变为橙色,即为终点。平行滴定3 次。要求测定的相对平均偏差在0.2%以内。
四.数据记录及数据处理

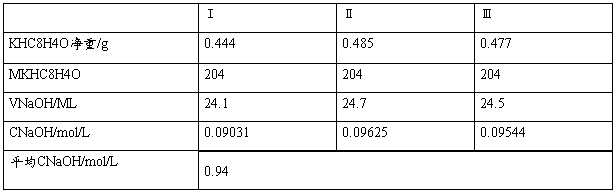
五.思考题
1. 滴定管、移液管至使用前为什么要用待装液润洗2~3 次?用于滴定的锥形瓶是否需要干燥?是否要用待装液荡洗?为什么?
答:避免滴定液被管内壁的蒸馏水稀释待装溶液,多次润洗实验数据更精确。不需要干燥,不用待装液荡洗,加入物品后还需用蒸馏水溶解,荡洗对待装液的物质的量并无影响。
2. 溶解基准物质Na2CO3使用蒸馏水的体积是否需要准确?为什么?
答:不需要,需要溶解蒸馏水的体积在20~30ml,在这之间均可,且计算时采用n=m/M,与C无关。
3、酚酞指示剂有五色变为为红色时,溶液的PH值为多少?变红的溶液在空气中放置后右边为无色的原因?
答:PH值为8.0~9.6;是因为吸收了空气中的CO2,PH值小于8.0,所以又变为无色了。
4、标定HCl的两种基准物质Na2CO3和Na2B4O7·10H2O各有什么优、缺点?
答:基准物质Na2CO3的缺点是易吸潮,使用前应干燥,保存于干燥容器中。
基准物质Na2B4O7·10H2O的优点是容易制的纯品,摩尔质量大,称量时相对误差小,不易吸水。缺点是空气中的相对温度小于39%时,易失去结晶水。
Na2S2O3标准溶液的配制和标定
时间12月16号 指导老师:某某
—、实验目的
1. 掌握Na2S2O3 的配制和贮存方法。
2. 学会用K2Cr2O7标定Na2S2O3浓度的原理和标定条件的控制。
3. 了解淀粉指示剂的作用及使用方法。
二、实验原理
Cr2O72- + I- +14H+ ==2Cr3+ + 3I2 + 7H2O
I2 + 2S2O32- == 2I- + S4O62-
根据滴定至终点时消耗的NA2S2O3溶液的量,计算其浓度,即根据:
Cr2O72- ∝ 3I2 ∝ 6S2O32-
CNa2CO3(mol/L) ==6CK2Cr2O7*VK2Cr2O7/VNa2S2O3
三、实验步骤
1、0.004167mol/L标准溶液的配制
称取优级纯K2Cr2O7固体0.1226g 置于烧杯中,用约25ml 蒸馏水溶解,定量转移至100ml 容量瓶中,用蒸馏水稀释至刻度,摇匀。
2、0.10mol/LNa2S2O3溶液的配制与标定
用台秤称取Na2S2O3·5H2O固体6.2g,溶于新沸并冷却的蒸馏水中,加入0.2gNa2CO3,用蒸馏水稀释至1000 ml,贮存于棕色瓶中。临用前稀释后再标定。
Na2CO3溶液的标定:将上面配制的溶液稀释10倍,置于碱式滴定管中,另在一250ml碘量瓶中,加入约1gKI和50 ml蒸馏水,加入10.00ml 0.004167mol/LK2r2O7标准溶液,再加入1 ml0.5(1+5)H2SO4盖好瓶塞置于暗处约5min,用待标的Na2CO3溶液滴定至淡黄色,再加入1ml0.5%淀粉指示剂,继续用N a2S2O3溶液滴定至蓝色刚好褪去,记下Na2S2O3所消耗的体积V(ml)。平行标定2~3次。
四、数据记录及数据处理
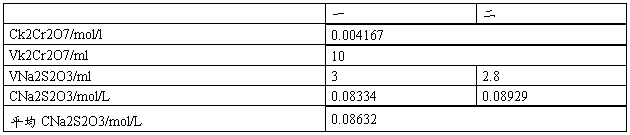
五、思考题
1、Na2S2O3为什么不能直接配制成标准溶液?
答:市售的易风化,并含有少量S,SO32- 等杂质。
2、Na2S2O3溶液久置后,为什么浓度易发生变化?配制时应采取何措施?
答:它能与水中的微生物、CO2、空气中的O2作用,此外蒸馏水中常存在着痕量的Cu2-和Fe3+等,也能促进Na2CO3溶液的分解。因此配制Na2CO3溶液时需要用新沸并冷却的蒸馏水溶解,并既然少量的Na2CO3使溶液呈碱性。
3、用K2Cr2O7作基准物质标定Na2S2O3的浓度时应注意什么?
答:应使K2Cr2O7在酸性溶液中。
混合碱中NaOH和 Na2CO3含量的测定(双指示剂)
时间:12月18号 指导老师:某某
一、实验目的
1、掌握双指示剂法测定混合碱各部分含量的原理和方法。
2、掌握在同一份溶液中用双指示剂法测定混合碱中NaOH和Na2CO3含量的操作技术。
二、实验原理
在混合碱中先加入酚酞试剂,用HCL标准溶液滴定至红色刚消失,记下消耗盐酸的体积V1,这时NaOH已全部被中和,而Na2CO3只被滴定到NaHCO3。在此溶液中再加甲基橙指示剂,继续HCL滴定止橙红色为终点,则生成的NaHCO3被进一步中和为CO2,记下用去盐酸的体积V2(V2是滴定碳酸氢钠所消耗的体积)根据V1和V2可以判断混合碱的组成。
三、实验步骤
1、分析迅速称取25.00ml上述溶液的制备
准确迅速的称取混合碱式样1.3~1.5 g于250ml锥形瓶中,加入少量无CO2的蒸馏水,搅拌使其完全溶解,定量转移至一洁净的250ml容量瓶中,用无CO2的蒸馏水稀释至刻度,充分摇匀。
2、测定
用移液管移取25.00ml上述试液于250ml容量瓶中,加2~3滴酚酞,以0.10 ml/LHCL标准溶液滴定至溶液由红色变为无水,为第一终点,记下用去HCL标准溶液的体积V1然后再加入1~2滴甲基橙指示剂于该溶液中,此时该溶液的颜色是黄色。继续用HCL标准溶液滴定至变为橙色,为第二终点,记下第二次用去HCL标准溶液的体积V2.平行测三次,根据V1和V2计算NaOH 和N a2CO3的含量。
四、实验数据记录及处理

结果计算:WNaOH == CHCL*(V1-V2)*MNaOH*100%/0.1m
WNa2CO3 == 2CHCL*V2MNa2CO3*100%/0.1m
五、思考题
1、什么叫混合碱?Na2CO3和NaHCO3的混合物能不能采用“双指示剂法”测定其含量?写出测定结果的计算公式。
答:混合碱是Na2CO3与 NaOH 或Na2CO3与NaHCO3的混合物;能;
WNa2CO3 == 2CHCL*V1MNa2CO3*100%/0.1m
W NaHCO3 == CHCL*(V2-V1)*M NaHCO3*100%/0.1m
2、采用双指示剂法测定混合碱,试判断下列五种情况下,混合碱的组成?
(1)V1=0,V2>0 (2)V1>0,V2=0 (3)V1>V2 (4)V1<V2 (5)V1=V2
答:(1) NaHCO3; (2)NaOH;(3) NaOH和Na2CO3 ;(4) Na2CO3 和NaHCO3 ;(5) Na2CO3 3、取等体积的同一烧碱试液两份,一份加酚酞指示剂,另一份加甲基橙指示剂,分别用HCL 标准溶液滴定,怎样确定NaOH和NaHCO3所消耗HCL标准溶液的体积?
答:溶液变为无色时是NaOH消耗HCl的标准溶液的体积;溶液变为黄色时是NaHCO3消耗HCl的标准溶液的体积。
水中溶解氧的测定
时间:12月22号 指导老师:某某
一、实验目的
1、 掌握碘量法测定水中溶解氧的原理和方法。
2、 学习水样采集、保存和水中溶解氧的固定等操作技术。
二、实验原理
有关反应式如下:
Mn2+ +2OH- == Mn(OH)2 (白色)
2Mn(OH)2 + 1/2O2 == 2Mn(OH)3 (棕色)
当溶解氧充足时:
Mn(OH)2 + 1/2O2 == 2Mn(OH)2 (棕色)
2Mn(OH)3 +2I- + 6H+ == 2Mn2+ + I2 + 6H2O
或 MnO(OH)2 + 2I -+ 4H+ == Mn2+ I2 + 3H2O
I2 + 2S2O32- == 2I- + S4O62-
根据滴定时消耗Na2S2O3溶液的量,计算出来水中溶解氧的量。即
根据上述反应式:DO(O2,mg/L) ==0.25CNa2S2O3VNa2S2O3*32*103/V水样
三、实验步骤
水样采集后,用虹吸法将水样转移到溶解氧瓶内,并使水样从瓶口流出10s左右,立即将移液管插入液面下,依次加入1mlMnSO4溶液和2ml碱性碘化钾溶液。盖好瓶塞(瓶内不得有气泡),颠倒混合15次,静置。待棕色絮状沉淀降到一半时,再颠倒几次。
分析时轻轻打开瓶塞,立即用刻度移液管插入液面下加4~45ml浓H2SO3,小心盖好瓶塞,颠倒混匀至沉淀全部溶解为止。若溶解不完全,可继续加入少量浓H2SO4,但此时不可溢出溶液。然后置于暗处5min,用移液管取100ml上述溶液,置于250ml锥形瓶中,立即用0.01mol/LNa2S2O3标准溶液滴定至淡黄色,再加入1ml0.5%淀粉溶液,继续用Na2S2O3标准溶液滴定至蓝色刚好褪去为终点。记下Na2S203标准溶液消耗的体积V(ml)。平行测定2~3次。
四、实验数据记录及处理

五、思考题
1、 在水样中加入MnSO4和碱性KI溶液后,溶液中沉淀的颜色深浅说明了什么?
答:沉淀深说明水样中溶解氧大。
2、 为什么将水样转入溶解氧瓶时,应把乳胶管插入瓶底并溢出水样约10s左右?为什么加入水样中的试剂均需插入液面以下进行。
答:这样在加入试剂时就不会把空气中的O2带入水样中,并让在加试剂时暴落在空气中的溶解了O2的水样溢出,以免影响实验结果。
KMnO4标准溶液的配制和标定
12月23 号 指导老师:某某
一、实验目的
1、 掌握KMnO4标准溶液的配制和贮存方法。
2、 学习用基准物质Na2C2O4标定KMnO4的原理和方法。
3、 了解KMnO4自身指示剂的特点和终点判断的方法。
二、实验原理
反应式如下:
2MnO4 - + 5C2O42- + 16H+ == 2Mn2+ + 10CO2 +8H2O
三、实验步骤
1、 CKMnO4=0.02mol/L KMnO4溶液的配制
称取KMnO4固体约1.6g 溶于500ml蒸馏水中,盖上表面皿,在电炉上加热至沸并保持微沸状态1h,冷却后,用微孔玻璃漏斗过滤。滤液贮存于棕色试剂瓶中。将溶液在室温下静置2~3d后过滤备用。
2、 用Na2C2O4标定KMnO4溶液
准确称取0.15~0.20g Na2C2O4基准物质3份,分别置于250m锥形瓶中,加热50ml蒸馏水使之溶解,加热10ml(1+3)K2SO4,在水浴上加热到75~85℃。趁热用KMnO4溶液滴定,开始慢滴,待溶液中产生了Mn2+后,滴定速度可加快,直到溶液呈粉红色并持续30s内不褪色为终点(滴定结束时溶液的温度不低于55℃)。
相对误差要求在0.2%以内。
计算:
CKMnO4(mol/L) == 0.4MNa2C2O4*1000/MNa2C2O4*VKMnO4
四、实验数据记录及处理
CKMnO4(mol/L) == 0.4*0.1892*1000/(134*22.8)
==0.0247
五、思考题
1、 KMnO4为什么不能直接配制成标准溶液?
答:KMnO4中一般含有少量的MnO2和其他杂质,蒸馏水中微量的还原性物质也会与KMnO4反应,MnO2、Mn2+的存在以及光、热、酸、碱等外界条件的变化均可促使KMnO4的分解。
2、 标定时Na2C2O4溶液的温度为什么不能太高也不能太低?
答:温度太高溶液要以H2C2O4分子的形式散发出去;温度太低C2O4 2-还原性不强,反应不完全。
3、 为什么用Na2C2O4标定KMnO4溶液时,滴定速度应“先慢后快”?
答:开始慢是让溶液中产生Mn2+,才能让反应顺利进行。
4、 滴定至终点后溶液成粉红色,为什么久置后红色又消失?
答:溶液中过量的KMnO4呈红色,空气中的O2把KMnO4氧化了,所以红色消失。
高锰酸盐指数的测定(酸性法)
12月23 号 指导老师:某某
一、实验目的
1、 初步学会水样的采集和保存方法。
2、 理解高锰酸盐指数与水体污染的关系。
3、 掌握用高锰酸钾法测定高锰酸盐指数的原理、方法及其条件的控制。
二、实验原理
有关反应式如下:
4MNO4- + 5C(待测有机物) + 12H+ == 4Mn2+ + 5CO2 + 6H2O
2MNO4- +5C2O42- + 16H+ ==2MN2+ + 10CO2 + 8H2O
三、实验步骤
1、 移取100.0ml均匀水样(如高锰酸盐指数>5mg/L时,可酌情少取,并用蒸馏水稀释至100ml)于250ml锥形瓶中。
2、 加入5ml(1+3)H2SO4溶液,均匀。
3、 加入10.00ml 0.002mol/LKMNO4溶液,摇匀,立即放入水浴中加热30min(从水浴重新沸腾起计时)。沸水液面应高于反应溶液的液面。或放在电炉上直火加热煮沸10min(从沸腾开始计时,加热前应加几颗玻璃珠以防暴沸时溶液溅出瓶口)。
4、 取下锥形瓶,趁热加入10.00ml 0.00500mol/l Na2C2O4 标准溶液,摇匀,立即用0.002 mol/l KMnO4 溶液滴定至溶液呈粉红色(30s不褪色),记录消耗的KMnO4溶液的体积,记作V1(ml)。
5、 KMnO4溶液浓度的标定。将上述已滴定完毕的溶液加热约70oC,再加入10.00 ml
0.00500mol/l Na2C2O4 标准溶液,,再加入0.002 mol/l KMnO4 溶液滴定至溶液呈粉红色
(30s不褪色),记录消耗KMnO4 溶液的体积,记作V2(ml),按下式求得KMnO4溶液的校正系数(K)。 K=10.00/V2
式中 v2------测定校正系数K时,消耗KMnO4溶液的体积,ml。
计算:
高锰酸盐指数(O2,mg/l)=[(10.00+V1)K—10.00]C*32.00*103/2V水样
式中 V1-----滴定水样时,消耗KMnO4溶液的体积,ml;
K------校正系数,即1ml KMnO4溶液相当于Na2C2O4标准溶液的体积,ml;
C----- Na2C2O4 标准溶液的物质的量浓度,mol/l;
32-----O2的摩尔质量,g/mol;
1/2-----由C〓2C2O42-,得nc=1/2n C2O42-。
四、思考题
1、 水样采集与保存应注意什么?
答:采取水样时应让自来水缓缓流入不要产生气泡,以免把空气中的氧气溶进水样,
保存水样时应用瓶盖盖劲。
2、 水样加入KMnO4溶液煮沸后,若紫红色完全退去说明什么?应采取什么措施?
答:水样中的O2氧化了溶液中的KMnO4,所以紫红色褪去。
3、 若水样中Cl-含量超过300mg/l,能否用该法测定?为什么?
答:不能;因为在强酸溶液中Cl-易被氧化而消耗KMnO4,是测定结果带来较大误差。
4、 测定高锰酸盐指数适应控制哪些条件?
答:必须在酸性溶液中进行;水样的Cl-的含量要小于300mg/l.;KMnO4溶液要过滤且保存在棕色瓶中。
EDTA标准溶液的配制和标定
12月25号 指导老师:某某
一、实验目的
1、 了解EDTA标准溶液的配制和标定原理。
2、 掌握常用的标定EDTA的方法。
3、 掌握配为滴定的原理,了解配位滴定的特点。
二、实验原理
EDTA常因吸附有约0.3%的水分和其中含少量杂质而不能直接配制标准溶液,通常先把EDTA配成所需的近似浓度,然后再用基准物质标定。
用于标定EDTA的基准物质有:含量不低于99.95%的某金属,如Cu 、Zn、Ni、Pb等,以及他们的金属氧化物,或某些盐类,如ZnSO4·7H2O、MnSO4·7H2O、CaCO3等。通常选用其中与被测组分相同的物质作基准物,在与测定相同条件下标定,可减少系统误差。
在选用纯金属作为标准物质时,应注意金属表面氧化膜的存在会带来标定时的误差。届时应将氧化膜用细砂纸擦去,或用稀酸把氧化膜溶掉,先用蒸馏水,再用乙醚或丙酮冲洗,于105oC的烘箱中烘干,冷却后,再称量。
三、实验步骤
1、 配制500ml 0.01mol/l EDTA溶液
用台秤称取1.9gEDTA二钠盐于200ml烧杯中,加水,温热溶解,冷却后,转入聚乙烯塑料瓶或硬质玻璃瓶中,稀释至500ml,摇匀。
2、 配制250 ml 0.01 mol/l钙标准溶液
用差减法准确称取0.25g基准CaCO3于小烧杯中,以少量水润湿,盖上表面皿,从烧杯嘴处往烧杯中滴加4mol/lHCl至CaCO3全部溶解(避免加入过量酸)。加水50ml,微沸几分钟赶走CO2,冷却至室温,用少量水冲洗表面皿和烧杯内壁,加入数滴甲基红指示剂溶液,逐滴加入3mol/l NH3·H2O至变为橙色,将溶液定量转入250ml容量瓶中,定容,摇匀,根据CaCO3的实际用量计算Ca+标准溶液的准确浓度。
3、 标定操作
移取25.00ml 上述钙标准溶液于锥形瓶中,加水25ml水,加入NH-NH4Cl缓冲溶液,鉻黑T指示剂干粉50~100mg,此时溶液呈紫红色,立即在不断振摇下用EDTA溶液滴定,开始滴定时速度宜较快,接近终点时应稍慢,并充分振荡,最好每滴间隔2~3s,溶液的颜色由紫红或紫色逐渐转为蓝色,刚出现天蓝色为终点。记录消耗EDTA溶液的体积。整个滴定过程在5min内完成,平行滴定3次。
四、实验数据记录及处理
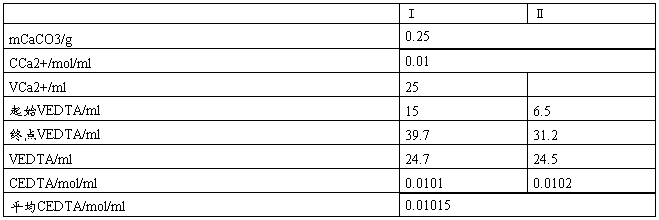
四、思考题
1、 配为滴定为什么要在缓冲溶液中进行?
答:配位反应进行得较慢,所以要在缓冲溶液中进行。
2、 鉻黑T指示剂适用的PH值范围是多少?
答:PH= 8 ~ 10
3、 在中和标准物质中的HCl时,能否用酚酞取代甲基红?为什么?
答:不能,因为该溶液呈酸性,酚酞的变色范围是碱性,甲基红的显色范围是酸性,所以不能用酚酞代替。
4、 阐述Mg2+-EDTA能够提高终点敏锐度的原理。
答:铬黑T与Mg2+能形成稳定的络合物,显色很灵敏,但与Ca2+形成的络合物不稳定,显色灵敏度低,为此在pH=10的溶液中用EDRA滴定Ca2+时,常于溶液中先加入少量MgY,使之发生置换反应,置换出Mg2+:
MgY+Ca2+ == CaY+Mg2+,
置换出的Mg2+与铬黑T显出很深的红色:
Mg2++EBT=Mg-EBT(红色)
但EDTA与Ca2+的络合能力比Mg2+强,滴定时,EDTA先与Ca2+络合,当达到终点时,EDTA夺取Mg-EBT中的Mg2+,形成MgY,
Y+Mg-EBT=MgY+EBT (蓝色)
游离出的指示剂显蓝色,变色很明显,在这里,滴定前的MgY与最后生成的MgY物质的量相等,故不影响滴定结果。
水中总硬度的测定
12月25号 指导老师:某某
一、 实验目的
1、 掌握配位滴定法测定水中硬度的原理和方法。
2、 掌握水中硬度的常用表示方法。
3、 掌握鉻黑T指示剂的使用条件.
二、实验原理
水的硬度是指水中除碱金属离子的浓度,由于Ca+、Mg2+含量远比其他金属离子为高,所以通常以水中Ca+、Mg2+总量表示水中的硬度。水中Ca+、Mg2+以酸式碳酸盐形式存在的称为暂时硬度,煮沸时即分解成碳酸盐沉淀而失去其硬度;若以硫酸盐、硝酸盐、氯化物形式存在的称为永久硬度。
水的硬度的测定一般采用EDTA滴定法测定。在PH≈10 的氨性缓冲溶液中,以鉻黑T为指示剂,用EDTA标准容易直接测定Ca2+、Mg2+总量,溶液由酒红色恰变为纯蓝色即为滴定终点。
滴定前 Mg2+ + Hin2- ←可逆反应→ MgIn- + H+
(酒红)
滴定 Ca2+ + HY3- ←可逆反应→CaY2- + H+
Mg2+ + HY3- ←可逆反应→ MgY2- + H+
终点 MgIn- + HY3- ←可逆反应→MgY2- + Hin2-
(酒红色) (纯蓝色)
三、实验步骤
移取100.0ml 自来水样于250ml 锥形瓶中,加4ml氨缓冲溶液(加一份,滴一份,即配一份做一次实验,不要都配好了再做试验),50~100mg指示剂干粉,应立即不断振摇(防止产生沉淀),用EDTA标准溶液滴定,近终点是应慢慢加入标准溶液,并充分摇动,至溶液由紫红色刚变为纯蓝色为终点,整个滴定过程应在5min内完成。记录消耗的EDTA的体积,平行滴定三次。计算水样的硬度。
四、实验数据记录及处理
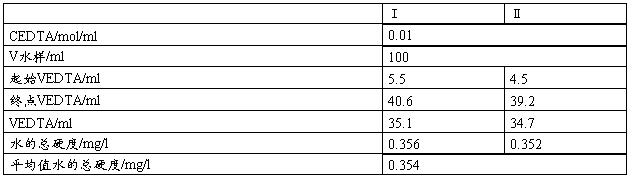
五、思考题
1、本实验所用的EDTA,应该采取何种指示剂标定?最适当的基准物质什么?
答:选用甲基红作指示剂;Na2S2O3为基准物质。
2、在测定水的硬度时,先于三个锥形瓶中加水样,再加NH3-NH4Cl 缓冲溶液,加···然后在一份一份地滴定,这样好不好?为什么?
答:不好,加了NH3-NH4Cl 缓冲溶液的试剂随着时间的推移会变质,影响实验结果。
-
分析化学实验报告
分析化学实验报告20xx0218200858分类理工类标签字号大中小订阅盐酸和氢氧化钠标准溶液的配制和标定时间12月15号指导老师…
-
分析化学实验报告(武汉大学第五版)
分析化学实验报告陈峻贵州大学矿业学院贵州花溪550025摘要熟悉电子天平的原理和使用规则同时可以学习电子天平的基本操作和常用称量方…
-
分析化学实验报告
级名分析化学实验报吉林农业大学告班姓同组人实验酸碱标准溶液的配制和比较滴定实验目的实验原理实验步骤1酸碱标准溶液的配制101mol…
-
分析化学实验报告样本
实验名称游标卡尺的使用实验目的1掌握游标卡尺的使用方法2了解游标卡尺的结构原理3学习数据处理的相关内容4养成良好的写实验报告的习惯…
-
分析化学实验报告
HarbinEngineeringUniversityHarbinEngineeringUniversity实验题目姓名班级学号同…
-
初三化学实验教学总结
九年义务教育化学课程标准中明确指出:“初中化学必须以观察试验为基础”。这就为化学教学规定了一种必要的也是不可忽略的教学手段,同时也…
-
初三化学实验现象全总结
一、氧化反应:2Mg+O2==点燃==2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2==点燃==SO2现象:空气中是…
-
初三化学实验教学工作总结
初三化学(下)实验教学工作总结----曾中化学组化学实验教学是化学教学中学生获得化学知识和检验化学知识的重要媒体和手段,能为学生形…
-
20xx-20xx化学实验室工作总结
20xx-20xx学年(上)化学实验室工作总结化学科学是一门实验科学,为学生创造良好的实验条件,帮助学生理解概念,帮助学生,培养学…
-
化学实验室工作总结总结
20xx~20xx(下)惠安嘉惠中学化学实验室工作总结在学校领导的帮助、同事们的关心、配合下,化学实验室的管理工作取得了一些成绩。…
-
化学探究实验报告2
化学探究实验报告(实验B)实验名称:白醋中的鸡蛋实验目的:探究鸡蛋泡在白醋中所发生的化学变化实验过程:1,将一枚鸡蛋放入一只干净的…