乙醇的蒸馏及沸点测定 实验报告


.

报告题目:乙醇的蒸馏及沸点测定
专业班级:生物工程
指导老师:刘明星
学生姓名:何德维
学 号:1108110384
20##年3月30日
乙醇的蒸馏及沸点测定
一.实验目的
1、了解用蒸馏法分离和纯化物质及测定化合物沸点的原理与方法。
2、训练蒸馏装置的安装与操作方法,要求整齐、正确。
3、掌握常量法和微量法测定沸点的原理和方法、蒸馏与沸点测定的原理。
二.实验原理
蒸馏是分离和提纯液体有机物质的最常用方法之一
液体加热时蒸汽压就随着温度升高而加大,当液体的蒸汽压增大到与外压相等时,会有大量气泡从液体内逸出,液体沸腾。这时的温度称为液体的沸点。
蒸馏是将液体加热到沸腾,使液体变为蒸汽,然后使蒸汽冷却再凝结为液体这两个过程的联合操作。因为组成液体混合物的各组分的沸点不同,当加热时,低沸点物质就易挥发,变成气态,高沸点物质不易挥发汽化,而留在液体内,这样,我们就能把沸点差别较大(至少30℃以上)的两种以上混合液体分开,以达到纯化的目的。同时,利用蒸馏法,可以测定液体有机物的纯度,每一种纯的液体有机物质,在平常状况下,都有恒定的沸点(恒沸混合物除外),而且恒定温度间隙小(纯粹液体的沸程一般不超过1-2℃);当有杂质存在,则沸点会有变化(有时升高,有时降低,根据杂质温度高低二变化),而且沸点的范围也会加大。
沸点相近的有机物,蒸汽压也近于相等。因此,不能用蒸馏法分离,可用分馏法分离;对于沸点高、受热易分解的物质,可用减压蒸馏或水蒸气蒸馏来分离提纯。
三.主要药品及仪器
1.工业酒精(滴几滴红汞或其他有色物)20ml(蒸馏用)
2.烧瓶(50ml) 蒸馏头 温度计(100℃) 冷凝管 接引管 三角瓶
3.铁夹 铁环 酒精灯 沸石 量筒(50ml) 铁台
四.实验步骤
1、清洗所有蒸馏装置,并用量筒量取20ml工业酒精装入烧瓶中,再放入2-3颗沸石。
2、安装蒸馏装置。首先将所需要的蒸馏装置均准备齐全(如上仪器),先从热源(酒精灯)处开始,然后“由下而上,由左到右”。在一铁架台上,依次由下往上安放热源、石棉网、烧杯(内盛放大半杯的自来水)、烧瓶(内盛放20ml的工业酒精,再加入2-3颗沸石)以及温度计;再从左到右接上冷凝管,用另一个铁架台将冷凝管中间夹住以固定,再接上接引管,将接引管通入锥形瓶中,在冷凝管上接上两根胶管,下端接到水源上,上端放入水槽中。整个装置要求准确端正,无论从正面还是侧面观察,全套仪器中各个仪器的轴线都要在同一水平面内;所有的铁夹和铁架都应尽可能整齐地放在仪器的背部。
3、开始试验。首先用打火机点燃酒精灯,调整铁台的高度,用酒精灯的外焰给烧杯加热,直到通过水浴加热使烧瓶中的酒精开始沸腾并有液体馏出,开始调整酒精灯的高度,使液体馏出速度为每秒钟1-2滴为宜,当速度趋于平衡时,用计时器开始计时,此时,并重新换一个锥形瓶来接收馏出液体,并记录下此时的温度。通过观察锥形瓶中馏出液体的体积,当差不多达到有2ml时,再换上另一个锥形瓶收集,并记录下此时的时间以及蒸馏气体的温度,用量筒量出换下来的馏出液体的体积并记录。就这样反复收集记录,待到烧瓶中的工业酒精差不多蒸馏完全,灭掉酒精灯,停止实验。
4、将所用的蒸馏仪器拆下来,用水洗干净,放会之前去的地方,注意别将玻璃仪器弄坏。再将实验桌面打理干净。
五.数据记录及其处理
乙醇的蒸馏数据记录

图一:

图二:
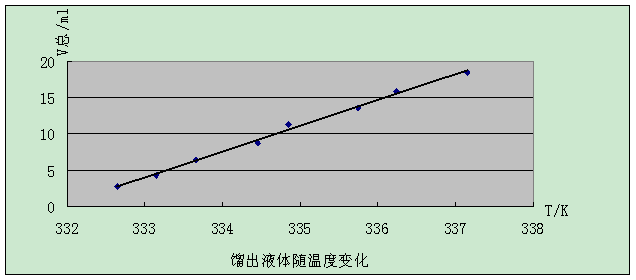
六.实验结果
由上表可以知道:V总=18.5ml
所以其回收率为:u= (V总/20)╳100%
代入数据得 u=(18.5/20) ╳100%=92.5%
七.问题讨论
1.常量法蒸馏与微量法测沸点个适用于那些情况?在高原地区蒸馏时,对沸点是否有影响?偏低还是偏高?
答:微量法一般用于现场监控,对数据准确度要求不高,但是可以监控数据的变化,当提供的液体不足以作沸点的常规测定时一般用微量法。常量法一般用于液体足够时的一般测量。在高原地区沸点会受一定影响,使沸点偏低。
2.为什么蒸馏时要加沸石?若加热时发现未加沸石,为什么一定要冷却后才能补加?
答:加沸石防止暴沸,如果不冷却就加入沸石,会引起严重的暴沸,部分液体会冲出瓶外,如是易燃物,可能引起火灾。
3.如果液体有一恒定沸点,能否认为是纯物质?液体中含有水分,一般引起沸点上升还是下降?
答:不能。一些混合物也有恒定的沸点,比如一些盐的水溶液,乙醇水溶液等。液体中含有水分,其沸点一般会下降。根据道尔顿分压定律,当不溶于水的有机物与水混合在一起时,整个体系的蒸汽压P=PH2O+P,此时混合物各组分的总压大于和等于外界大气压,混合物开始沸腾,这时的温度必小于任一组分的沸点。
第二篇:常压蒸馏及沸点测定
实验二 常压蒸馏及沸点的测定(有机化学实验第二课时教学简案)
授课班级:医学部各专业
授课时间:根据课表安排
授课地点:701-1245等
授课教材:虞虹/薛明强主编《基础化学实验》
授课学分:三分
授课教师:见具体安排
【教学课题】实验二 常压蒸馏及沸点的测定
【教学目标】了解常压蒸馏及沸点测定的原理及意义;掌握常量法(即蒸馏法)和微量法测定沸点的操作方法;掌握利用常压蒸馏来分离和提纯液体有机化合物的操作技术。
【教学重点】常压蒸馏及沸点测定的原理、操作方法
【教学难点】沸程、前馏分等概念,实验装置,常压蒸馏、微量法测沸点的基本操作以及适用范围
【教学方法】讲述、示范、讨论相结合
【教学过程】
【引言】把液体加热变为蒸气,再使蒸气冷凝变成液体,这两个过程的联合操作叫蒸馏,蒸馏广泛应用于分离和纯化液体有机化合物、测定化合物沸点并鉴定其纯度。
【讲述】 实验二 常压蒸馏及沸点的测定
一、实验目的(略,见教学目标)
二、实验原理
当液态物质受热时,由于分子运动使其从液体表面逃逸出来,形成蒸气压。随着温度升高,蒸气压增大,当蒸气压与大气压(或所给压力)相等时,液体沸腾,此时的温度称为该液体的沸点。纯液态有机化合物在一定压力下具有固定沸点,其第一滴馏出液开始至蒸发完全时的温度范围叫沸点距也叫沸程。纯液态有机化合物沸点距很小(0.5~1.0℃),混合物则没有固定沸点,沸点距也较长,故可通过蒸馏来测定液体的沸点和鉴别有机物纯度。具有固定沸点的液体不一定都是纯净物,共沸混合物也具有固定沸点。如:95.6﹪乙醇和4.4﹪水的沸点是78.2℃。
蒸馏沸点差别较大(30℃ 以上)的混合液体时,沸点较低的先蒸出,较高的随后蒸出,不挥发的留在蒸馏器内,可达到分离和提纯目的;当混合物沸点比较接近(小于30℃)时,用常压蒸馏则不能有效地进行分离和提纯,应改用分馏。
用蒸馏法测定沸点的方法叫常量法,此法用量较大,要10 mL以上,若样品不多时,可采用微量法,但微量法只适用于测定纯液体的沸点。
本实验用常量法测定工业乙醇的沸点,用微量法测定丙酮的沸点。
三、实验步骤
分别用常量法和微量法测定工业乙醇和丙酮的沸点,并与文献数据比较。
四、注意事项
(一)常量法
1、装置正确,注意整个装置要与大气相通。
2、加热前要添加费石,若遗忘必须待温度下降一定程度后才可添加。
3、必须先通冷凝水再水浴加热,注意观察前馏分及温度变化。
4、控制蒸馏速度,以每秒1~2滴为宜。
5、不可完全蒸干;先停止加热再停止通入冷凝水。
(二)微量法
1、注意装样量及试样与温度计水银端的位置。
2、空气尽量要赶尽。
3、注意控制加热速度。
4、气泡逸出过程要仔细观察。
5、重复测定必须置换毛细管,且需待温度下降一定程度以后。
【演示】 常量法蒸馏装置、微量法沸点测定装置的装配演示。
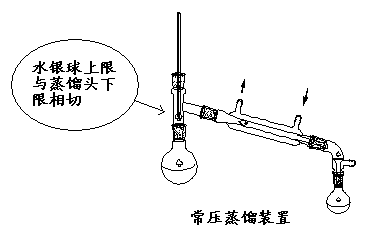
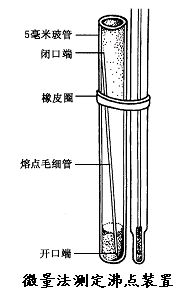
【讨论】如有以下情况,沸点测定结果将会如何?
1、常压蒸馏时加热过猛,蒸出速度太快。
2、常压蒸馏时温度计水银球上端位于蒸馏头侧管下线的水平线以上或以下。
3、微量测定时毛细管内空气未赶尽。
4、微量测定时毛细管上端未封口。
-
常压蒸馏及沸点测定实验
新乡医学院医用化学实验课教案首页授课教师姓名及职称新乡医学院化学教研室年月日实验常压蒸馏及沸点测定一实验目的1了解沸点测定的原理及…
-
乙醇的蒸馏及沸点测定 实验报告
报告题目:乙醇的蒸馏及沸点测定实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:***学生姓名:**学号:**20…
-
有机化学实验-----蒸馏及沸点的测定技术
实验报告姓名班级同组人项目蒸馏及沸点的测定技术课程学号一实验目的1了解蒸馏和沸点测定的基本原理和意义2掌握蒸馏和沸点测定的操作技术…
-
实验二:乙醇的蒸馏及沸点的测定
实验二乙醇的蒸馏及沸点的测定一实验目的1了解蒸馏提纯液体有机物的原理用途2掌握蒸馏提纯液体有机物的操作步骤3了解沸点测定的方法4了…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工133班王腾飞学号134020xx330…
-
实验二 液体饱和蒸气压的测定实验报告
实验二液体饱和蒸气压的测定MeasurementofSaturatedVaporPressure王暮寒PB1020xx67中国科学…
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
-
液体饱和蒸汽压的测定-实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
实验二实验报告
液体饱和蒸汽压的测定摘要本实验中通过对液体饱和蒸气压与温度的关系的研究根据克拉贝隆克劳修斯方程的简化建立起来的经验方程式求出液体的…
-
液体饱和蒸汽压的测定实验报告
液体饱和蒸汽压的测定一实验目的1明确液体饱和蒸汽压的意义熟悉纯液体的饱和蒸汽压与温度的关系以及克劳休斯克拉贝农方程2了解静态法测定…
-
有机化学实验-----蒸馏及沸点的测定技术
实验报告姓名班级同组人项目蒸馏及沸点的测定技术课程学号一实验目的1了解蒸馏和沸点测定的基本原理和意义2掌握蒸馏和沸点测定的操作技术…