熔点.沸点的测定实验报告
有 机 化 学 实 验 报 告

实 验 学 专 班 姓 指 导日 名 称: 院: 业: 级: 名:教 师: 期:
熔点的测定、沸点的测定 化学工程与工艺 化工10-1班 郭了了 学 号 10402010114 房椒华、沈梁钧 20xx年10月13日
一、 实验目的
1、 了解熔点和沸点的意义和应用
2、 掌握熔点沸点测定的操作方法
二、 实验原理
1.每一个晶体有机物都是具有一定的熔点,利用测定熔点,可以估计出有机化合物的纯度;
2.纯净有机物都有一定沸点,利用沸点可以估计出有机物的纯度;
三、 主要试剂及物理性质
尿素、苯甲酸、未知溶液;丙酮、乙醇、未知溶液;
几个概念:1.始熔:样品开始融化
2.熔距:开始熔化至完全熔化的温度范围,也叫熔点范围,熔距:一般不超过0.5℃
3.全熔固体样品消失成为透明液体时
四、 仪器装置

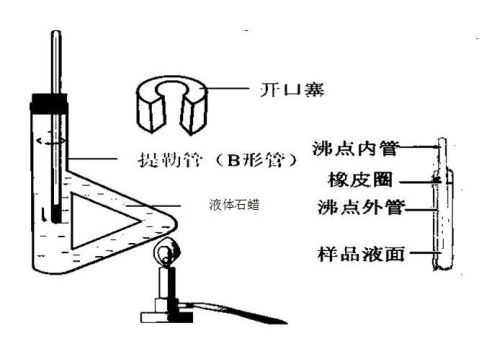
沸点测定装置图
五、 实验步骤及现象
1.装样2.加热3.记录
加热:开始快,低于熔点15℃时慢,1~2℃/分,快到熔点时0.2~0.3℃/分 记录 始熔 :113℃ 全熔:113.5℃
如某化合物 112℃开始萎缩塌落;113℃度时有液滴生成;113.5℃时全部成为透明体
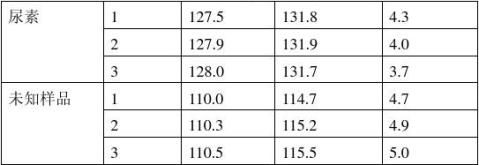
1个样品重复测3次,样品两个已知,一个未知
六、关键点:1.样品结实2.加热快慢
沸点步骤:1.装样0.50cm左右
2.加热先快后慢
3.当有连续气泡时停止加热,冷却
4.记录,当最后一个气泡冒出而缩回时为沸点
关键:不要加热太快,防止液体沸腾蒸发干
七、实验结果
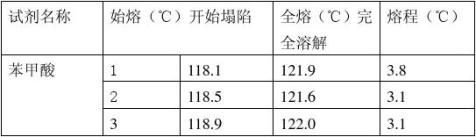
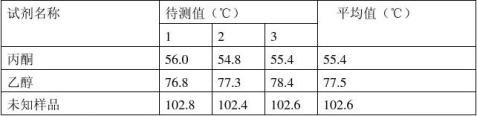
表2沸点测定数据记录表 最后一个气泡冒出而缩回为沸点
八、实验讨论
注意事项:①温度计不能用水冲洗,防爆裂 ②第二次测定时,温度略下降(30℃) ③不要烫手 ④b形管不要洗 ⑤200℃温度计
实验前未进行温度计校正,误差较大
第二篇:空气中二氧化硫的测定实验报告
实验十三 空气中二氧化硫含量的测定
(甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法)
一、概述
二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性气体,沸点-10℃;熔点-76.1℃;对空气的相对密度2.26。极易溶于水,在0℃时,1L水可溶解79.8L,20℃溶解39.4L。也溶于乙醇和乙醚。二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。
二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在0.9mg/m3或大于此浓度就能被大多数人嗅觉到。吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。
二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。它主要来源于以煤或石油为燃料的工厂企业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。
测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。
二、实验目的
1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。
2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。
三、实验原理
1.二氧化硫的基本性质
二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性的气体,沸点为-10℃,熔点为-76.6℃,对空气的相对密度为2.26。极易溶于水,在0℃时,1L水可溶解79.8L SO2,20℃溶解39.4L SO2,也溶于乙醇和乙醚。SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。
2.盐酸副玫瑰苯酚分光光度法
测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。为避免汞的污染,近年来用甲醛溶液代替汞盐作吸收液。
SO2被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,与盐酸副玫瑰苯胺作用,生成紫红色化合物,用风光光度计在570mm处进行测定。
测定范围为10mL样本溶液中含0.3—20μg SO2。若采样体积为20L,则可测浓度范围为0.015—1.000mg/m3。
3.方法特点
加入氨磺酸钠溶液可消除氮氧化物的干扰,采样后放置一段时间可使臭氧自行分解,加入磷酸和乙二胺四乙酸二钠盐,可以消除或减小某些重金属的干扰;
空气中一般浓度水平的某些重金属和臭氧、氮氧化物不干扰本法测定;
本方法克服了四氯汞盐吸收=盐酸副玫瑰苯酚风光光度法对显色温度的严格要求,适宜的显色温度范围较宽,为15—25℃,可根据室温加以选择。但样品应与标准曲线在同一温度、时间条件下显示测定;
本方法也克服了汞的污染。
四、实验试剂
(一)吸收液储备液(甲醛——邻苯二甲酸氢钾):称取2.04g邻苯二甲酸氢钾和0.364g乙二胺四乙酸二钠(EDTA—2Na)溶于水中,加入5.5ml 3.7g/L甲醛溶液,用水稀释至1000ml,混匀。(本试剂由实验室准备)
(二)吸收液使用液:吸取吸收液储备液25ml于250ml容量瓶中,用水稀释至刻度。(学生完成)
(三)氢氧化钠溶液CNaOH=2mol/L:称取4gNaOH溶于50ml水中。(本试剂由实验室准备)
(四)氨基磺酸0.6g/100ml:称取0.3g氨基磺酸,溶解于50ml水中,并加入1.5ml 2mol/L NaOH溶液pH=5。(本试剂由实验室准备)
(五)盐酸副玫瑰溶液0.025g/100ml。(本试剂由实验室准备)
(六)碘溶液(1/2 I2=0.10mol/L):称取1.27g碘于烧杯中,加入4.0g碘化钾和少量水,搅拌至完全溶解,用水稀释至100ml,储存于棕色瓶中。(本试剂由实验室准备)
(七)淀粉溶液(0.5g/100ml):称取0.5g可溶性淀粉,用少量水调成糊状,慢慢倒入100ml沸水中,继续煮沸至溶液澄清,冷却后存于试剂瓶中,临用现配。(本试剂由实验室准备)
(八)硫代硫酸钠标准溶液(CNa2S2O3=0.1mol/L)。(本试剂由实验室准备)
(九)二氧化硫标准储备溶液:称取0.1g亚硫酸钠(Na2SO3)及0.01g乙二胺四乙酸二钠盐(EDTA—2Na)溶于100ml新煮沸并冷却的水中,此溶液每ml含有相当于(320~400)μg二氧化硫。溶液需放置(2~3)小时后标定其准确浓度。
标定方法:吸取20.00ml二氧化硫标准储备溶液,置于250ml碘量瓶中,加入50ml新煮沸但已冷却的水,20.00ml碘溶液(1/2 I2=0.10mol/L)及1ml冰乙酸,盖塞,摇匀。于暗处放置5min后,用0.1mol/L硫代硫酸钠标准溶液滴定至浅黄色,加入2ml 0.5g/100ml淀粉溶液,继续滴定至蓝色刚好褪去为终点。记录滴定所用硫代硫酸钠标准溶液的体积V,另取水20ml进行空白试验,记录空白滴定硫代硫酸钠的体积V0 。按下式计算二氧化硫标准储备溶液的浓度:
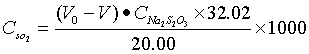
(学生完成)
(十)二氧化硫标准使用液:吸取二氧化硫标准储备液Xml [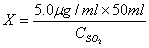 ]于50ml容量瓶中,用吸收液使用液定容至刻度。(学生完成)
]于50ml容量瓶中,用吸收液使用液定容至刻度。(学生完成)
五、测定步骤
(一) 采样
用一个内装8mL采样吸收液的多孔玻板吸收管,以0.5L/分钟的流量,采样40分钟。同时,测定气温、气压。据此计算出相当于标准状态下的采样体积V0。
附:体积换算
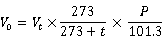
式中,V0为相当于标准状态下的样品体积(L);Vt为现场采样的体积(L);t为采样时的气温(℃);P为采样时的气压(kPa)。
(二) 标准曲线的绘制
吸取SO2标准使用液0.00、0.25、0.50、1.00、2.00、4.00mL与10mL比色管中,用吸收使用液定容至10mL刻度处,分别加入0.5mL0.6g/100mL氨基磺酸钠溶液,0.5mL2.0mol/LNaOH溶液,充分混匀后,再加入2.5mL0.025g/100mL盐酸副玫瑰苯胺溶液,立即混匀。等待显色(可放入恒温水浴中显色)。参照表1选择显色条件:
表1 显色温度与显色时间对应表
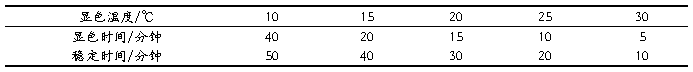
根据实验室室温条件,选择20℃对应显色条件进行操作。
依据显色条件,用10mm比色皿,以吸收液作参比,在波长570nm处,测定各管吸光度。以SO2含量(μg)为横坐标,吸光度为纵坐标,绘制标准曲线。
(三) 样品测定
采样后,样品溶液转入10mL比色管中,用少量(<1mL)吸收液洗涤吸收管内容物,合并到样品溶液中,并用吸收液定容至10mL刻度处。按上述绘制标准曲线的操作步骤,测定吸光度。将测得的吸光度值标在标准曲线上,通过查取或计算,得到样品中SO2的量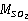 (μg)。
(μg)。
六、注意事项
(一)加入氨磺酸钠溶液可消除氮氧化物的干扰,采样后放置一段时间可使臭氧自行分解,加入磷酸和乙二胺四乙酸二钠盐,可以消除或减小某些重金属的干扰。
(二)空气中一般浓度水平的某些重金属和臭氧、氮氧化物不干扰本法测定。当10ml样品溶液中含有1μg Mn2+或0.3μg以上Cr6+时,对本方法测定有负干扰。加入环己二胺四乙酸二钠(简称CDTA)可消除0.2mg/L浓度的Mn2+的干扰;增大本方法中的加碱量(如加2.0mol/L的氢氧化钠溶液1.5ml)可消除0.1mg/L浓度的Cr6+的干扰。
(三)二氧化硫在吸收液中的稳定性:本法所用吸收液在40℃气温下,放置3天,损失率为1%,37℃下3天损失率为0.5%。
(四)本方法克服了四氯汞盐吸收-盐酸副玫瑰苯胺分光光度法对显色温度的严格要求,适宜的显色温度范围较宽(15~25)℃,可根据室温加以选择。但样品应与标准曲线在同一温度、时间条件下显色测定。
七、实验数据记录及处理
(一) SO2标准储备液浓度的测定
根据上述对SO2标准储备液浓度进行标定,标定结果如下:
表2 SO2标准储备液标定数据

将两组数据分别代入计算公式可得:

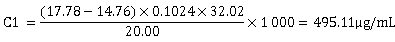
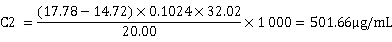
求平均值可得: 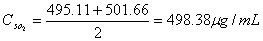
(二) SO2标准使用液使用量计算
根据上述计算结果,可以计算:
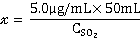
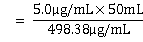
= 0.50mL
因此,SO2标准使用液的使用量应为0.50mL。
(三) 采样体积换算
根据实验当天气温、气压条件:t = 20℃,P = 101.8kPa
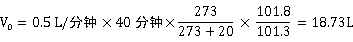
(四) 标准曲线绘制
不同浓度的SO2标准使用液吸光度测定结果见表3:
表3 不同含量的SO2标准使用液吸光度测定结果
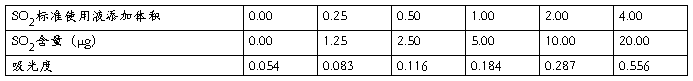
换算公式: M = 5.0μg/mL × L;
其中:M——SO2含量(μg);
L——SO2标准使用液添加体积。
以SO2含量(μg)为横坐标,吸光度为纵坐标,绘制标准曲线:
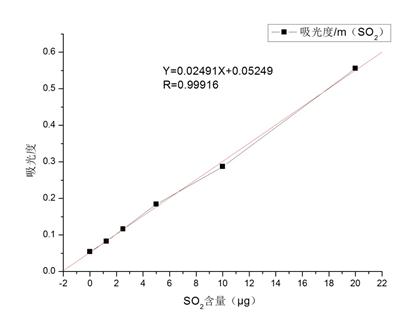
采用origin软件进行线性拟合得:
Y = A + B * X
Parameter Value Error
------------------------------------------------------------
A 0.05249 0.0048
B 0.02491 5.09761E-4
------------------------------------------------------------
R SD N P
------------------------------------------------------------
0.99916 0.00857 6 <0.0001
------------------------------------------------------------
得到标准方程:Y=0.02491X+0.05249;
R=0.99916,表明吸光度与SO2含量为正比关系,符合实际。
(五) 实验结果计算
样品经处理后,测得的吸光度为0.075。
根据标准曲线的方程,可计算出样品中SO2的量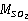 (μg):
(μg):
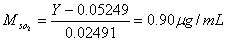
因此空气中的SO2含量为:
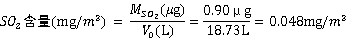
八、实验结果分析
(一) 数据有效性分析
1.本次实验滴定SO2标准储备液时,相对平均偏差为0.13%,测定结果可靠;
2.标准曲线方程R2值为0.99916,表明方程符合线性规律,方程可靠;
3.实验最终计算得样品中SO2含量为0.90g,符合本方法中“测定范围为10mL样本溶液中含0.3—20μg SO2”的要求,因此选用该实验方法是可靠的;
4.此外,本次实验操作较为规范,计算较为严谨。因此可以认为,本次实验的数据有效性高,结果准确、可靠。
(二) 结果分析与评价
根据《环境空气质量标准》(GB 3095-2012)的基本规定以及《广州市环境空气质量功能区区划》(穗府﹝1999﹞23号)的精神,中山大学东校区应当属于大气环境质量一类功能区,执行《环境空气质量标准》(GB 3095-2012)的一级标准。相关标准数据如表4:
表4 SO2浓度限值标准(μg/m3)

本次实验受客观条件的限制,以1次采样分析结果模拟小时均值。实验结果得出监测点所在区域SO2浓度为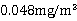 (48μg/m3),达到上述标准要求,距离标准限值还有102μg/m3,可认为该浓度符合环境空气质量标准的一级标准,监测点附近空气受SO2污染较小。
(48μg/m3),达到上述标准要求,距离标准限值还有102μg/m3,可认为该浓度符合环境空气质量标准的一级标准,监测点附近空气受SO2污染较小。
九、相关讨论
1.空气中二氧化硫测定方法的对比分析
对目前实验中最常用的两种测量空气中二氧化硫浓度的方法——四氯汞钾-盐酸副玫瑰苯胺分光光度法和甲醛缓冲液-盐酸副玫瑰苯胺分光光度法——进行分析比较。
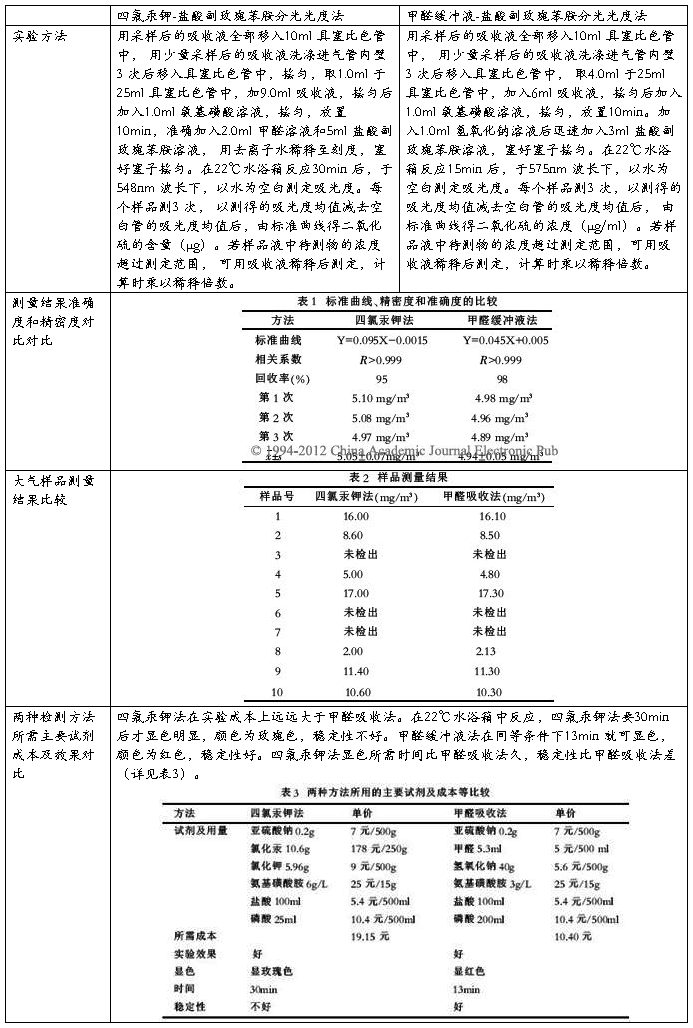
对比结论:两种方法检出结果差异无统计学意义,准确度及精确度等方面结果相近。从试剂毒副作用、环境保护、实验消耗成本等方面来看,甲醛缓冲液-盐酸副玫瑰苯胺分光光度法优于四氯汞钾-盐酸副玫瑰苯胺分光光度法。
2.空气中二氧化硫测定实验条件的优化。
① 选择适宜的测定条件, 减少实验误差, 保证实验结果的准确性
甲醛缓冲溶液吸收—盐酸副玫瑰苯胺分光光度法”测定空气中的二氧化硫时,对实验条件中的显色温度与显色时间要控制得很严格, 否则测定将出现严重偏差。总结出一套用“ 甲醛法”测定二氧化硫时的显色温度、显色时间控制方法。
选定与室温相接近的控制温度(一般选定巧-25 ℃ ), 利用水浴准确控制显色温度将样品按三个一组分为若干分析测定单元, 每个分析单元之间控制显色反应的时间间隔为5 m in( 间隔时间可视样品个数不同而延长或缩短, 也可根据学生的操作熟练程度而定) ,从而保证每个样品(样品单元)能在规定的时间内显色同样的时间后被测定完毕, 也就保证了样品分析条件的一致性, 使结果准确, 可比性增强。如果超过显色的稳定时间, 测定结果将偏低。由于温度和显色时间对测定样品影响很大, 因此绘制校准曲线应与样品测定同时进行, 以消除因显色温度和时间不同而产生的误差, 同时必须作空白试验。
② 合理改进实验器皿, 降低操作难度, 提高教学效率
将“ A 管” 所用的比色管改为相同体积大小的试管, 经过多次尝试后, 发现实验精度和准确性不受任何影响, 而且操作过程较以前简单, 学生更容易掌握。因试管中内壁光滑,不滞留溶液, 故“ 倾倒” 过程要求较松, 不需“ 空干片刻” 缩短了操作时间, 降低了操作难度, 也更能保证实验结果的准确度和精密度, 大大提高教学效率。
十、实验结论
1.本次实验采用甲醛溶液吸收——盐酸副玫瑰苯胺分光光度法,绘制出的SO2含量与吸光度标准曲线方程为:Y=0.02491X+0.05249,R=0.99916,表明吸光度与SO2含量为正比关系,拟合程度较好,符合实际。
2.本次实验求得测量点空气中的SO2的含量为0.048mg/m3,达到环境空气质量标准的一级标准,但因测量点单一且测量时间较短,该次测量结果并不具代表性,不能完全说明东校区空气中SO2含量的实际情况。
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
- 熔点的测定实验报告
-
有机化学实验报告实例熔沸点的测定
有机化学实验报告姓名班级学号郑州轻工业学院化工系实验名称熔点沸点的测定姓名班级学号实验日期实验目的1掌握用齐列管法测定有机化合物熔…
-
熔点.沸点的测定实验报告(4)沈杰
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程学院化学工程与工艺化工114班沈杰学号114020…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工101班郭了了学号104020xx114…
-
熔点的测定预习实验报告
河北北方学院20xx级工业分析与检验一班邢妍萍熔点的测定预习实验报告一、实验目的及要求1.了解熔点测定的意义和应用。2.掌握熔点测…
-
传热膜系数测定实验报告加思考题
目录一摘要1二实验目的1三实验基本原理及内容1四实验装置说明及流程图3五实验步骤4六实验注意事项4七实验数据处理5八结果与讨论8九…
- 熔点的测定实验报告
-
熔点及沸点的测定实验报告
有机化学实验报告实验名称熔点和沸点及其测定学院化学工程学院专业化学工程与工艺班级姓名学号指导教师日期熔点及其测定实验目的1了解熔点…
-
熔点的测定实验报告
熔点的测定一实验目的1了解熔点测定的基本原理及应用2掌握熔点的测定方法二实验原理固液两相蒸汽压一致固液两相平衡共存这时的温度摄氏度…
-
有机化学实验报告实例熔沸点的测定
有机化学实验报告姓名班级学号郑州轻工业学院化工系实验名称熔点沸点的测定姓名班级学号实验日期实验目的1掌握用齐列管法测定有机化合物熔…