氯化钠的提纯实验报告
山东师范大学化学化工与材料科学学院
实 验 报 告
实验题目 氯化钠的提纯 实验时间 指导教师 成绩
年级__ _专业 班 姓名 学号
[目的要求]
[实验原理]
[主要仪器设备]
[实验步骤]


















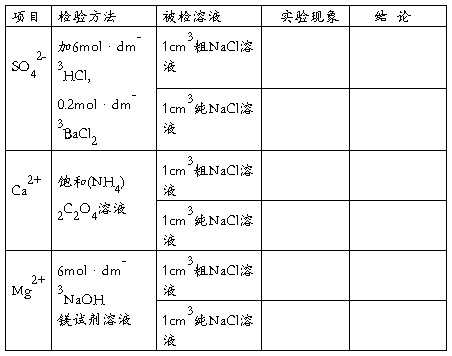
[实验结果]
1.产品外观及质量(克):
2.粗盐质量及纯盐产率(计算):
3.纯度检验
[实验结果分析]
[讨论与心得]
1.重要注意事项总结
2.思考题
(1)K+离子在哪一步操作中除去?
(2)除去 时调pH为多少?为什么?
时调pH为多少?为什么?
第二篇:氯化钠提纯

工业盐提纯方案
一、实验原理
粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+,Mg2+等.不溶性杂质可以用过滤的方法除去,可溶性杂质中的Ca2+,Mg2+ 则可通过加入 、NaOH和Na2CO3溶液,生成沉淀而除去,也可加入BaCO3固体和NaOH溶液来除去。
二、实验仪器和药品
药品:粗盐,蒸馏水
氢氧化钠饱和溶液:称取120g氢氧化钠,加100mL水,振摇使之溶解成饱和溶液,冷却后置于聚乙烯塑料瓶中,密塞,放置数日,澄清后备用
碳酸钠溶液: 称取45.5g碳酸钠,溶解于100 ml 蒸馏水中,加盖煮沸后放凉,用带橡皮塞的试剂瓶保存备用。
盐酸溶液 (1+1)取50mL浓盐酸加50mL蒸馏水混合均匀
器材:托盘天平(含砝码),量筒,烧杯,玻璃棒,药匙,漏斗,滤纸,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,若干一样的小纸片,研钵,研杵,滤纸,火柴,纸片
三、实验操作
1.溶解
用托盘天平称取5克粗盐(精确到0.1克).用量筒量取50毫升水倒入烧杯里.用药匙取一匙粗盐加入水中,观察发生的现象.用玻璃棒搅拌,

并观察发生的现象 .接着再加入粗盐,边加边用玻璃棒搅拌,一直加到粗盐不再溶解时为止.观察溶液是否浑浊.
2.过滤
将滤纸折叠后用玻璃棒蘸水润湿使其紧贴漏斗内壁并使滤纸上沿低于漏斗口,溶液液面低于滤纸上沿,倾倒液体的烧杯口要紧靠玻璃棒,玻璃棒的末端紧靠有三层滤纸的一边,漏斗末端紧靠承接滤液的烧杯的内壁。慢慢倾倒液体,待滤纸内无水时,仔细观察滤纸上的剩余物及滤液的颜色.滤液仍浑浊时,应该再过滤一次.
①“一贴”是指滤纸折叠角度要与漏斗内壁口径吻合,使湿润的滤纸紧贴漏斗内壁而无气泡,因为如果有气泡会影响过滤速度.
②“二低”是指滤纸的边缘要稍低于漏斗的边缘,二是在整个过滤过程中还要始终注意到滤液的液面要低于滤纸的边缘。这样可以防止杂质未经过滤而直接流到烧杯中,这样未经过滤的液体与滤液混在一起,而使滤液浑浊,没有达到过滤的目的。
③“三靠”一是指待过滤的液体倒入漏斗中时,盛有待过滤液体的烧杯的烧杯嘴要靠在倾斜的玻璃棒上(玻璃棒引流),防止液体飞溅和带过滤液体冲破滤纸;二是指玻璃棒下端要轻靠在三层滤纸处以防碰破滤纸(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄破);三是指漏斗的颈部要紧靠接收滤液的接受器的内壁,以防液体溅出。
3.蒸发
把得到的澄清滤液倒入蒸发皿.把蒸发皿放在铁架台的铁圈上,用酒精灯加热。同时用玻璃棒不断搅拌滤液(均匀受热,防止液体飞溅).
等到蒸发皿中出现较多量固体时,停止加热.利用蒸发皿的余热使滤液蒸干.
4.用玻璃棒把固体转移到纸上,称量后,回收到教师指定的容器.比较提纯前后食盐的状态并计算精盐的产率.
5.粗盐中含有Mg2+、Ca2+去除可溶性杂质:
溶解
1.加入过量NaOH(去除镁离子)Mg2++2OH-=Mg(OH)2↓
2.加入过量Na2CO3(去除钙离子及BaCl2中的钡离子) Ca2++CO32-=CaCO3↓
注:1,2两步可互换
过滤
向滤液中加入适量HCl(除去过量NaOH,Na2CO3,可选择用pH试纸控制加入的量,或是直接蒸发)
蒸发,结晶
四、计算产率
将提纯后的氯化钠与粗盐作比较,计算精盐的产率。
玻璃棒的作用:
本实验5次用到玻璃棒
1.溶解时:搅拌,加速溶解。
2.过滤前:蘸水润湿滤纸。
3.过滤时:引流。
4.蒸发时:搅拌,使液体均匀受热,防止液体飞溅。
5.计算产率时:用玻璃棒把固体转移到纸上。
(注意玻璃棒搅拌时不要碰到杯壁)
过滤前后溶液内元素变化:反应前NaCl、MgCl2、CaCl2
加入Na2CO3(过量)产生CaCo3沉淀 溶液内还剩:NaCl、MgCl2、Na2CO3
加入NaOH(过量)产生Mg(OH)2沉淀 溶液内还剩:NaCl、Na2CO3、NaOH
加入HCl(过量)产生CO2、H20 溶液内还剩:HCl、NaCl
蒸发后还剩下:Nacl
五、实验现象
溶解:粗盐固体为灰色,加入水中所得液体呈浑浊状。
过滤:滤液是无色透明液体,滤纸上的残留物呈黑色。
蒸发:随着加热,蒸发皿中液体的量减少;当蒸发到一定程度时,蒸发皿底部有固体析出。蒸发得到的固体为白色。[1]
-
化学实验报告-氯化钠提纯
化学实验报告氯化钠提纯实验目的1通过沉淀反应了解提纯氯化钠的方法2练习台称和煤气灯的使用以及过滤蒸发结晶干燥等基本操作实验原理粗食…
-
无机化学实验八 氯化钠的提纯
实验八氯化钠的提纯一实验目的1学会用化学方法提纯粗食盐同时为进一步精制成试剂级纯度的氯化钠提供原料2练习台秤的使用以及加热溶解常压…
-
氯化钠的提纯实验报告
山东师范大学化学化工与材料科学学院实验报告实验题目氯化钠的提纯实验时间指导教师成绩年级专业班姓名学号目的要求实验原理主要仪器设备实…
-
实验一 氯化钠的提纯
实验一氯化钠的提纯一目的要求1掌握提纯氯化钠的原理和方法2练习溶解沉淀减压过滤蒸发浓缩结晶和烘干等基本操作4了解CaMgSO4等离…
-
粗盐制备分析纯氯化钠实验报告
粗盐制备分析纯氯化钠一实验题目粗盐制备分析纯氯化钠二实验目的1巩固减压过滤蒸发浓缩等基本操作2了解沉淀溶解平衡原理的应用3学习在分…
-
甲基橙的制备 有机化学实验报告
实验学专班姓指导日机化学实验报告名称甲基橙的制备业化学工程与工艺级名学号教师房江华李颖期有一实验目的1通过甲基橙的制备学习重氮化反…
-
粗盐制备分析纯氯化钠实验报告
粗盐制备分析纯氯化钠一实验题目粗盐制备分析纯氯化钠二实验目的1巩固减压过滤蒸发浓缩等基本操作2了解沉淀溶解平衡原理的应用3学习在分…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…
- 一定溶质质量分数的氯化钠溶液的配制实验报告单
-
实验活动5_一定溶质质量分数的氯化钠溶液的配制实验报告
实验报告班级姓名日期年月日一实验目的1练习配制一定溶质质量分数的溶液2加深对溶质的质量分数概念的理解二实验仪器与药品托盘天平烧杯玻…
-
粗盐提纯实验报告
一实验目的1掌握溶解过滤蒸发等实验的操作技能2理解过滤法分离混合物的化学原理二实验原理粗盐中含有泥沙等不溶性杂质不溶性杂质可以用溶…