酸碱中和滴定实验预习报告
酸碱中和滴定和溶液配制实验预习报告
实验原理:
c(标)×V(标) = c(待)×V(待)
实验目的;
(1)通过中和滴定实验,掌握中和滴定实验操作方法.
(2)通过中和滴定实验,理解化学定量分析实验中有关实验数据的收集和处理,实验结果的计算,实验误差的分析等.
(3)通过酸碱中和实验,理解化学实验中测定酸或碱的浓度的基本方法.
实验要求:
a.滴定管:洗涤---检漏---润洗---注液---赶气泡---调液
润洗:用标准液或待测液分别润洗酸式滴定管和碱式滴定管.
调液:调节液面至零或零刻度线以下.如果尖嘴部分有气泡,要排出气泡.
读数:视线和凹液面最低点相切.
b.锥形瓶:洗涤
注入(用滴定管或移液管)一定体积的溶液(待测液或标准液)到锥形瓶中,并滴加
实验步骤:
(1)左手控制滴定管的活塞
(2)右手摇动锥形瓶
(3)目视锥形瓶中溶液颜色的变化
(4)终点的判断
溶液颜色发生变化且在半分钟内不再变色.
多次测定求各体积的平均值 实验注意事项:
(1)摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出。
(2)滴定时左手不能离开旋塞让液体自行流下。
(3)注意观察液滴落点周围溶液颜色变化。开始时应边摇边滴,滴定速度可稍快(每秒3~4滴为宜),但是不要形成连续水流。接近终点时应改为加一滴,摇几下,最后,毎加半滴,即摇动锥形瓶,直至溶液出现明显的颜色变化,而且半分钟内不褪色,准确到达终点为止。滴定时不要去看滴定管上方的体积,而不顾滴定反应的进行。加半滴溶液的方法如下:微微转动活塞,使溶液悬挂在出口嘴上,形成半滴(有时还不到半滴),用锥形瓶内壁将其刮落。
(4)每次滴定最好从“0.00”ML处开始(或者从0ML附近的某一段开始),这也可以固定使用滴定管的某一段,以减小体积误差。
(5)计算时应注意
a、碱式滴定管没有用待测液润湿,结果偏低。
b酸式滴定管没用标准液润湿,结果偏高。
(5)指示剂的选择
酸碱指示剂一般选用酚酞和甲基橙,石蕊试液由于变色不明显,在滴定时不宜选用 .
强酸与强碱滴定 酚酞或甲基橙
强酸与弱碱滴定 甲基橙
弱酸与强碱滴定 酚酞
第二篇:酸碱中和滴定实验报告上课用
标准NaOH溶液滴定未知HCl的实验报告
一、实验目的: ;
二、实验用品:
实验仪器: ;
实验药品: ;
三、实验原理:例1、要使2L0.1mol/L的盐酸完全反应,所需NaOH溶液的体积为4L,求该NaOH溶液的物质的量浓度为多少?
四、实验步骤
(一)滴定前的准备阶段1、认识酸碱滴定管及其特点:
(1)结构特点:
(2)材质区别:
2、滴定前操作
(1)、检漏: ;
(2)、洗涤: ;
3、量取:用酸式滴定管量出一定体积的未知浓度的HCl溶液,注入锥形瓶中,并往锥形瓶中滴加几滴酚酞,现象为溶液不变色。用碱式滴定管量取标准液NaOH,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位。
(二)滴定阶段
1、观察: 眼睛: 左手: ;
右手: ;
2、操作:滴加溶液方法:成线(开始时) 成滴(接近终点时)
终点判断:
;
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复3次。
讨论:1、认识酸碱指示剂;
2、滴定终点是否为PH=7?
例2、将半滴(约为0.02ml)1mol/L的盐酸滴入到纯水中20mL,求该溶液的PH为多少?
(三)数据处理
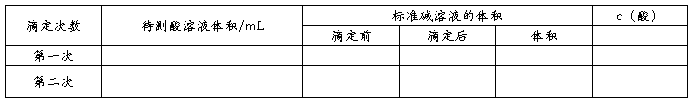
,
计算待测液的物质的量浓度
(四)误差分析

当堂测验:
1、中和滴定中,视线应注视( )
A. 滴定管内液面变化 B. 液滴滴出速度C. 滴定管刻度 D. 锥形瓶中溶液颜色变化
2、在25mL的碱式滴定管中盛有溶液,液面恰好在20mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
3. 用标准酸滴定碱时,滴定前读酸式滴定管读数时,视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度 ;
课下对点练习:
知识点一 滴定实验仪器与操作
1. 刻度“0”在上方的用于测量液体体积的仪器是( )
A. 滴定管 B. 量筒 C. 移液管 D. 量杯
2. 要准确量取25.00 mL稀盐酸,可用的仪器是( )
A. 25 mL碱式滴定管 B. 25 mL量筒 C. 25 mL酸式滴定管
3. 中和滴定时,用于量取待测液体积的仪器是( )
A. 胶头滴管 B. 量筒 C. 滴定管 D. 移液管
4. 进行中和滴定时,事先不应该用所盛溶液洗涤的仪器是( )
A. 酸式滴定管 B. 碱式滴定管 C. 锥形瓶 D. 移液管
5. 在25mL的碱式滴定管中盛有溶液,液面恰好在20mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
6. 准确量取25.00mL KMnO4溶液可以选用的仪器是( )
A. 50mL量筒 B. 10mL量筒 C. 50mL酸式滴定管 D. 50mL碱式滴定管
7. 下列仪器中,没有“0”刻度线的是( )
A. 温度计 B. 量筒 C. 滴定管 D. 容量瓶
8. 用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,在滴定操作时,盐酸( )
A. 只能盛在锥形瓶中 B. 只能盛在酸式滴定管中
C. 也可用碱式滴定管取放 D. 既可盛在锥形瓶中,也可盛在酸式滴定管中w.w.w.k.s.5.u.c.o.m
知识点二 指示剂的选择
1. 用标准浓度的盐酸来滴定未知浓度的氢氧化钠,若用甲基红为指示剂,滴定终点时的颜色变化应该是
A. 由黄色变成红色 B. 由黄色变为橙色 C. 由橙色变成红色 D. 由红色变为橙色
2. 用标准浓度的氢氧化钠溶液来滴定未知浓度的盐酸,使用酚酞做为指示剂,下列叙述中说明恰好达到滴定终点的是( )
A. 由红色变为深红色 B. 由无色变为深红色
C. 由浅红色变成深红色 D. 由无色变为浅红色
3. 用标准NaOH溶液滴定待测盐酸,若用甲基橙代替酚酞作指示剂,此时盐酸浓度的测定值与酚酞作指示剂的测定值相比较是( )
A. 偏大 B. 偏小 C. 无影响 D. 无法判断
4. 用已知物质的量浓度的NaOH溶液滴定未知物质的量浓度的HCl溶液,一般选用_________作指示剂,用已知物质的量浓度的HCl溶液滴定未知物质的量浓度的NaOH溶液,一般选用_________作指示剂。
知识点三 中和滴定的误差分析
1. 用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液,下列操作会导致测定结果偏高的是( )
A. 用标准的盐酸溶液润洗酸式滴定管2-3次 B. 用待测碱液润洗碱式滴定管2-3次
C. 用待测碱液润洗锥形瓶2-3次 D. 用蒸馏水润洗锥形瓶2-3次
2. 用标准的盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是( )
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C. 用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
D. 改用移液管取10.00 mL的NaOH溶液,放入锥形瓶后,把移液管尖嘴液体吹去
3. 实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂.下列操作可能使测定结果偏低的是( )
A. 酸式滴定管在装液前未用标准盐酸溶液润洗2次~3次.
B. 开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中,气泡消失.
C. 滴定过程中,锥形瓶内溶液颜色变化由黄色变橙色,但立即又变为黄色,此时即记下滴定管液面所示的刻度.
D. 达到滴定终点时,俯视读数. E. 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗.
知识点四 中和滴定的数据处理
1. 酸碱完全中和时( )w.w.w.k.s.5.u.c.o.m
A. 酸与碱的物质的量一定相等
B. 酸所能提供的H+和碱所能提供的OH-的物质的量相等
C. 酸与碱的质量相等 D. 溶液呈中性
2. 中和滴定中,用浓度为C mol·L-1的某二元酸溶液中和摩尔质量为M g·mol-1的一元碱W g,耗这种二元酸溶液的体积是( )
A. 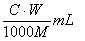 B.
B. 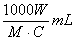 C.
C. 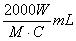 D.
D. 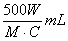
3. 中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者的大小关系为( )
A. V3>V2>V1 B. V3>V2=V1 C. V3=V2>V1 D. V1=V2>V3,
4. 下列溶液一定是碱性的是( )
A. 溶液中c(OH-)>c(H+) B. 滴加甲基橙后溶液显红色
C. 溶液中含有OH- D. 滴加甲基橙后溶液显黄色
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定实验报告
酸碱中和滴定实验一所用仪器酸式滴定管碱式滴定管和锥形瓶1酸式滴定管和碱式滴定管的构造对比不同点及其原因2对比滴定管和量筒刻度的不同…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…