食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定
孟娟
20##级化学3班14小组 41207149
一、实验目标
1.初步学会用传感器技术测定食醋中的总酸量;
2.会组织中学生用传感器技术测定食醋中的总酸量教学过程。
二、实验原理
1.食醋中的主要成分是醋酸,此外还含有少量的乳酸等有机酸,醋酸是弱酸,用传统的pH试纸或酸度计测定食醋中的总酸量,总是要比实际浓度低,误差很大。本实验将使用传感器技术来测定食醋中的总酸量,该方法不怕待测物中的颜色干扰,测定既快又不用加指示剂。
传感器简介:传感器是一系列根据一定的物理化学原理制成的物理化学量的感应器具,它能把外界环境中的某个物理化学量的变化以电信号的方式输出,再经数据模拟装置转化成数据或图表的形式在数据采集器上显示并储存起来。中学化学教学中进行科学探究常用到的传感器有温度传感器、pH传感器、溶解氧传感器、电导率传感器、光传感器、压力传感器、色度传感器等。传感器技术的特点:便携,实时,准确,综合,直观。
pH传感器是用来检测被测物中氢离子浓度并转换成相应的可用输出信号的传感器,通常由化学部分和信号传输部分构成。pH传感器利用能斯特(NERNST)原理。
待测的食醋中醋酸及其他有机酸可换算为醋酸总量,都可以被标准的强碱NaOH溶液标定:
NaOH+CH3COOH=CH3COONa+H2O
C待测V待测=C标准V标准
2.当溶液中的电解质含量恒定时,电导率亦恒定,当生成难电离物质时,电导率下降,pH传感器就是把电信号转化为化学信息来测定其中的总酸度的。
三、仪器与药品
pH传感器、数据采集器、自动计数器、50mL酸式滴定管、电磁搅拌器、铁架台、250mL烧杯、量筒
有色食醋原液、0.1mol/L NaOH溶液、蒸馏水
四、实验操作过程
1.准备阶段:pH传感器的标定
(1)在采集器3号传感器接口上连接好pH传感器,然后按下采集器电源开关,打开数据采集器,进入如下界面:

图一
点击右下角“系统设置”,进入如下界面:
图二
选择系统设定里的“探头标定”选项,并点击“探头校准工具”按钮:
图三
点击“建立连接”按钮(点击后变灰色,显示连接成功,即可开始标定)。
(2)拔开电极上部的橡胶塞,使小孔露出。否则在进行校正时,会产生负压,导致溶液不能正常进行离子交换,会使测量数据不准确。
(3)将电极取出,先用蒸馏水冲洗,然后用滤纸把电极上残留的保护液吸干。将电极放进pH=4.00(邻苯二甲酸氢钾)的缓冲液中,点击采集器上pH=4下的“开始标定”按钮,5-10秒后,当显示的数值在220##-23000间,且变化幅度不大时,点击“结束标定”,取出电极。
(4)将电极取出,先用蒸馏水冲洗,然后用滤纸把电极上残留的保护液吸干。将电极放进pH=9.18(邻苯二甲酸氢钾)的缓冲液中,点击采集器上pH=4下的“开始标定”按钮,5-10秒后,当显示的数值在27000-28000间,且变化幅度不大时,点击“结束标定”,取出电极。最后点击一次“写标定值”。
(5)验证标定:标定完成,进入传感器测量界面,将探头放入pH=6.86(混合磷酸盐)的溶液中,检测标定是否成功。观察读数稳定后读数在6.70-7.00之间即可认为标定比较准确,否则应重新标定。
2.软件操作
(1)标定后, 点击“通用”,进入通用实验界面:点击左上角“打开模版”依如下路径选择实验:
打开模版—SDMEM—实验模版—化学实验—酸碱中和滴定—酸碱中和滴定(xmlp文件)
 进入滴定实验界面,如下图:
进入滴定实验界面,如下图:
图四
光电门传感器红色线(或有红色标记的)一端连接液滴计数器,黑色线(无标记的)接一光电门(该光电门应放在空处,不被任何物体挡光),调节光电门传感器为计数模式(第1个和第3个灯同时亮)。然后长按光电门传感器上按钮,3个灯同时亮时放开清零数据(开始实验前必备操作)(注意清零时不要更改模式)。
在盐酸一栏中输入烧杯中溶液浓度,在待测液体积一栏中输入烧杯中溶液体积。该实验模版原用于已知浓度的盐酸滴定未知浓度氢氧化钠的实验,在未修改模版条件下,故如此填写已知量,计算仍以H+与OH-物质的量相等为原理
图五
3.往酸式滴定管中注入有色食醋溶液。再往烧杯中注入标定过的50mL NaOH溶液,把烧杯放于磁力搅拌器上。如图:

图六
4.点击“开始/停止”按钮,开始实验。打开磁力搅拌器(最好在实验开始前调好位置或打开,不要让磁子在转动时碰到传感器电极),然后转动滴定管旋钮,让滴定管中食醋以不连续状态滴入烧杯中。当pH传感器的数据刚开始变化,立即终止滴入食醋,并记录已消耗的食醋的体积。再次滴入食醋,注意跟踪pH的变化,当数值接近滴定终点时滴入的食醋尽可能地慢。当波峰曲线出现平台时,停止滴加食醋溶液。
5.当整个实验结束后,点击“开始/停止” 按钮,停止实验。点击“刷新数据”,进入实验数据界面可看到整个实验过程中所有实验数据,最后点击“保存/转发”按钮,保存实验数据到采集器SD卡根目录下。通过计算机端“单机运行平台”软件可在电脑端打开此数据,求导值的最低点横座标即为滴定终点的体积,输入该滴定终点体积(之前已输入烧杯中溶液体积和浓度),点击软件上“重新计算”按钮,可计算出待测溶液浓度。
五、数据处理
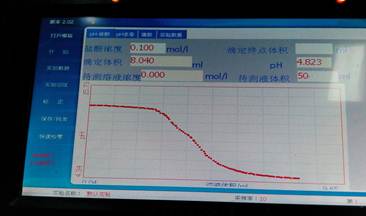
图七
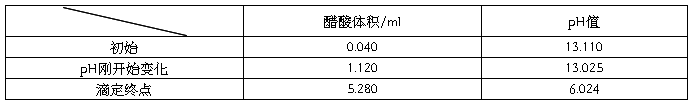
滴定终点所消耗的体积为5.280 ml,滴定终点pH为6.024
对pH-体积图中的最低点进行求导,得到到该点时消耗的食醋的体积约为5.280mL。已知NaOH溶液的浓度为0.1mol/L,NaOH溶液的体积为50mL。
 由C待测V待测=C标准V标准 C待测=(C标准V标准)/V待测
由C待测V待测=C标准V标准 C待测=(C标准V标准)/V待测
所以C待测=(0.1mol/l×50ml÷5.280ml=0.95mol/l=5.70g/(100ml)
待测食醋中的醋酸含量为5.70g/100mL。
误差分析:1.所用仪器较为老旧,致使实验数据不准;2.配制NaOH溶液使部分NaOH固体发生了潮解,致使实验数据偏高。
六、实验注意事项
1.pH电极使用一段时间后,不对称电位将会发生很大改变,故必须定期校准。用pH缓冲溶液标定是为了消除不对称电位的影响。
2.在进行标定pH电极时,应断开光电门传感器与数据采集器的连接。
3.数据采集器关机或重启后,pH传感器须重新标定。
4.光电门应放在空处,不被任何物体挡光。
5.滴定前长按光电门传感器上按钮清零数据,清零数据时不要更改模式。
6.滴定时,酸式滴定管的尖嘴与计数器挡光孔必须垂直对齐。
7.滴定开始后注意“滴定体积”一栏中有无体积变化,同时在“pH”一栏会开始显示pH值。如溶液已开始滴入烧杯,而“滴定体积”一栏无数据,则说明液滴通过计数器时未引起变化,需要调节装置,让液滴通过计数器挡光孔,并更换溶液清除数据重新开始实验。如果“pH”一栏数据不变或为非数字时,说明传感器标定不正确,需要重新标定,再开始实验。
8.滴定速度的控制:在接近终点时,要注意放慢速度,以便观察到终点。
9.酸碱的浓度差别不要太大,否则,实验将较难控制,结果误差较大。
七、实验反思
本次实验是利用传感器技术测定食醋中的总酸量。对于传感器技术,我认为自己还不熟悉,还有很多困惑,比如传感器的工作原理,为什么可以使用传感器技术来测定食醋中的总酸量以及除了测定食醋中的总酸量之外,传感器还能运用于化学的哪些方面等。根据这些困惑,我会继续查找资料,深入学习传感器技术。
用传感器技术来测定食醋中的总酸量这一部分内容已经出现在了高中课本中,因此,学会用传感器技术测定食醋中的总酸量,并在此基础上学会组织中学生用传感器技术测定食醋中的总酸量对于即将成为化学老师的我们变得很重要。但是,使用传感器技术进行实验与传统的在玻璃仪器中进行的实验不同,它的操作对于初学者来说比较陌生,因此,如果想要把这个实验做好并给学生讲清楚,我们就需要下一定的功夫。
八、重点文献综述
1.关于“食醋中总酸含量的测定”学案设计与评价的设计思想:食醋中总酸含量的测定是高中《实验化学》(苏教版)关于“物质的定量分析”专题研究的开始,将学生带入定量研究学习状态尤为重要[1]。为此,该学案的设计思想是利用学案导学诱思,促进学生积极主动地投身于定量实验探究的活动。[2]
2.为了避免常规指示剂法对观察滴定终点的影响,采用连续电位滴定法,通过控制食醋样品的pH值来连续测定食醋中的总酸量,获得了比较满意的结果[3]。
3.传感器简介
传感器是一系列根据一定的物理化学原理制成的物理化学量的感应器具,它能把外界环境中的某个物理化学量的变化以电信号的方式输出,再经数据模拟装置转化成数据或图表的形式在数据采集器上显示并储存起来。
20世纪80年代,传感器技术已在美国等西方国家的中学理科教学中得到广泛的应用。我国是从20世纪末才开始传感器技术在教学中的应用,尽管起步较晚,但传感器技术在在包括化学学科在内的中学理科教学中发挥越来越显著的作用。
中学化学教学中进行科学探究常用到的传感器有温度传感器、pH传感器、溶解氧传感器、电导率传感器、光传感器、压力传感器、色度传感器等。[4]
传感器技术的特点:便携,实时,准确,综合,直观。[5]
4.实验背景
醋作为我们日常生活中经常食用的酸性调味品,不仅营养丰富而且具有抗疲劳、调节血糖、调节血脂、降血压、抗氧化、抗癌、促进食欲、预防骨质疏松等多种保健功效。[6]
食醋的质量高低取决于其中所含醋酸量的多少。
市场上销售的食醋中,既有无色的(白醋、兑制醋),又有有色的(香醋、陈醋、熏醋),它们的标牌上所标出的醋酸总含量各不相同,有的大于9g/100mL,有的大于6g/100mL,还有的标着大于等于4.5 g/100mL、4.2 g/100mL、3.5 g/100mL等等。
(1)食醋中的主要成分是HAc,此外还含有少量的乳酸等有机酸,HAc是弱酸,用pH试纸或酸度计测定食醋中的总酸量,总是要比实际浓度低,何因?
答:若用pH试纸或酸度计测定只能测定出HAc溶液中电离出来的H+的含量,但是由于食醋中大多含有的为CH3COOH,而它是一种弱酸,在溶液中是部分电离,所以pH试纸或酸度计测得的比实际的pH低。
(2)如果用中和滴定的方法来测定食醋中的总酸量,那么如何选择指示剂? 答:用氢氧化钠滴定,酚酞是在碱性范围(pH8.2 ~ 10.0)内变色,HAc与NaOH反应产物为弱酸强碱盐NaAc,化学计量点时pH≈8.7,滴定突跃在碱性范围内(如:0.1mol?L-1NaOH 滴定0.1mol?L-1HAc突跃范围为PH:7.74~9.70),在此若使用在酸性范围内变色的指示剂如甲基橙,将引起很大的滴定误差(该反应化学计量点时溶液呈弱碱性,酸性范围内变色的指示剂变色时,溶液呈弱酸性,则滴定不完全)。因此在此应选择在碱性范围内变色的指示剂酚酞(8.0~9.6)。(指示剂的选择主要以滴定突跃范围为依据,指示剂的变色范围应全部或一部分在滴定突跃范围内,则终点误差小于0.1%)而甲基橙(pH<3.1的变红,pH>4.4的变黄,3.1-~4.4的呈橙色)或甲基红是在酸性范围(PH4.4~6.2)内变色,若用甲基橙或甲基红变色时并未达到滴定终点,会影响实验结果。
(3)用中和滴定来测定白醋和兑制醋很好,但是测定米醋、果醋、熏醋等有色食醋的含酸量时,因其颜色比较深,能遮盖住指示剂的颜色,这样就无法看见指示剂的颜色变化,能否用蒸馏水冲稀食醋以减轻颜色的干扰,或者能否用活性炭对这类食醋作脱色处理以后滴定?加入活性炭对溶液的酸度是否有影响?
答:在意外的中学实验当中,都是通过稀释食醋来达到目的,使其受颜色干扰小,但是这样在稀释的过程中,同样的会使HAc电离情况发生变化,会带来测量不准确的问题;而加入活性炭进行脱色看起来可以,但是活性炭中的C是具有还原性的,食醋的配料是复杂的,所以加入进去,会对食醋的酸度有一定影响。
综上所述:为了克服上述三点不足,所以我们选用一种称作pH传感器测定的方法来实现,该方法不怕待测物中的颜色干扰,测定既快又不用加指示剂。
九、参考文献
[1]王先锋.“食醋中总酸含量的测定”学案设计与评价[J].化学教学,2012:02.
[2]郑长龙主编.化学实验课程与教学论[M].北京:高等教育出版社,2009:18-19
[3]肖常磊,钱扬义主编.中学化学实验教学论[M].北京:化学工业出版社,2008:55-57
[4]钱扬义编著.手持技术在立刻试验中的应用研究[M].北京:高等教育出版社,2003:20
[5]白涛等编著. 化学为什么是这样基于手持技术的数字化实验探索[M].北京:化学工业出版社,2011:54-55
[6]黄诚,尹红,周金森.食醋中总酸、总酯含量的连续测定[J].食品与发酵工业,2001:12.
第二篇:食醋总酸的测定1修改好的
漯河职业技术学院
毕业设计
题 目: 食醋中总酸的测定
系 别: 食品工程系
专 业: 生物技术及应用
班 级: 10级生物技术一班
学 号: 2010040301018
学生姓名: 豆丛丛
指导教师姓名: 党玮 左俊峰
指导教师职: 副教授 讲师
‘
河南 漯河
20##年 12 月 25日
目 录
1.食醋中总酸的测定... 1
1.1实验目的... 1
1.2实验原理... 1
1.3使用器材... 1
1.4实验步骤... 1
1.5数据处理... 2
2.实验技能... 2
2.1电子分析天平及容量瓶的使用方法... 2
2.2容量瓶的使用方法... 2
2.3吸量管的使用... 3
2.4滴定管的使用... 4
2.4.1定义... 4
2.4.1类别... 4
2.4.3滴定管的准备: 4
2.4.5溶液的装入... 5
2.4.6滴定操作... 5
2.4.6读数... 5
2.4.7滴定结束... 5
2.5溶液的配制... 6
2.5.1配制方法... 6
2.5.2注意事项: 6
3.思考以总结... 6
参考文献... 7
致 谢... 8
食醋中总酸的测定
豆丛丛
1食醋中总酸的测定
1.1实验目的
1) 熟练掌握电子天平,电子分析天平,滴定管,容量瓶,移液管的使用方法和滴定操作技术
2) 掌握氢氧化钠标准溶液的配制和标定方法
3) 了解强碱滴定弱酸的反应原理及指示剂的选择
4) 学会食醋中总酸度的测定方法
1.2实验原理:
1) NaOH的标定
NaOH易吸收水分及空气中的CO2,因此,不能用直接法配制标准溶液。需要先配成近似浓度的溶液(通常为0.1mol/L),然后用基准物质标定。
邻苯二甲酸氢钾,邻苯二甲酸氢钾易制得纯品,在空气中不吸水,容易保存,摩尔质量大,是一种较好的基准物质。标定NaOH反应式为:
KHC8H4O4+NaOH=KNaC8H4O4+H2O
m/M=CNaOH´VNaOH(L)
CNaOH=m/(M´VNaOH)(L)
2) 醋酸总酸的测定
食醋中的主要成分是醋酸,此外还含有少量的其他弱酸如乳酸等,用NaOH标准溶液滴定,在化学计量点是呈弱碱性,选用酚酞作指示剂,测得的是总酸度。
反应式:CH3COOH+NaOH=CH3COONa+H2O
1.3使用器材
碱式滴定管,锥形瓶(250ml),小烧杯(100ml),试剂瓶,量筒,容量瓶(250ml),移液管(25mL),电子分析天平,电子天平.
1.4实验步骤
1) 进入实验室,将实验要用的到的有关仪器从仪器橱中取出,把玻璃器皿按洗涤要求洗涤干净规用配制好的NaOH溶液润洗的碱式滴定管,然后装入NaOH溶液,调至0.000液面
2) NaOH溶液的标定准确称取0.5~0.6g邻苯二甲酸氢钾三份,分别置于250mL锥形瓶中,加水50mL溶解后,滴加酚酞指示剂1~2滴,用NaOH溶液滴定至溶液呈微红色,30秒内不褪色,即为终点。平行测定三份。
3) 食醋中醋酸含量测定
4) 准确移取25.00mL稀释后的食醋于250mL容量瓶中,以蒸馏水稀释至标线,摇匀。用移液管吸取上述试液25mL于锥形瓶中,加入25mLH2O,1~2滴酚酞指示剂,摇匀,用已标定的NaOH标准溶液滴定至溶液呈微红色,30秒内不褪色,即为终点。平行测定三份,同时做试剂空白,计算食醋中醋酸含量(g/100mL)。
1.5数据处理
P(Hac)=c(NaOH)V(NaOH)Mr.(Hac)
Vex
2.实验技能
2.1电子分析天平及容量瓶的使用方法
1) 观察水泡是否位于水平仪中心,若有偏移可调节水平调节脚,是水平仪内气泡位于圆
2) 环中央。
3) 接通电源,轻按“on/off”键,当显示器显示“0.0000”后方可称量。
4) 称量时,将洁净的称量纸、称量瓶、小烧杯、至于秤盘中央,关闭天平侧门,稍后轻按下天平“on/off”键,天平自动校对零点。当显示器显示‘0.0000’后,开启右侧门。在称量盘上缓慢加入待测试样知道所需质量,随手关好门。到显示器显示稳定的数值,次数值为被测物的质量。
5) 称量完毕,按“on/off”键关闭显示器,此时天平处于待机状态,如天平不再使用,应拔下电源插头。罩上天平罩,并记录本上记录使用情况。
2.2容量瓶的使用方法
1) 检查容量是否漏水。检漏时,在瓶中加水至刻度线附近,盖上瓶塞后,左手用食指按住瓶塞,其余手指拿住瓶颈线以上部分,右手用之间拖住瓶地边缘,将瓶倒立2min,观察平周围是否渗水。然后将瓶直立,将瓶塞旋转180°,再检查一次,若仍不渗水,即可使用。
2) 容量瓶的洗涤。洗涤容量瓶时,应先用自来水洗几遍,倒出水后,内壁不挂水珠,即可用蒸馏水(15~20ml)荡洗3次后,备用。若内壁仍挂有水珠,则用铬酸洗液洗涤。先尽量倒出瓶内残留的水(以免破坏洗液),再加入10~20ml洗液,倾斜并转动容量瓶,使洗液布满内壁。放置数分钟,将洗液倒回原瓶中,再用自来水充分冲洗容量瓶和瓶塞,最后用蒸馏水荡洗3次。
2.3吸量管的使用
1) 要准确移取一定体积的液体时,常使用吸管。吸管有无分度吸管(又称移液管)和有分度吸管(又称吸量管)两种。如需吸取5mL、10mL、25mL等整数,用相应大小的无分度吸管,而不用有分度吸管。量取小体积且不是整数时,一般用有分度吸管,使用时,令液面从某一分度(通常为最高标线)降到另一分度,两分度间的体积刚好等于所需量取的体积,通常不把溶液放到底部。在同一实验中,尽可能使用同一吸管的同一段,而且尽可能使用上面部分,不用末端收缩部分。
2) 使用前,依次用洗液、自来水、蒸馏水洗涤,最后再取少量被量液体荡洗3次,以保证被吸取的溶液浓度不变。蒸馏水和溶液荡洗的用量由吸管大小决定,无分度吸管以液面上升到球部为限,有分度吸管则以充满全部体积的1/5为限。
3) 用吸管吸取溶液时,左手拿洗耳球(预先排除空气),右手拇指及中指拿住管颈标线以上的地方。吸管下端至少伸入液面1cm,不要伸入太多,以免管口外壁沾附溶液过多,也不要伸入太少,以免液面下降后吸空。用洗耳球慢慢吸取溶液,眼睛注意正在上升的液面位置吸管应随容器中液面下降而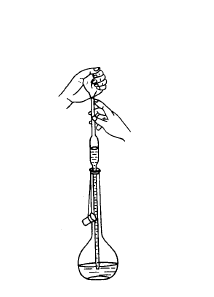
 降低。当溶液上升到标线以上时迅速用右手食指紧按管口,取出吸管,左手拿住盛溶液的容器,并倾斜约45°。右手垂直地拿住吸管,使其管尖靠住液面以上的容器壁,微微抬起食指,当液面缓缓下降到与标线相切时,立即紧按食指,使流体不再流出。再把吸管移入准备接收溶液的容器中,仍使其管尖接触容器壁,让接收容器倾斜,吸管直立,抬起食指,溶液就自由地沿壁流下。待溶液流尽后,约等15s,取出吸管。注意,不要把残留在管尖的液体吹出(除非吸管上注明“吹”字),因为在校准吸管容积时没有把这部分液体包括在内。
降低。当溶液上升到标线以上时迅速用右手食指紧按管口,取出吸管,左手拿住盛溶液的容器,并倾斜约45°。右手垂直地拿住吸管,使其管尖靠住液面以上的容器壁,微微抬起食指,当液面缓缓下降到与标线相切时,立即紧按食指,使流体不再流出。再把吸管移入准备接收溶液的容器中,仍使其管尖接触容器壁,让接收容器倾斜,吸管直立,抬起食指,溶液就自由地沿壁流下。待溶液流尽后,约等15s,取出吸管。注意,不要把残留在管尖的液体吹出(除非吸管上注明“吹”字),因为在校准吸管容积时没有把这部分液体包括在内。



 2.4滴定管的使用:
2.4滴定管的使用:
2.4.1定义:
滴定管是可准确测量滴定剂体积的玻璃量器。
2.4.1类别:
a) 酸式滴定管:(特征—玻璃旋塞)用于盛放酸性溶液、中性溶液和氧化性溶液。
b) 碱式滴定管:(特征—橡皮管+玻璃珠)用于盛放碱性和无氧化性溶液。
2.4.3滴定管的准备:
a) 用前检查:检查是否漏水,旋塞转动是否灵活;酸式管涂凡士林;碱式管更换胶皮管或玻璃球。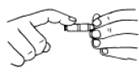 活塞涂凡士林碱式滴定管赶去气泡的方法
活塞涂凡士林碱式滴定管赶去气泡的方法
b) 洗涤:要求管壁湿润洁净,不挂水珠。
2.4.5溶的装入:
c) 用待装液润洗2~3次,每次约10mL;b、装液至0.00刻度以上;
d) 排气泡;d、调节初读数为0.00,或近0的任一刻度,以减小体积误差。
2.4.6滴定操作:
a) 酸式滴定管:左手无名指和小指向手心弯曲,其余三指,拇指在前,食指、中指在后,轻扣旋塞,转动。
b) 碱式滴定管:左手无名指及小指夹住尖嘴管,拇指与食指捏乳胶管,使玻璃球向手心移动,停止时,先松拇指和食指。
c) 滴加方法:逐滴连续滴加;加一滴;使液滴悬而未落,即加半滴于锥形瓶壁(或用蒸馏水冲下或用溶液涮下)。
d) 锥形瓶:右手三指拿住瓶颈,瓶底离台约2~3cm,滴定管下端深入瓶口约1cm,同一方向圆周运动,边滴边摇动。
e) 注意事项:滴定时,左手不能离开旋塞任其自流;眼睛注意落点周围溶液颜色的变化;开始时可稍快,最后加半滴。
f) 
左手操作活塞酸管滴定操作碱管滴定操作
2.4.6读数:
a) 装满或滴定完后,等1~2分钟再读数;若滴定速度较慢可等0.5~1分钟。
b) 将滴定管从架上取下,用右手大拇指和食指捏住无刻度处,其他手指辅助,保持垂直,视线与凹液底部平行(深色溶液读两侧最高点);
c) 读取的数值必须记录至小数点后第二位。
2.4.7滴定结束:
滴定管内剩余溶液应弃去,洗净滴定管,并用蒸馏水充满,夹在夹上备用。
2.5溶液的配制
2.5.1配制方法:
用固体物质(基准试剂或被测样品)配制溶液时,应现在烧杯中将固体物质完全溶解后在转移至容量瓶中,转移时,要使溶液沿玻璃棒流入瓶中。当烧杯中的溶液流尽后,在烧瓶仍沿着玻璃棒的情况下,让玻璃棒沿烧杯嘴稍向上提起至瓶嘴,再慢慢竖起烧瓶,使烧杯和玻璃棒之间附着的液体流回烧杯中,再将玻璃棒末端残留的液滴靠入瓶口内。在瓶口上方将玻璃棒放回烧杯内,但不得将玻璃棒靠在烧杯嘴一边。然后再用少量的蒸馏水(或是他溶剂)冲洗烧杯3~4次,洗出液按上法全部移入容量瓶中。加水至至刻度以下1~2cm时,改用胶头滴管加水至凹液面最低点与标线水平相切,随即盖紧瓶塞,左手捏住瓶颈上端,食指按住瓶塞,右手三指拖住瓶底,将容量瓶颠倒10次左右。一只手抓住瓶颈及瓶塞进行颠倒和摇动即可。
2.5.2注意事项:
对玻璃有腐蚀作用的液体,如强碱溶液,不能再容量瓶中久储,配好后应立即转移到其他容器中密闭存放。
3思考与总结
通过实验我们了解了哪些用电子分析天平,哪些用电子天平,学会了配制各种溶液,和实验室一些基本仪器的使用方法。同时也更全面的掌握了专业技能知识。
随着毕业日子的到来,毕业设计也接近了尾声。经过几周的奋战,我的毕业设计终于完成了。在没有做毕业设计以前觉得毕业设计只是对这几年来所学知识的单纯总结,但是通过这次做毕业设计发现自己的看法有点太片面。毕业设计不仅是对前面所学知识的一种检验,而且也是对自己能力的一种提高。通过这次毕业设计,我才明白学习是一个长期积累的过程,在以后的工作、生活中都应该不断的学习,努力提高自己的专业知识和综合素质。虽然时间有限,但我们还是从这次毕业设计中学到了好多知识,为我们以后走向工作岗位和继续深造打下了良好的基础。在以后的学习和工作中,我们仍然要不断努力,严格要求自己,实现自己的人生理想。
总之,这次的毕业设计使我学会了很多也成长了很多,真是万事开头难啊,不知道如何入手,今天终于完成了有种如释重负的感觉。此外,还得出一个结论:知识必须通过应用才能实现其价值!有些东西以为学会了,但真正到用的时候才发现是两回事,所以我认为只有到真正会用的时候才是真的学会了。
参考文献
【1】吴名胜,诸全头,杨秀芬“食醋总酸量“的测定教学过程化学教育200711:51—-51
【2】武汉大学。2002.无机及分析化学
【3】唐臻.食品分析与检验.北京:中国轻工业出版社[M],2009
【4】朱明华、2004.仪器分析,北京,高等教育出版社。
【5】范亚娜,盖轲.食醋中总酸含量的测定.宝鸡文理学院学报[J],2008,28(1):41-43.
致 谢
在本人的写作过程中,党玮老师和左俊锋老师给予了大力的帮助和指导,在此深表感谢!在整个过程中左老师指导我完成了实验,并讲解了与实验有关的内容。党老师在论文题目制定时,她首先肯定了我的题目大方向,同时帮我具体分析使我选择了食醋总酸的测定,让我在写作时有了具体方向。在论文提纲制定时,我的思路不是很清晰,经过老师的帮忙,让我具体写作时思路顿时清晰。从初稿到定稿,党老师不厌其烦,一审再审,大到篇章布局的偏颇,小到语句格式的瑕疵,都一一予以指出,才能让我顺利完成毕业论文。在此,谨向我的恩师党老师、左老师致以崇高的敬意和衷心的感谢!同时也感谢食品工程系的全体师生三年来对我的关心、支持和帮助。
本设计的完成远非终点,文中的不足和浅显之处则是我新的征程上一个个新的起点。我将努力继续前行!
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定姓名学号20xx级化学四班实验小组邮箱一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
食醋中总酸量的测定实验报告 (1)
食醋中总酸量的测定孟娟20xx级化学3班14小组4120xx49一实验目标1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用…
-
食醋中总酸量实验报告1
食醋中总酸量的测定一实验目的1学习食醋中总酸度的测定方法2了解传感器技术在中学实验中的应用二实验原理待测的食醋中醋酸及其他有机酸可…
-
食醋中总酸量的测定实验报告
食醋中总酸量的测定梁建林4100711820xx级化学3班1号实验小组电话187xxxxxxxx一实验目标1初步学会用传感器技术测…
-
食醋中总酸量的测定实验报告
实验六食醋中总酸量的测定20xx级化学1班1223实验室一实验目的1初步学会用传感器技术测定食醋中的总酸量2会组织中学生用传感器技…
-
实验三 食醋中总酸度的测定
实验三食醋中总酸度的测定总学时2学时一实验目的1熟练掌握滴定管容量瓶移液管的使用方法和滴定操作技术2掌握氢氧化钠标准溶液的配制和标…
-
食醋中总酸含量的测定
食醋中总酸含量的测定黄岩中学周元勇二基本的操作要求食醋总酸含量的测定实验操作要求基本上等同于老教材的中和滴定实验中和滴定实验的过程…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…