手持技术在酸碱中和滴定中的应用实验报告
大学实验报告
学生姓名 学 号
专 业 年级、班级
课程名称 实验项目手持技术在酸碱滴定中的应用
实验类型 □验证□设计□综合 实验时间2012 年 月 日
实验指导老师 实验评分
【实验问题提出】
中学阶段主要采用酸碱指示剂来确定滴定终点,但学生常因指示剂的选取不当或过早估计终点等问题而造成较大的实验误差。在中学的教学中,处理这一章节的内容比较困难,是否有比指示剂更准确更方便的实验方法呢?
【实验目的】
1. 通过手持技术加深对pH值变化滴定终点的理解
2. 感受手持技术在化学实验中的应用,了解手持技术的特点
3. 能够比较手持技术和指示剂判断酸碱滴定终点两种方法的优缺点
【问题解决设想】
由于酸碱中和滴定的全过程均是在溶液中进行的,溶液中pH 的变化随着滴定过程的进行而发生变化,因此,溶液的pH 可以表征溶液中离子( 如H + ) 的浓度。在滴定过程中,滴定剂与溶液中的被测离子反应生成水使溶液的pH 发生变化。因此,可通过滴定曲线上的突跃点来确定滴定终点。本次研究主要采用手持技术仪器( 主要包括数据采集器与pH传感器) ,通过计算机处理数据,为学生深刻理解中和滴定提供了技术条件,让学生更好的理解中和滴定的实质是
H+ + OH- = H2O。向酸( 或碱) 溶液中滴加碱( 或酸) 溶液,混合溶液pH 必然会发生变化。使用pH 传感器检测混合溶液在滴定过程中pH 的变化情况,并借助计算机以图像形式显示出来,即可得到酸碱中和滴定曲线。
本实验操作简便、快捷、准确性高,因此广泛应用于工农业生产和科学研究中,具有很高的使用价值。
【实验设计方案】
利用pH传感器和手持技术,研究酸碱中和滴定过程中pH值的变化趋势,从而准确判断出滴定终点,代替了传统的指示剂判断滴定终点的方法。
1、实验装置图

2、实验仪器及药品
仪器:计算机,数据采集器,pH 传感器,酸式滴定管( 50ml),磁力搅拌器; 烧杯( 50ml)
药品:盐酸(0.1mol/L)、NaOH溶液(0.1mol/L)
3、实验步骤
a.准确量取20.00ml 0.1mol/L NaOH溶液于100ml烧杯中
b.安装好实验装置,开启磁力搅拌器,调节适当的搅拌速度
c.打开数据采集器,将pH传感器连接到数据采集器的端口,然后设置数据采集器,采样样本总数为不连续。
d.打开酸式滴定管,调整适宜的滴定速度,滴定过程要保持匀速。
e.进行测定,得到变化曲线,分析结果
【实验结果记录和讨论】
通过实验,得到以下曲线,其中横坐标是时间,纵坐标是pH值
盐酸滴定氢氧化钠的pH值变化图
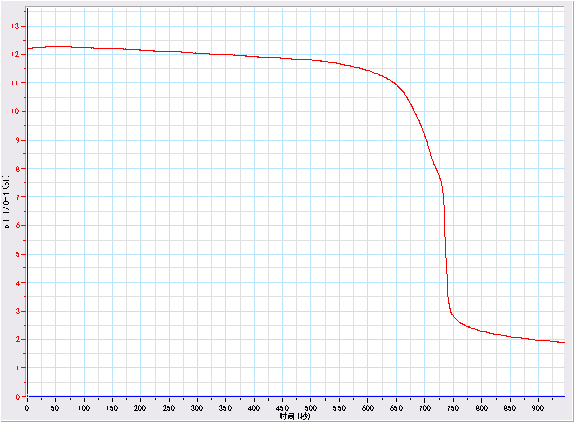
讨论:
1.本实验得到的曲线趋势符合滴定的过程,较直观准确地展现了中和滴定过程中的pH值变化。
2.不过从上图中可以看出,在实验过程中因为没有经验,我们一开始把滴定的速度调节得太慢,使得前段的pH变化比较平缓,后来我们把滴定速度稍微调快了一点,不过这并没有影响实验滴定终点的确认。
3.图中可以看出曲线并不是平滑的,而是有些小小的曲线变化,分析其原因可能是实验滴定过程中,因为溶液完全搅拌到酸碱反应需要一定的时间,而pH传感器比较敏感,在酸滴下来的瞬间测得了较低的pH值,酸碱中和后其值又暂时略有升高。
4.在滴定快达到终点的时候,从图上可以看出pH值降低曲线略为平缓了一点,分析其原因是此时溶液接近40毫升,其中的碱已经几乎完全被中和了,即使搅拌也没有太大的变化,所以在新一滴酸滴下来前测得的这一段比较平缓。
5.手持技术相对于传统滴定方法的优点:
a.通过测量pH值的变化,更便捷更直观地,且是定量地展现了酸碱中和滴定过程中的变化,使学生更容易理解和记忆。
b.避免了指示剂准确判断的难题。
【实验扩展思考与讨论】
1、手持技术是一种应用最先进的实用技术和教育理念、集数据采集与分析于一体的实验系统,将手持技术应用于研究性学习,既体现了新一轮基础教育改革的思想和理念,又符合学生学习的认知规律。该系统能采集的理科数据包括电流、电压、光强度、温度、力、气压、磁场、音量、距离、Ph、溶解氧、电导率、多种离子的浓度、相对湿度、心电图、光强度等。手持技术最突出的特点有以下几点:便携;数据采集器和传感器都比较小,在手掌上就可以操作,采集多种数据,故形象地称为手持技术仪器。其便携性可让师生能随时随地进行定量的探究活动,并将实验的过程及结果储存。
2、手持技术的优点使其可以更广泛地应用于中学化学实验中。例如根据上面的酸碱滴定实验,我们可以设计实验来同时滴定强酸与弱酸或者同时滴定强碱与弱碱,用所得的图表可以清晰准确地表示出这两种酸碱性不同的物质的区别。手持技术在化学实验中还有很多应用,下面一点是我在文献资料中了解到的:
3、 手持技术在新课标化学实验中的应用
新课标中对化学实验的重视度又有所上升。新课程中大大加强了化学实验的力度, 同时也强调了实验的探究性, 其中新课标在每个主题下都专门设置了“活动与探究建议”栏目, 并设计了多个与化学实验探究有关的活动。根据活动的内容, 可以把实验探究活动分为两类: 对化学物质及其变化的实验探究和对化学物质及其变化的应用研究。 而且, 在实验手段上, 更加体现了其多元化与现代化。随着科学技术的发展, 现代信息技术在教育中的应用越来越广泛。由于手持技术在化学实验中应用的特点与新课标下化学实验的特点相吻合, 这使得这一新型技术在化学实验中的应用具有广泛的空间。 探究性化学实验的数目大量增加, 能更好地培养学生的创新能力和探究精神, 提高他们的动手能力, 丰富其科学素养。
手持技术不仅可以应用于化学演示实验, 如金属氧化物对过氧化物分解速率的影响, 还可以应用于研究性实验和实验的开发研究中, 如胃药疗效的测定分析、 浓度对盐类水解的影响等。
总之, 把手持技术融入化学实验中, 能使学生学会如何进行探究性实验学习; 学会合作学习, 培养科学严谨的态度和对社会的责任感; 学会从定量的角度分析和解决问题, 探求变量之间的因果关系和相关关系, 发展了学生的问题解决能力, 真正体现了新课标教育思想。
4、手持技术在化学教学应用中存在的问题:
手持技术在 国内作为一种新生的技术,把其应用于化学教学中还存在不少的问题。手持技术在中学化学教学中以实验的形式发挥其教育功能。但是很多学校实验室都没有配置有手持技术设备(比如我所在的东莞的某间市级高中,这次也是我第一次听到关于手持技术实验的信息),有些学校及时配备有手持技术设备,也往往由于种种原因,只把它们当成摆设,而没有充分发挥手持技术的功能和价值。同时还有不少其它问题:比如手持技术实践理论的缺乏、手持技术本身在技术上存在的不足、手持技术教育功能的认识不足等。
手持技术的广泛应用,我觉得需要研发人员、学校和教师等多方面做出努力。特别是我们这些新一代的化学教师也应该多了解手持技术的应用,掌握必要的手持技术知识和技能等,思考如何更好地充分地发挥手持技术在化学实验教学中的广泛用途。
【参考文献】
[1]高中化学实验中手持技术的应用.四川师范大学化学与材料科学学院.叶春峰,蔡军,曾玲,薛卫东.《教学与管理》.2006.4.20.P129-130
[2]手持技术在酸碱滴定中的应用研究.邓峰,钱扬义,林耿勉.华南师范大学化学与环境学院.《Educational Equipment And Experiment》.Vol.23,No.1,January 2007..P12-14
[3]手持技术与化学生活——如何明智选择食醋.郑逸萍,钟明华,黄燕璇,张泽玲.韩山师范学院化学系
[4]手持技术在化学教学应用中存在的问题及对策研究.张贤金,黄静,黄新颖.华东师范大学化学系,福建师范大学附属中学. 《Educational Equipment And Experiment》.Vol.25,No.4, 2007.P9-11
第二篇:酸碱中和滴定实验报告
酸碱中和滴定实验报告
时间:
组别: 第 组 指导教师: 组长: 组员:
一、实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、0.1000mol/L盐酸(标准液)、未知浓度的NaOH溶液(待测液)、酚酞(变色范围8~10)、甲基橙(3.1~4.4)
四、实验步骤
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次
3、量取:用碱式滴定管量出一定体积的未知浓度的NaOH溶液,注入锥形瓶中,并往
锥形瓶中滴加几滴酚酞,现象为 。用酸式滴定管量取标准液盐酸,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位。

(二)滴定阶段
1、把锥形瓶放在酸式滴定管的下面,将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴盐酸后溶液变为无色且半分钟内不恢复原色。此时,氢氧化钠恰好完全被盐酸中和,达到滴定终点。记录滴定后液面刻度V2。
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复2~3次。
(三)数据处理
注意:取两次测定数值的平均值,计算待测液的物质的量浓度
(四)误差分析
1、来自滴定管产生的误差:
①滴定管用蒸馏水洗后,未用标准液润洗 ②滴定管未用待测液润洗
③盛标准液的滴定管滴定前有气泡,滴定后无气泡
④盛标准液的滴定管滴定前无气泡,滴定后有气泡
⑤盛待测液的滴定管滴定前有气泡,滴定后无气泡
2、来自锥形瓶中产生的误差
锥形瓶用蒸馏水洗后又用待测液润洗
3、读数带来的误差
如:标准液读数时 ①先俯视后仰视 ②先仰视后俯视
课后巩固:
1、进行中和滴定时,事先不应该用所盛溶液润洗的仪器是( )
A、酸式滴定管 B、碱式滴定管 C、锥形瓶 D、量筒
2、准确量取25.00mL 高锰酸钾溶液,可选用的仪器是( )
A、50mL量筒 B、10mL量筒
C、50mL酸式滴定管 D、50mL 碱式滴定管
3、有一支50mL的酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处,把滴定管中的溶液全都流下排出,承接在量筒内,量筒中溶液的体积 ( )
A、大于40.0mL B、为40.0mL C、小于40.0mL D、为10.0mL
4、用0.1mol/L的氢氧化钠溶液测定某浓度的浓硫酸,其实验步骤如下:
1.配制稀硫酸溶液100mL,操作方法是:在___ _里盛适量蒸馏水,用___ _滴定管取1mL浓硫酸,使其缓缓沿烧杯内壁注入盛有适量蒸馏水的___ ____中,并用___ __搅拌,以达___ __的目的。将___ __后的溶液沿____ __注入___ ___中,用蒸馏水洗涤___ _和___ _2~3次,洗液都注入____ __中,振荡摇匀后,将水注入___ __,直至液面接近刻度线___ _处,改用____ __加水至___ ___。盖好瓶塞,振荡摇匀后,转移至贴有标签的试剂瓶中。
2.滴定:用酸式滴定管取10mL稀硫酸,注入___ _中,滴入3至5滴酚酞并摇匀后,用0.1mol/L的氢氧化钠溶液滴定,直到加入最后一滴氢氧化钠,刚好使溶液___ _,即达滴定终点。
3.记录和计算:求:稀释前后硫酸物质的量的浓度。
4.讨论:
①碱式滴定管在盛氢氧化钠溶液前要先用___ _洗净再用__ __润洗,盛待测硫酸溶液的容器是__ __,容器在盛稀硫酸前,要用_ ___洗。
②碱式滴定管未用标准碱溶液洗,只用水洗,立即注入氢氧化钠溶液,将会使测定的稀硫酸浓度___ _(偏高、偏低、不受影响,下同)。
③滴定前,盛稀硫酸的容器水洗后,用稀硫酸润洗,再盛稀硫酸10mL,再用标准氢氧化钠溶液滴定,将会使测定硫酸溶液的浓度结果___ _。
④滴定前碱式滴定管内无气泡,后因操作不当进了气泡,测定结果,使稀硫酸的浓度_。
⑤盛稀硫酸的容器内盛10mL稀硫酸后,再加入10mL水后滴定,则测定结果,硫酸溶液浓度将___ _。
⑥滴定前平视读数,滴定终点时,仰视读数,并记录读数,测得的硫酸溶液浓度将___ _。
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定实验报告
酸碱中和滴定实验一所用仪器酸式滴定管碱式滴定管和锥形瓶1酸式滴定管和碱式滴定管的构造对比不同点及其原因2对比滴定管和量筒刻度的不同…
-
酸碱中和滴定实验操作方法
酸碱中和滴定实验报告班级姓名学号合作者日期一实验目的用已知浓度溶液标准溶液本实验NaOH为标准溶液测定未知溶液待测溶液浓度本实验盐…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…
-
酸碱中和滴定实验报告
酸碱中和滴定实验报告酸碱中和滴定实验报告时间组别第组指导教师组长组员一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶…
-
酸碱滴定实验报告
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定一实验目的1培养同学们通过实验手段用已知测未知的实验思想2学习相关仪器的使用方法掌…
-
酸碱中和滴定实验报告[1]
NaOH滴定HAc的实验报告一实验目的测量未知溶液的浓度二实验原理三实验仪器和药品酸式滴定管碱式滴定管锥形瓶铁架台滴定管夹NaOH…
-
酸碱中和滴定 实验报告
实验名称酸碱中和滴定时间实验分组桌号合作者指导老师一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实…
-
分析化学实验 碱度的测定 实验报告
实验报告姓名班级同组人项目碱度的测定课程分析化学学号一实验目的1掌握酸碱滴定法测定碱度的原理和方法2掌握碱度测定结果的计算3熟练滴…