酸碱中和滴定、化学反应速率和化学平衡实验报告
酸碱中和滴定实验报告(一)
一:实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二:实验仪器:酸式滴定管、碱式滴定管、锥形瓶、铁架台(含滴定管夹)。
实验药品: 0.1000mol/L盐酸(标准溶液)、未知浓度的NaOH溶液(待测溶液)、
酸碱指示剂:酚酞(变色范围8~10)或者甲基橙(3.1~4.4)
三:实验原理: c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
【本实验具体为:c(H+)×V(酸) = c(OH-)×V(碱)】
四:实验过程:
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水(具体方法: 酸式滴定管,将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。有漏必须在活塞上涂抹凡士林,注意不要涂太多,以免堵住活塞口。 碱式滴定管检漏方法是将滴定管加水,关闭活塞。静止放置5min,看看是否有水漏出。如果有漏,必须更换橡皮管。)
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次。锥形瓶用蒸馏水洗净即可,不得润洗,也不需烘干。
3、量取:用碱式滴定管量出一定体积(如20.00ml)的未知浓度的NaOH溶液(注意,调整起始刻度在0或者0刻度以下)注入锥形瓶中。用酸式滴定管量取标准液盐酸,赶尽气泡,调整液面,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位 。
(二)滴定阶段
1、把锥形瓶放在酸式滴定管的下面,向其中滴加1—2滴酚酞(如颜色不明显,可将锥形瓶放在白瓷板上或者白纸上)。将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴盐酸后溶液变为无色且半分钟内不恢复原色。此时,氢氧化钠恰好完全被盐酸中和,达到滴定终点。记录滴定后液面刻度V2。
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复2~3次。
(三)实验记录 (由于时间关系,本次实验只做一次)

(四).实验数据纪录:

(五)实验结果处理:c(待)=c(标)×V(标)/ V(待) 注意取几次平均值。
温度和催化剂对化学反应速率的影响实验(二)
一:实验目的:通过其它条件不变,只单独改变温度或使用催化剂来测定其反应现象出现
的时间长短而估测反应速率的大小,然后得出温度和催化剂对化学反应速度率的影响
二:实验仪器:试管、试管架、胶头滴管、10ml量筒、烧杯、热水、木条、火柴。温度计
实验药品:0.1mol/LNa2S2O3,0.1mol/LH2SO4,10%H2O2, 0.1mol/LFeCl3,
0.1mol/LCuSO4,MnO2.
三:实验过程
1)温度对化学反应速度率的影响实验

2)催化剂对化学反应速率的影响实验(每支试管取2ml5%H2O2溶液三支,分别加入下列物质

影响化学平衡的因素及铁离子、亚铁离子的相互转化和检验实验(三)
一:实验目的:通过其它条件不变,只单独改变温度或使用催化剂来测定其反应现象出现
的时间长短而估测反应速率的大小,然后得出温度和催化剂对化学反应速度率的影响
二:实验仪器:试管、试管架、胶头滴管、10ml量筒、烧杯、热水、密封的NO2连通管
实验药品:饱和的氯化铁,0.005mol/LFeCl3,0.01mol/LKSCN,1mol/LKSCN,
0.01mol/LNaOH, 氯水,0.1mol/LFeCl2 ,氯化铝溶液,碳酸钠溶液 铁粉
0.1mol/LCuSO4,MnO2.PH试纸。
三:实验过程
1)温度对化学平衡的影响实验

2)浓度对化学反应平衡的影响实验
向盛有2ml 0.005mol/LFeCl3溶液的试管中加入2ml 0.01mol/LKSCN溶液,溶液呈红色,
把上述试管中溶液均分置于两支试管中;进行下述操作。

四:铁离子、亚铁离子的相互转化
1)取一支试管加入2ml氯化铁溶液,然后加入还原性铁粉,观察现象
其反应方程式: 。
2)用两支试管分别取2ml0.1mol/LFeCl2 分别滴入KSCN约1到2滴,然后在第二支中加入氯水,观察现象 其反应方程式: ,离子方程式: 。
五:盐类水解实验
1)把PH试纸放到点滴板上,然后用玻璃棒沾取氯化铝溶液点到PH试纸上,其PH为 ,用化学方程式分析原因: 。
2)另取一张PH试纸放到点滴板上,然后用玻璃棒沾取碳酸钠溶液点到PH试纸上,其PH为 ,用化学方程式分析原因: 。
中和滴定的误差分析
1、来自滴定管产生的误差:
①滴定管用蒸馏水洗后,未用标准液润洗 ②滴定管未用待测液润洗
③盛标准液的滴定管滴定前有气泡,滴定后无气泡
④盛标准液的滴定管滴定前无气泡,滴定后有气泡
⑤盛待测液的滴定管滴定前有气泡,滴定后无气泡
2、来自锥形瓶中产生的误差
锥形瓶用蒸馏水洗后又用待测液润洗
3、读数带来的误差
如:标准液读数时 ①先俯视后仰视 ②先仰视后俯视
习题:
1.滴定:用酸式滴定管取10mL稀硫酸,注入___ _中,滴入3至5滴酚酞并摇匀后,用0.1mol/L的氢氧化钠溶液滴定,直到加入最后一滴氢氧化钠,刚好使溶液___ _,即达滴定终点。
2.①碱式滴定管在盛氢氧化钠溶液前要先用___ _洗净再用__ __润洗,盛待测硫酸溶液的容器是__ __,容器在盛稀硫酸前,要用_ ___洗。
②碱式滴定管未用标准碱溶液洗,只用水洗,立即注入氢氧化钠溶液,将会使测定的稀硫酸浓度___ _(偏高、偏低、不受影响,下同)。
③滴定前,盛稀硫酸的容器水洗后,用稀硫酸润洗,再盛稀硫酸10mL,再用标准氢氧化钠溶液滴定,将会使测定硫酸溶液的浓度结果___ _。
④滴定前碱式滴定管内无气泡,后因操作不当进了气泡,测定结果,使稀硫酸的浓度_。
⑤盛稀硫酸的容器内盛10mL稀硫酸后,再加入10mL水后滴定,则测定结果,硫酸溶液浓度将___ _。
⑥滴定前平视读数,滴定终点时,仰视读数,并记录读数,测得的硫酸溶液浓度将___ _。
第二篇:实验三草酸合铁(III)酸钾的制备和组成测定2齐齐哈尔大学化学专业 实验报告无机部分
齐 齐 哈 尔 大 学
实 验 报 告
题 目:三草酸合铁(III)酸钾的制备和组成测定
学 校:_齐齐哈尔大学__
专业班级:_化学101__ _
学生姓名: ____叶梦_____
同组者姓名:___苟登红____
成 绩:___________
2013 年 10 月 9 日
实验5 三草酸合铁(III)酸钾的制备和组成测定
实验目的
1 掌握合成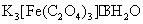 的基本原理和操作技术;
的基本原理和操作技术;
2 加深对铁(III)和铁(II)化合物性质的了解;
3 掌握容量分析等基本操作。
实验原理
三草酸合铁(III)酸钾(含三个结晶水)为翠绿色单斜晶体,易溶于水且难溶于乙醇,受光易分解。
本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(III)草酸配合物。主要反应为

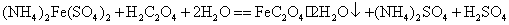
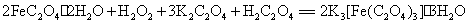
改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁(III)酸钾,通过化学分析确定配离子的组成。用高锰酸钾标准溶液在酸性介质中滴定测得草酸根的含量。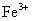 含量可先用过量镁粉将其还原为
含量可先用过量镁粉将其还原为 ,然后再用高锰酸钾标准溶液滴定而测得,其反应式为
,然后再用高锰酸钾标准溶液滴定而测得,其反应式为

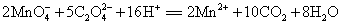
仪器与实验药品
托盘天平;分析天平;抽滤装置;烧杯;电炉;移液管;容量瓶;锥形瓶;量筒;试管;表面皿;玻璃棒;滤纸;点滴板;恒温水浴槽;恒温干燥箱。
铁屑;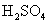 (3mol/L);Na2CO3 (0.1mol/L);硫酸铵;
(3mol/L);Na2CO3 (0.1mol/L);硫酸铵; 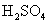 (1mol/L);
(1mol/L);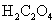 (饱和);
(饱和);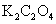 (饱和);KCl;
(饱和);KCl;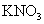 (300g/L);乙醇(95%);
(300g/L);乙醇(95%);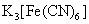 (5%);
(5%);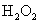 (3%);镁粉;
(3%);镁粉; ;高锰酸钾。
;高锰酸钾。
实验步骤
1. 草酸亚铁的制备
称取5g硫酸亚铁铵固体放在250ml烧杯中,然后加15ml蒸馏水和5~6滴1mol/L的硫酸。
加热溶解后,再加入25ml饱和草酸溶液,加热搅拌至沸,同时不断搅拌,防止飞溅。
维持微沸4min后,停止加热,取少量清液于试管中、煮沸,如还有沉淀还需加热,直到没有沉淀为止,将溶液静置。
带黄色晶体析出后倾析,弃去上层清液,用总量20ml的蒸馏水分三次用倾泻法洗涤晶体,搅拌并温热、静置,弃去上层清液,即得黄色晶体草酸亚铁。
2 三草酸合铁(III)酸钾的制备
往草酸亚铁沉淀中加入饱和草酸钠溶液10毫升,水浴加热40℃,恒温下慢慢滴加3%的过氧化氢溶液20毫升,沉淀转为深棕色。
边加边搅拌,加完后取一滴所得悬浊液于点滴板中,加一滴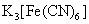 溶液,如有蓝色出现,则还需要加过氧化氢溶液,至检测不到
溶液,如有蓝色出现,则还需要加过氧化氢溶液,至检测不到 。
。
将溶液加热至沸,然后加入20ml饱和草酸溶液,沉淀立即溶解,溶液转为绿色。
趁热过滤,滤液转入100ml烧杯中,加入95%的乙醇25ml,加入几滴硝酸钾,均匀后冷却,可以看到烧杯底部有晶体析出。
晶体完全析出后,抽滤,将固体至于一表面皿上,放在恒温干燥箱中干燥。
得透明的绿色晶体,称重,计算产率。
3 高锰酸钾溶液的标定
准确称取0.13~0.17g草酸钠两份,分别置于250ml锥形瓶中。分别加水50ml使其溶解,加入10ml3mol/L硫酸溶液。
在水浴上加热到75~85℃,趁热用待标定的高锰酸钾溶液滴定。滴定至溶液呈现为红色并持续30s内不褪色即为终点。
根据每份滴定中草酸钠的质量和消耗的高锰酸钾的体积,计算出高锰酸钾溶液的浓度。
4 草酸根含量的测定
精确称取制得的样品约0.2~0.3g,放入250ml小烧杯中加水溶解后定量转移至250ml容量瓶中,稀释至刻度,摇匀,待测。
分别取2份25ml试液于锥形瓶中,加入25ml水和5ml 1mol/L硫酸溶液,用已标定的高锰酸钾溶液滴定。滴定前先一滴一滴地加入高锰酸钾溶液,然后加热到75~85℃,再用高锰酸钾滴定热溶液,直至微红色在30s内不消失。
记下消耗的高锰酸钾溶液的总体积,计算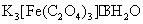 中草酸根的质量分数,并换算成物质的量。
中草酸根的质量分数,并换算成物质的量。
5 铁含量的测定
在上述滴定过草酸根的保留溶液中加镁粉还原,至黄色消失。加热3分钟,使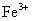 完全转化成
完全转化成 ,过滤,滤液转入250ml容量瓶中,用高锰酸钾滴定至微红色。
,过滤,滤液转入250ml容量瓶中,用高锰酸钾滴定至微红色。
计算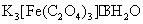 中铁的质量分数,并换成物质的量。
中铁的质量分数,并换成物质的量。
实验结果与讨论
三草酸合铁(III)酸钾的产率=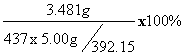 =62.5%
=62.5%
1 高锰酸钾溶液标定的数据处理
根据草酸钠与高锰酸钾的反应计量关系:
2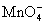 ~5
~5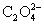 ;
;
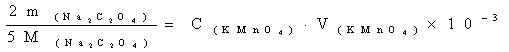
①当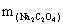 =0.151g,
=0.151g,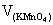 =22.75ml时;
=22.75ml时;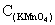 =
=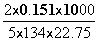 =0.01981mol/L
=0.01981mol/L
②当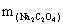 =0.150g,
=0.150g,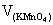 =22.45ml时;
=22.45ml时;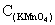 =
=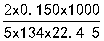 =0.01994mol/L
=0.01994mol/L
③当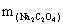 =0.149g,
=0.149g,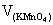 =21.85ml时;
=21.85ml时;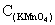 =
=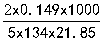 =0.02036mol/L
=0.02036mol/L

表一 高锰酸钾溶液浓度的标定数据处理(M[NaC2O4]=134)
2 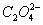 含量测定的数据处理
含量测定的数据处理
根据草酸钠与高锰酸钾的反应计量关系:2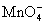 ~5
~5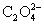 ;所以
;所以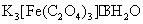 ~3
~3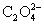 ~
~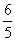
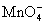 ;所以
;所以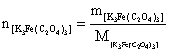
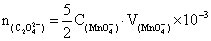
①当m[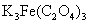 ]=0.0300g;V[
]=0.0300g;V[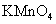 ]=3.40ml时;已知
]=3.40ml时;已知 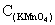 =0.02003mol/L;则n[
=0.02003mol/L;则n[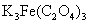 ]=
]=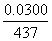 =6.86×
=6.86×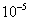 mol; n[
mol; n[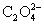 ]=
]=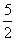 ×0.02003×3.40×
×0.02003×3.40× =1.70×
=1.70×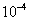 mol
mol
②当m[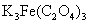 ]=0.0300g;V[
]=0.0300g;V[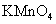 ]=3.45ml时;已知
]=3.45ml时;已知 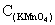 =0.02003mol/L;则n[
=0.02003mol/L;则n[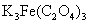 ]=
]=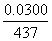 =6.86×
=6.86×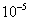 mol; n[
mol; n[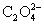 ]=
]=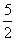 ×0.02003×3.45×
×0.02003×3.45× =1.73×
=1.73×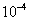 mol
mol
表2 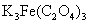 中
中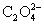 的测定数据处理(M[
的测定数据处理(M[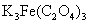 ]=437)
]=437)

③当m[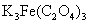 ]=0.0300g;V[
]=0.0300g;V[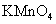 ]=3.35ml时;已知
]=3.35ml时;已知 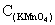 =0.02003mol/L;则n[
=0.02003mol/L;则n[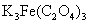 ]=
]=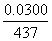 =6.86×
=6.86×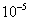 mol; n[
mol; n[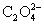 ]=
]=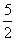 ×0.02003×3.35×
×0.02003×3.35× =1.68×
=1.68×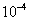 mol
mol
3  含量测定的数据处理
含量测定的数据处理
根据 与高锰酸根反应计量关系得出5
与高锰酸根反应计量关系得出5 ~
~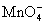 ;
; ~
~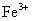 所以n[
所以n[ ]=5C[
]=5C[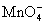 ]
] V[
V[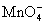 ]×
]×
①当V[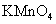 ]=0.26ml时,n[
]=0.26ml时,n[ ]=5×0.02003×0.26×
]=5×0.02003×0.26× =2.60×
=2.60×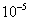 mol
mol
②当V[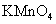 ]=0.25ml时,n[
]=0.25ml时,n[ ]=5×0.02003×0.25×
]=5×0.02003×0.25× =2.50×
=2.50×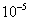 mol
mol
③当V[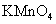 ]=0.27ml时,n[
]=0.27ml时,n[ ]=5×0.02003×0.27×
]=5×0.02003×0.27× =2.70×
=2.70×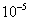 mol
mol
表3 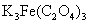 中
中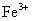 的测定数据处理(M[
的测定数据处理(M[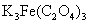 ]=437)
]=437)

在草酸根含量测定中,称取0.300g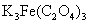 配成250ml溶液,移取25ml滴定。
配成250ml溶液,移取25ml滴定。
在1mol产品中含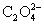 2.48mol,
2.48mol,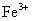 0.38mol,该物质的化学式为
0.38mol,该物质的化学式为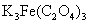 。
。
思考题
1 能否用 代替硫酸亚铁铵来合成
代替硫酸亚铁铵来合成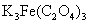 ?这时可用硝酸代替过氧化氢做氧化剂,写出用硝酸做氧化剂的主要反应式。你认为哪个做氧化剂较好?为什么?
?这时可用硝酸代替过氧化氢做氧化剂,写出用硝酸做氧化剂的主要反应式。你认为哪个做氧化剂较好?为什么?
答:能;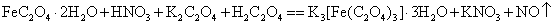
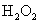 做氧化剂好,没有引入其它杂质,不污染环境。
做氧化剂好,没有引入其它杂质,不污染环境。
2 根据三草酸合铁(III)酸钾的合成过程及它的TG曲线,你认为该化合物该如何保存?
答:三草酸合铁(III)酸钾受光易分解,易溶于水,应保存在棕色试剂瓶中且置于阴凉干 燥处。
3 在三草酸合铁(III)酸钾制备过程中,加入15ml饱和草酸溶液后,沉淀溶解,溶液转为绿色。若此溶液中加入25ml95%乙醇或将此溶液过滤后往滤液中加入25ml95%乙醇,现象有何不同?为什么?并说明对产品质量有何影响。
答:若不过滤就加入乙醇,则会有杂质参加晶体的形成,使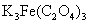
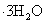 不纯净,而且会有部分铁(II)参与晶体形成,使产品质量增加。
不纯净,而且会有部分铁(II)参与晶体形成,使产品质量增加。
-
化学反应速率 化学平衡实验
实验二十二化学反应速率化学平衡实验日期年月日星期实验用品1试管试管架胶头滴管NO2平衡仪2001molLKMnO4溶液01molL…
-
酸碱中和滴定、化学反应速率和化学平衡实验报告
选修4化学反应原理姓名班级酸碱中和滴定实验报告一一实验目的用已知浓度溶液标准溶液本实验盐酸为标准溶液测定未知溶液待测溶液浓度本实验…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
实验报告:影响化学反应速率和化学平衡的因素研究
实验报告影响化学反应速率和化学平衡的因素的探究班级姓名编号1实验目的实验原理编号2实验目的实验原理编号3实验目的实验原理1编号4实…
-
化学反应速率和化学平衡试题综合训练
化学反应速率和化学平衡试题综合训练1某一反应在一定条件下的平衡转化率为253当使用了催化剂时其转化率为A大于253B小于253C等…
-
化学反应速率、化学平衡知识点总结及练习
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
【人教版】高中化学选修4知识点总结:第二章化学反应速率和化学平衡
第二章化学反应速率和化学平衡一化学反应速率1化学反应速率的概念化学反应速率是用来衡量化学反应进行的快慢程度的物理量2化学反应速率的…
-
高中化学选修4知识点总结:第二章化学反应速率和化学平衡【人教版新课标】
第二章化学反应速率和化学平衡一化学反应速率课标要求1掌握化学反应速率的含义及其计算2了解测定化学反应速率的实验方法要点精讲1化学反…
-
化学反应速率与限度教材分析报告
教材分析报告化学反应速率与反应限度化学111班11240119谢灵君必修二苏教版专题2化学反应与能量转化第一单元化学反应速率与反应…
-
2-实验-化学反应速率和化学平衡
化学20杭州学军中学陈进前编制实验化学反应速率和化学平衡教学目标1知识目标1巩固浓度温度和催化剂对化学反应速率的影响等基本知识加深…
-
大学化学实验 滴定分析基本操作 酸碱浓度的比较 实验报告
滴定分析基本操作及酸碱浓度的比较实验报告实验目的就不写出来了大家肯定都有一实验原理1酸碱指示剂有其变色范围pH甲基橙的变色范围是3…