免疫学实验讲义
实验一 凝集反应
实 验 目 的: 1. 掌握凝集反应的原理
2. 直接凝集反应
3.间接凝集反应
实 验 内 容: 1. 直接凝集反应
2.间接凝集反应
实验原理:当颗粒性抗原与其相应的抗体特异结合时,在电解质存在下,两者比例合适时,可出现凝集颗粒,此现象称凝集反应。
一、直接凝集反应一血型鉴定
人类血型是以红细胞表面所带抗原的不同而命名。红细胞表面主要带A、B两种抗原,人类血清中主要含有两种抗体(抗A或抗B抗体),用抗 A或抗B标准血清可以鉴定四种不同的血型,既A、B、AB、O表型。现介绍玻片直接凝集法。
(一)材料:人抗A和抗B标准血清、生理盐水、被检者红细胞、采血针、试管、载玻片、滴管、皮肤消毒剂。
(二)方法
1、用酒精棉球消毒指端皮肤,针刺受检者指端取血一滴,加入盛有2ml 生理盐水的试管中,制成红细胞悬液(约2%)。
2、 取清洁载玻片,用记号笔划分两半,左角上注 A字,右角上注B字。
3、 于玻片 A侧中央加抗 A型标准血清一滴,于玻片B侧中央加抗B血清一滴。
4、 用滴管取受检者红细胞悬液加入抗A血清及抗B血清中各一滴,摇动玻片使红细胞与血清充分混匀,15~20min后肉眼或低倍镜观察结果,以凝集现象的有无,按下表报告结果。
血型 凝集现象
抗 B标准血清 抗 A标准血清
O - -
A - +
B + -
AB + +
二、间接凝集反应
将可溶性抗原吸附在惰性颗粒载体上,与其相应抗体可发生凝集,称为间接凝集反应。以乳胶吸附猪细小病毒作为抗原,猪细小病毒免疫血清作为抗体,两者相遇,即出现凝集。
(一)材料:作为抗体的猪细小病毒免疫血清、吸附猪细小病毒的乳胶、生理盐水、载玻片等。
(二)方法
1、取洁净载玻片,用记号笔分为两格。
2、用滴管取生理盐水一滴加于玻片右端,再取猪细小病毒的乳胶一滴加于玻片左端。
3、各加一滴作为抗体的猪细小病毒免疫血清,分别混匀。
4、缓慢摇动2~5min,并观察结果。
思考讨论
1、直接凝集反应与间接凝集反应的区别。
实验二 免疫沉淀反应
实 验 目 的: 1. 掌握免疫沉淀反应的原理
2. 琼脂糖双向免疫扩散
实 验 内 容: 1. 琼脂糖双向免疫扩散
实验原理:当可溶性抗原与其相应抗体相遇,在有电解质存在的条件下,二者比例合适可出现肉眼可见的白色沉淀,故名沉淀反应。。
一、琼脂糖双向免疫扩散
在含有电解质的琼脂中,抗原抗体分子互相弥漫扩散,当比例合适时可出现沉淀带。此法可用于分析抗原成分,以及鉴定抗体的纯度等。
(一)材料:1%生理盐水琼脂糖、人IgG、抗人IgG血清、载玻片、打孔器等。
(二)方法
1、将1%盐水琼脂糖加热溶化。
2、取一洁净载玻片,放水平台上,将已熔化的琼脂3~4ml趁热倾注在玻片上制成厚薄均匀的琼脂糖凝胶板。
3、待琼脂凝固后,按图2.1打孔。
4、在中心孔内加入抗人IgG血清。
5、1孔加入空白对照。
6、于2,3,4各孔中分别加入不同浓度的人IgG。
7、将琼脂糖凝胶板放湿盒中,置37℃温箱中24h后,取出观察结果。
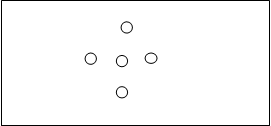

图2.1
实验三 免疫酶技术ELISA
实 验 目 的: 1. 掌握免疫酶技术ELISA的原理
2. 掌握免疫酶技术ELISA的技术
实 验 内 容: 免疫酶技术ELISA
免疫标记技术(immunolabelling techniques)是指用荧光素、放射性同位素、酶、铁蛋白、胶体金及化学(或生物)发光剂等作为示踪物,标记抗体或抗原进行的抗原抗体反应;并借助于荧光显微镜、射线测量仪、酶标检测仪、电子显微镜和发光免疫测定仪等精密仪器,对实验结果直接镜检观察或进行自动化测定,可在细胞、亚细胞、超微结构及分子水平上,对抗原抗体反应进行定性和定位研究;或应用各种液相和固相免疫分析方法,对体液中的半抗原、抗原或抗体进行定性和定量测定。因此,免疫标记技术在敏感性、特异性、精确性及应用范围等方面远远超过一般免疫血清学方法。
根据试验中所用标记物的种类和检测方法不同,免疫标记技术分为免疫酶技术、免疫荧光技术、放射免疫技术、免疫电镜技术、免疫胶体金技术和发光免疫测定。在此基础上发展了生物素-抗生素标记技术。
一、免疫酶技术ELISA
免疫酶技术是利用酶标记抗体或抗原,以检测相应抗原或抗体的一种免疫学标记技术。其原理是酶与抗体或抗原结合后既不改变抗体或抗原的特异性及免疫反应性,也不影响酶的催化效能。当存在相应酶底物时,酶能催化产生有颜色的产物,颜色的有无及深浅能反映相应的抗原或抗体是否存在及其量的多少。
酶联免疫吸附试验(ELISA)是一类常用的免疫酶技术,可用于测定抗体,也可用于检测抗原。该实验常用的酶为辣根过氧化物酶,底物为邻苯二胺(OPD)。实验方法有间接法、双抗体夹心法和抗原竞争法。
一) 材料和试剂:已知人IgG含量的参考蛋白、辣根过氧化物酶标记的抗人IgG抗体、包被液:pH 9.6 0.05mol/L碳酸盐缓冲液、封闭液:10%脱脂奶粉溶液、稀释液:含10%牛血清白蛋白pH 7.4 0.01mol/L PBS、洗涤液:pH 7.4 0.01mol/L PBS-吐温20、底物溶液:OPD-H2O2、终止液:2mol/L H2SO4、96孔酶标反应板。
二) 操作步骤
1、包被:将人IgG用包被液适当稀释至不同浓度,在96孔反应板中每孔加100ml,每个浓度2孔,置370C 2h后再移置40C过夜。
2、 洗涤:将96孔反应倾去包被液,用洗涤液PBS-吐温20加满各孔,置3min,倾去,如此反复3次。
3、 封闭:每孔加200ul的封闭液封闭20-30min,
4、洗涤3次(同上)
5、 加辣根过氧化物酶标记的抗人IgG抗体(其稀释度根据预试结果而定)每孔100ml,(PBS-T20稀释)
6、 370C孵育1h。
7、 洗涤3次(同上)。
8、 显色:加新鲜配制的底物溶液,每孔100ml,在室温下避光放置15min。
9、 终止反应:每孔加2mol/L H2S04 50ml。
10、用肉眼观察每孔颜色深浅或以酶标光度计495nm滤光片测各孔OD值。
三)结果观察与分析
空白对照及阴性对照应无色。
参考蛋白各孔呈棕黄色,并呈明显的颜色深浅梯度。
四)注意事项
1、 在加已稀释的标准抗体时,应从低浓度的第一管开始加,避免将高浓度的抗体带入低浓度的孔中引起误差。
2、 应尽量避免孔中有气泡,以免所测得OD值不准确。
思考讨论:
1、ELISA操作中的注意事项。
2、什么是假阳性与假阴性?ELISA的假阳性与假阴性发生的原因有那些?
实验四 小鼠脾细胞分离、形态观察及计数
实 验 目 的: 1. 掌握小鼠脾细胞分离技术
2. 观察小鼠脾细胞的形态并计数
实 验 内 容: 1. 小鼠脾细胞分离
2.观察小鼠脾细胞的形态并计数
一) 材料和试剂:小鼠、帆布手套、酒精、无菌剪刀、镊子及注射器活塞、一次性小号无菌培养皿、无菌1640液、红细胞裂解液(无菌的8.3%氯化铵溶液,即100克蒸馏水中加8.3克氯化铵)、带盖的无菌离心管、计数板、显微镜、离心机、超净工作台(带紫外灯)、灭菌锅、移液枪及无菌的枪头。
二) 操作步骤
1、小鼠颈椎脱臼处死,75%酒精浸泡3分钟,取出小鼠置于无菌超净台上,左腹侧朝上。
2、在小鼠左腹侧中部剪开小口,撕开皮肤,暴露腹壁,可见红色长条状脾脏。
3、在脾脏下侧提起腹膜,剪开后上翻,暴露脾脏,用镊子提起脾脏,眼科剪分离脾脏下面的结缔组织,取出脾脏。放入盛有1640液的一次性小号无菌培养皿中。
4、用镊子将脾脏表面的粘液等洗去,然后用镊子将脾脏转移到另一盛有少量1640液的一次性小号无菌培养皿中,用注射器活塞轻轻研磨小鼠脾脏,尽量研碎后再加适量的1640液,并用镊子去掉细胞悬液中的粗渣。
5、将细胞悬液转移至带盖的无菌离心管中,1000转/分离心10分钟后,去掉上清。
6、向离心管中加适量的红细胞裂解液(无菌的8.3%氯化铵溶液,即100克蒸馏水中加8.3克氯化铵),使细胞重悬后静置5分钟,1000转/分离心10分钟后,去掉上清。
7、向离心管中加适量的1640液,使细胞重悬。
8、用显微镜观察细胞形态并计数。
注:
1.一般6-8周龄小鼠,根据品系不同,可得5-20×107细胞/只小鼠;
2.手术器械灭菌:术前高压灭菌外,也可将手术器械泡在95%酒精的小容器中,使用前取出器械,在酒精灯上烧灼去除酒精,即可保证无菌,此法较为简便。
思考讨论
1、如何保证分离小鼠脾细胞过程中无微生物污染?
实验五 小鼠的注射方法及血液采集方法
实验目的:练习对小鼠注射的操作方法与小鼠的采血方法
实验内容:小鼠注射的操作方法与小鼠的采血方法
一、材料和试剂
1、实验动物 小鼠
2、溶液或试剂 灭菌的生理盐水(代替实验材料,用以注射)
3、仪器或其它用具 无菌注射器(1ml),剪刀,镊子,碘酒棉花,75%的酒精棉花,消毒干棉花,无菌棉签,无菌棉球,毛细吸管,橡皮吸管头,无菌EP管,一次性手套若干,帆布手套若干。
二、操作步骤
一)小鼠注射:常用的注射途径有皮下、皮内、肌肉、腹腔和静脉等
1、取出无菌注射器及针头,吸入注射材料(本实验以生理盐水代替),并排尽空气(若材料具有传染性,则排气时以消毒棉花包住针头,以免传染材料外溢而污染环境)。
2、皮下注射:将药液推入皮下结缔组织,经毛细血管、淋巴管吸收进入血液循环的过程。作皮下注射常选项背或大腿内侧的皮肤。操作时,戴上手套,用右手拖鼠尾,使其爬行于较粗糙的台面或铁丝试管架的底面,再用左手拇指和食指紧抓小鼠颈部两耳之间的皮肤,将手翻转,使小鼠腹部向上,左手无名指和小指夹住鼠尾和后肢;先用碘酒棉花,后用75%的酒精棉花消毒小鼠腹部皮肤,右手持备好的注射器,针头稍平刺入皮下,把针头轻轻向左右摆动,易摆动则表示已刺入皮下,再轻轻抽吸,如无回血,可缓慢地注射若干生理盐水(注射快慢要适度,以免注射液溢出),注射量约为0.1~0.3ml。拔针时用无菌棉签轻压进针部位片刻,以防止药物外漏。针头拔出后,皮下呈扩散状隆起者为注射正确。
3、皮内注射:将药液注入皮肤的表皮河真皮之间,观察皮肤血管的通透性变化或皮内反应,接种、过敏实验等一般作皮内注射。操作时,戴上手套,1人固定小鼠,另1人先将注射部位的被毛剪掉,局部常规消毒,左手拇指和食指按住皮肤使之绷紧,在两指之间,用注射器针头穿刺,针头进入皮肤浅层,再向上挑起并梢刺入,将生理盐水注入皮内。注射后皮肤出现一白色小皮丘,而皮肤上的毛孔极为明显。注射量为0.1ml/次。拔针时用无菌棉签轻压进针部位片刻,以防止药物外漏。
4、肌肉注射:小鼠体积小,肌肉少,很少采用。当给小鼠注射不溶于水而混悬于油或其他溶剂中的药物时,采用肌肉注射。操作时,戴上手套,1人固定小鼠,另一人用左手抓住小鼠的1条后肢,右手拿注射器。将注射器与半腱肌呈90°角迅速插入1/4,注入生理盐水,用量不超过0.1ml。拔针时用无菌棉签轻轻按住进针部位片刻,以防止药物外漏。
5、腹腔注射:戴上手套,抓取与固定小鼠同皮下注射。使小鼠的头部向下,这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。右手持注射器,进针的动作要轻柔,防止刺伤腹部器官。尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射0.1ml生理盐水,注射完后,缓缓拔出针头,并轻微旋转针头,防止漏液。拔出针头后,用无菌棉签轻压注射部位。
6、静脉注射:将小鼠放在金属笼或鼠夹中,通过金属笼或鼠夹的孔拉出尾巴(也可人工国定小鼠),戴上手套,用左手抓住小鼠尾巴中部。小鼠的尾部有2条动脉和3条静脉,2条动脉分别在尾部的背侧面和腹侧面,3条静脉呈品字型分布,一般采用左右两恻的静脉.拔去沿尾部静脉走向的毛,置尾巴于45~50℃温水中浸泡几分钟或用75%酒精棉球反复擦拭尾部,以达到消毒和使尾部血管扩张及软化表皮角质的目的。行尾部静脉注射时,以左手拇指和食指捏住鼠尾两恻,使静脉更为充盈,用中指从下面托起尾巴,以无名指夹住尾巴的末梢,右手持注射器,使针头与静脉平行(小于30°角),从尾巴的下1/3处进针,开始注入药物时应缓慢,仔细观察,如果无阻力,无白色皮丘出现,说明已刺入血管,可正式注入生理盐水(正常情况下,推注的过程应该没有明显阻力,血管也不会鼓起。推液时动作宜轻柔,若发现血管鼓起,那是针头没有刺入血管,需立即拔出针头。)。有的实验需连日反复尾静脉注射,注射部位应尽可能从尾端开始(但是进针部位也不可以太靠下,因为越往下,静脉越细,操作越难,一般以小鼠尾巴下三分之一的位置比较好),按次序向尾根部移动,更换血管位置注射给药。注射量为0.05~0.1ml/10g体重。拔出针头后,用无菌棉签轻压注射部位1~2min,防止出血。
二)小鼠采血:常用的采血方法有剪尾采血、静脉采血、摘除眼球采血、心脏采血、颌下静脉丛采血。
1、剪尾采血:戴上手套,拇指和食指从背部抓住小鼠颈部皮肤,将小鼠头朝下,小鼠固定后将其尾巴置于50°热水中浸泡数分钟,使尾部血管充盈。擦干尾部,再用剪刀或刀片剪去尾尖1~2mm,用EP管接流出的血液,同时自尾根部向尾尖按摩。取血后用无菌棉球压迫止血并用6%液体火棉胶涂在伤口处止血。每次采血量0.1ml。此方法无需麻醉、创伤小、可重复采血,是一种简便、安全、快速的采血方法。
2、静脉采血:戴上手套,固定小鼠,将采血注射针头刺入颌下静脉丛血管取血,每次采血量可达到0.3-0.5 ml。此方法无需麻醉、创伤小、采血量大并可重复采血,是一种简便、安全、快速、采血量多的采血方法。
3、摘除眼球采血:戴上手套,左手抓住小鼠颈部皮肤,轻压在实验台上,取侧卧位,左手食指尽量将小鼠眼周皮肤往颈后压,使眼球突出。用眼科弯镊迅速夹去眼球,将鼠倒立,用器皿接住流出的血液。采血完毕立即用无菌纱布压迫止血。每次采血量0.1~0.6ml。
4、心脏采血:戴上手套,小鼠仰卧位固定,剪去胸前区被毛,皮肤消毒后,用左手食指在左侧第3~4肋间触摸到心搏处,右手持带有4~5号针头的注射器,选择心搏最强处穿刺,当刺中心脏时,血液会自动进入注射器。每次采血量0.5~0.6ml。
5、断头采血:戴上手套,右手用剪刀剪断小鼠颈部约1/2~4/5,让血液流入试管。此法可采血0.8~1.2ml。
6、颌下静脉丛采血:徒手固定法:将小鼠固定在左手中。在小鼠头部下颌部准确把握颌下静脉丛血管位置(位于下颌骨后方咬肌边缘)。酒精棉球擦拭采血部位消毒后, 将灭菌注射针头迅速刺入颌下静脉丛血管,血液即流出。采血结束, 立即用灭菌干棉球压迫止血。每次采血量0.5ml, 可重复采血。
注:
1.避免小鼠咬人,避免针头等器械伤人;
2.注射前要注意调整好注射器,在装好针头吸取注射液后,一定要排除空气,特别是注射粘性材料,如油包水乳剂时更为重要,假如有气泡存在,它将被皮肤对注射的阻力所挤压,而引起注射释放量减少,也会使残余的注射液在拔出针头时渗漏出来;
3.采血的注射器与针头及盛血的容器最好用干热灭菌法,因为如果带有水分会溶解红细胞,若用高压蒸气灭菌法,在灭菌后一定要烘干。
思考讨论:
1、如何抓小鼠既避免小鼠咬人,由使它不乱动?
2、如果注射传染性材料,应注意哪些?
3、采血所用的注射器和容器要注意些什么?
第二篇:免疫学应用实验1






-
医学免疫学CDC实验报告
CDC实验一实验原理细胞表面抗原与相应的抗体IgG13或IgM特异性结合形成的免疫复合物可通过经典途径激活补体形成攻膜复合体而导致…
-
39份 医学免疫学实验报告
医学免疫学实验报告院系基础医学院专业临床医学五年制年级20xx级班级五年八班姓名学号我的大学我的同学日期20xx年星期五1实验目的…
-
《医学免疫学与微生物学》实验报告
医学免疫学与微生物学实验报告实验一实验名称沉淀反应实验目的通过单向琼脂扩散测定待测血清Ig含量实验材料离子琼脂白喉类毒素白喉抗毒素…
-
医学免疫学实验教案
医学免疫学课程实验教案实验一实验名称E玫瑰花环形成实验计划学时4学时实验目的与要求1掌握人T淋巴细胞形成E花环的实验原理和操作方法…
-
医学免疫学实验
第一章免疫学概要12机制34生长567TCRTCR即T细胞抗原受体是T细胞表面特异性识别和结合抗原的结构SIg即B细胞表面的膜免疫…
-
工程竣工监理工作总结
尊敬的各位领导、各位专家、各位来宾:新建工程经参建单位的共同努力,顺利完工。在此,我代表本工程监理公司项目部,将本工程监理工作情况…
-
户外竞技活动总结
为了充分展示我校教职工良好的精神与面貌,增强团队的凝聚力,11月x日下午,我校12名教职工参加了由海南广播电视总台文体频道与盛高海…
-
食品安全知识宣传教育活动总结
根据上级有关部门的文件精神和区教育局关于食品安全知识宣传教育的要求,我校认真组织部署,围绕宣传活动主题,突出宣传重点,有计划、有步…
-
学校实施素质教育工作总结
李寨二中20xx-20xx学年第一学期实施素质教育工作总结一学期来,我校在各级教育主管部门的正确领导下,在全体教职员的工的共同努力…
-
20xx年春季学期个人工作总结
两河口小学邓平我们每一个教师每一年都会有所收获,每一年中,自己的成长的历程都需要我们付出心血和汗水,才能获得丰硕的果实。我是一名极…