实验二:乙醇的蒸馏及沸点的测定
实验二:乙醇的蒸馏及沸点的测定
一、实验目的
1.了解蒸馏提纯液体有机物的原理、用途。
2.掌握蒸馏提纯液体有机物的操作步骤。
3.了解沸点测定的方法。
4.了解折光率测定的方法和意义。
二、实验原理
将液体加热至沸,使液体变为气体,然后再将蒸气冷凝为液体,这两个过程的联合操作称为蒸馏。
蒸馏是分离和纯化液体有机混合物的重要方法之一。当液体混合物受热时,由于低沸点物质易挥发,首先被蒸出,而高沸点物质因不易挥发或挥发的少量气体易被冷凝而滞留在蒸馏瓶中,从而使混合物得以分离。蒸馏法提纯工业乙醇只能得到95%的乙醇,因为乙醇和水形成恒沸化合物(沸点78.1℃),若要制得无水乙醇,需用生石灰、金属钠或镁条法等化学方法。
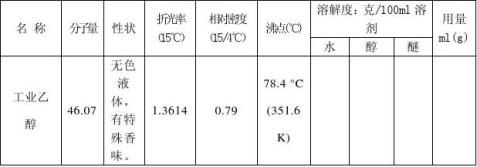
三、主要试剂及产品的物理常数:(文献值)
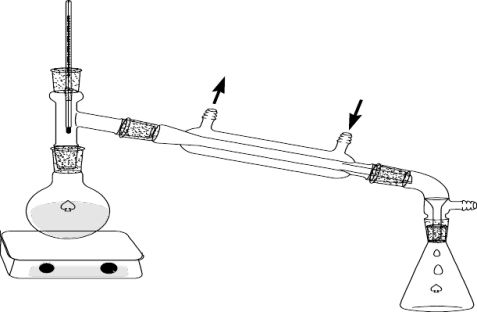
四、实验装置图
六、数据处理
实际产量=
回收率=
nDt =
nD20=
七、思考题:
1
1.什么叫沸点?液体的沸点和大气压有什么关系?
2.蒸馏时加入沸石的作用是什么?如果蒸馏前忘记加沸石,能否立即将沸石加至将近沸腾的液体中?当重新蒸馏时,用过的沸石能否继续使用?
3.如果液体具有恒定的沸点,那么能否认为它是单纯物质?
五、操作流程和实验记录
工业乙醇 + 沸石 +
蓝墨水
时间 实验记录:
100ml圆底烧瓶
工业乙醇=? 沸石=? 蓝墨水=?
第一滴馏出液流出时t1=?℃

工业乙醇
蒸馏结束时t2=?℃
沸程?(后馏分的起始温度)
称量

前馏分=总重-瓶重 后馏分=总重-瓶重
2
产品状态? nDt=?
第二篇:实验4 简单蒸馏
实验四 简单蒸馏
一、实验目的
1、学习蒸馏的基本原理及其应用
2、掌握简单蒸馏的实验操作技术
二、预习要求
理解蒸馏的定义;了解沸程的定义;了解简单蒸馏的用途;什么样的组分的分离才能采用蒸馏的方法;了解冷凝管的种类和使用范围;掌握什么是止爆剂及其止爆原因;掌握有机实验装置搭配顺序和标准;思考在本实验中如何防止火灾、玻璃仪器炸裂、倒吸等实验事故的发生。
三、实验原理
蒸馏就是将液体混合物加热至沸腾使液体汽化,然后将蒸汽冷凝为液体的过程。通过蒸馏可以使液态混合物中各组分得到部分或全部分离,所以液体有机化合物的纯化和分离、溶剂的回收,经常采用蒸馏的方法来完成。通常蒸馏是用来分离两组分液态有机混合物,但是采用此方法并不能使所有的两组分液态有机混合物得到较好的分离效果。当两组分的沸点相差比较大(一般差20~30℃以上)时,才可得到较好的分离效果。另外,如果两种物质能够形成恒沸混合物也不能采用蒸馏法来分离。
利用蒸馏法还可以来测定较纯液态化合物沸点。在蒸馏过程中,馏出第一滴馏分时的温度与馏出最后一滴馏分的温度之差叫做沸程。纯液态化合物的沸程较小、较稳定,一般不超过0.5~1℃。沸程可以代表液态化合物的纯度,一般说来纯度越高,沸程较小。
用蒸馏法测定沸点的方法叫常量法,此法用量较大,一般要消耗样品10ml以上。
四、仪器和试剂
铁架台(铁夹、铁圈)、酒精灯、石棉网、蒸馏烧瓶、蒸馏头、直形冷凝管、温度计、温度计套管(或单孔橡皮塞)、尾接管、接液瓶、量筒、橡皮管、沸石;
无水乙醇、蒸馏水、工业酒精
五、实验内容
(一)蒸馏装置简介
实验室的蒸馏装置如图4-1所示。主要包括下列三个部分:
1、蒸馏部分 主要包括铁架台、热源(如酒精灯等)、蒸馏烧瓶(带支管和不带支管两种)、蒸馏头、温度计等仪器。蒸馏过程中,液体在蒸馏烧瓶内受热气化、蒸气经支管进入冷凝管。支管与冷凝管靠单孔橡皮塞相连(若使不带支管的蒸馏烧瓶则是用蒸馏头),支管伸出塞子外约2~3 cm。
2、冷凝部分 主要仪器是冷凝管,其作用是使蒸气在冷凝管中冷凝成为液体。常用的冷凝管有四种,即空气冷凝管、直形冷凝管、蛇形冷凝管、球形冷凝管(见前)。常根据不同的沸点范围来选择适当的冷凝管。一般说来,液体的沸点高于130℃的用空气冷凝管,沸点在70℃~130℃之间时用直形冷凝管或球形冷凝管,液体沸点低于70℃时,用蛇形冷凝管(蛇形冷凝管要垂直装置)。冷凝管下侧管为进水口,用橡皮管接自来水龙头,上侧管为出水口,用橡皮管套接将水导入水槽。上端的出水口朝上,才可保证套管内充满着水,才会有更好的冷凝效果。
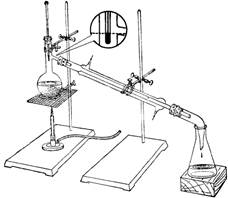
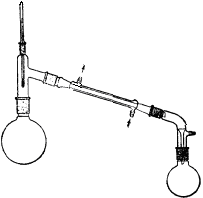
图4-1蒸馏装置(右边为标准磨口玻璃仪器)
3、接液部分 主要包括尾接管或真空尾接管、接液瓶。当蒸馏低沸点或毒性较强的液体时,应采用真空尾接管,在其支管上套上橡皮管并倒入下水道或通风橱口。常用接液瓶是三角烧瓶或圆底烧瓶,应与外界大气相通。
(二)蒸馏装置的安装
安装有机化学实验装置总的原则是从下到上,从左往右,由简到繁。
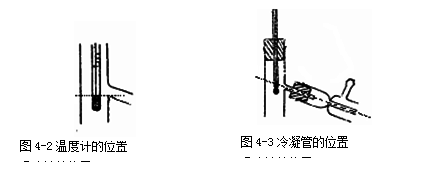
在铁架台上放置一酒精灯,用酒精灯火焰高度来调节石棉网的位置。取—个干燥的蒸馏烧瓶,用铁夹在靠近瓶口的瓶颈部分,并固定在铁架台上,使蒸馏烧瓶的底部在石棉网上方1~2 mm。瓶口配一个单孔橡皮塞(若为标准磨口仪器则此处采用配套的蒸馏头和温度计套管即可),插入适当量程、分度的温度计,调整温度计的位置务必使在蒸馏时水银球完全被蒸气所包围,才能正确地测得蒸气的温度。通常是使水银球的上边缘恰好与蒸馏烧瓶支管接口的下边缘在同一水平线上,如图4-2所示。
在支管处套上一个适合于冷凝管口的单孔橡皮塞。先将选定的冷凝管的两侧管口接上橡皮管,然后用另一铁架台上的铁夹夹住冷凝管的重心部位(约中上部),调整固定器的位置(即使铁夹的位置上下移动),务必使冷凝管和蒸馏烧瓶的支管在同尽可能一直线上,如图4-3所示。然后松开冷凝管上的铁夹,使冷凝管在此直线上移动与蒸馏烧瓶相连后,旋转冷凝管使其侧管一个朝上、一个朝下,再固定铁夹。下侧管接自来水龙头,上侧管将水导入水槽。
在冷凝管下端口处套上一个适合于尾接管口的单孔橡皮塞,再接上尾接管和接液瓶。由于尾接管没有固定装置,容易滑下,所以蒸馏过程中要特别小心。接液瓶应与外界大气相通,高度不够时可以垫上垫板。
(三)蒸馏操作
1、检漏 仪器安装好后,应认真检查仪器各部位连接处是否严密,是否为封闭体系。
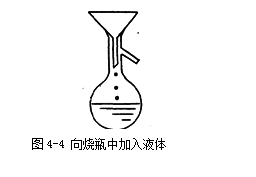
2、加料 检漏后,取下蒸馏烧瓶上口的塞子(或温度计套管),加入数粒止暴剂[1](又叫助沸物或沸石),将待蒸馏液体通过玻璃漏斗倒入蒸馏烧瓶,注意漏斗的尖嘴部分的位置,如图4-4所示。塞好带温度计的塞子,再仔细检查一遍装置是否正确,各仪器之间的连接是否紧密,有没有漏气[ 2 ]。
3、加热 加热前,先慢慢打开水龙头,使冷却水充满冷凝管,并引入水槽。放好热源后开始加热[3]。先用小火加热,以免蒸馏烧瓶因局部过热而炸裂,再慢慢增大火力,可以看到蒸馏瓶中液体逐渐沸腾,蒸气上升,温度计读数略有上升。当蒸气到达温度计水银球部位时,温度计读数急剧上升。这时应稍稍调小火焰,使加热速度略为下降,蒸气停留在原处,使瓶颈和温度计充分受热,让水银球上液滴和蒸气温度达到平衡,然后又稍加大火焰精选蒸馏。
控制加热以调节蒸馏速度,一般以每秒蒸出1~2滴为宜。蒸馏过程中,温度计水银球上常有液滴并且比较匀速的滴下,此时的温度即为液体与蒸气达到平衡时的温度,温度计的读数就是液体(馏分)的沸点。
蒸馏时火焰不能太大,否则会在蒸馏瓶的颈部造成过热现象,使部分液体的蒸气直接接受了火焰的能量,这样测得值会偏高;反之,加热火焰太小,蒸气达不到支管口处,温度计的水银球不能为蒸气充分润湿而使测得值偏低或不规则。
4、收集馏分 在达到收集物的沸点之前,常有沸点较低的液体先蒸出。这部分馏液称为“前馏分”。蒸完前馏分温度趋于稳定后,馏出的就是较纯物质,这时应更换接液瓶。记下开始馏出和最后一滴时的温度,就是该馏分的沸程。当某一组分蒸完后,这时若维持原来温度就不会再有馏液蒸出,温度会突然下降。遇到这种情况,应停止蒸馏。
蒸馏操作中,即使杂质(或某一组分)含量很少,也不要蒸干。由于温度升高,被蒸馏物可能发生分解,影响产物纯度或发生其他意外事故。特别是蒸馏硝基化合物及含有过氧化物的溶剂(如乙醚)时,切忌蒸干,以防爆炸。
5、后处理 蒸馏完毕,应先移走热源,待稍冷却后再关好冷却水,以免发生倒吸现象。拆除仪器(其程序与装配时相反),洗净。
六、注释
[1] 常用的止暴剂都是多孔性物质,如碎瓷片或玻璃沸石等。当液体加热到沸腾时,止暴剂内的小气泡成为液体分子的汽化中心(也可以理解为将大气泡边成小气泡),使液体平稳地沸腾,防止液体因过热而产生暴沸。如果蒸馏已经开始但是忘了加沸石,此时千万不要直接加沸石,否则会引起剧烈的暴沸!必须等液体冷却后再补加。如果加热中断,再加热时也应该重新加入沸石,因为原来大沸石上的小孔已经被液体充满,不能再起到汽化中心的作用。
还可以用一端封闭的毛细管作为止暴剂,但是要注意其正确的使用方法,即封口朝上的插入蒸馏烧瓶底部,如图4-5所示。
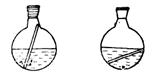
正确 不正确
图4-5 毛细管作为止暴剂时的放置
[2]所用的塞子不能漏气,以免在蒸馏过程中有蒸气渗漏而造成产物的损失,甚至有可能发生火灾。如果漏气,换用另一适合的塞子。
[3]蒸馏易燃易挥发的物质时不能用明火,而应用热浴,否则易引起火灾。
七、思考题
1、在装置中,若把温度计水银球插至液面上或者在蒸馏烧瓶支管口上是否正确?这样会发生什么问题?
2、如果加热过猛,测定出来的沸点会不会偏高?为什么?
3、沸石在蒸馏中的作用是什么?忘记加沸石时,应该怎样补加?
4、为什么蒸馏速度控制在每秒1~2滴最好?
-
常压蒸馏及沸点测定实验
新乡医学院医用化学实验课教案首页授课教师姓名及职称新乡医学院化学教研室年月日实验常压蒸馏及沸点测定一实验目的1了解沸点测定的原理及…
-
乙醇的蒸馏及沸点测定 实验报告
报告题目:乙醇的蒸馏及沸点测定实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:***学生姓名:**学号:**20…
-
有机化学实验-----蒸馏及沸点的测定技术
实验报告姓名班级同组人项目蒸馏及沸点的测定技术课程学号一实验目的1了解蒸馏和沸点测定的基本原理和意义2掌握蒸馏和沸点测定的操作技术…
-
实验二:乙醇的蒸馏及沸点的测定
实验二乙醇的蒸馏及沸点的测定一实验目的1了解蒸馏提纯液体有机物的原理用途2掌握蒸馏提纯液体有机物的操作步骤3了解沸点测定的方法4了…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工133班王腾飞学号134020xx330…
-
有机化学实验-----蒸馏及沸点的测定技术
实验报告姓名班级同组人项目蒸馏及沸点的测定技术课程学号一实验目的1了解蒸馏和沸点测定的基本原理和意义2掌握蒸馏和沸点测定的操作技术…
-
乙醇的蒸馏及沸点的测定
大学化学基础实验II实验报告课程名称物理化学实验实验名称乙醇的蒸馏及沸点的测定姓名张玉学号1108110191专业化学工程与工艺班…
-
乙醇的蒸馏及沸点测定 实验报告
报告题目:乙醇的蒸馏及沸点测定实验报告报告题目:乙醇的蒸馏及沸点测定专业班级:生物工程指导老师:***学生姓名:**学号:**20…
-
熔点.沸点的测定实验报告
有机化学实验报告实验学专班姓指导日名称院业级名教师期熔点的测定沸点的测定化学工程与工艺化工133班王腾飞学号134020xx330…
-
《有机化学实验》复习提纲实验一蒸馏`分馏和沸点的测定
有机化学实验复习提纲实验一蒸馏分馏和沸点的测定一实验目的和基本要求蒸馏和分馏的基本原理是一样的都是利用有机物质的沸点不同在蒸馏过程…
-
实验一 蒸馏、分馏和沸点的测定
实验一蒸馏分馏和沸点的测定一实验目的和基本要求蒸馏和分馏的基本原理是一样的都是利用有机物质的沸点不同在蒸馏过程中低沸点的组分先蒸出…