聚合酶链式反应和琼脂糖凝胶电泳 实验报告
实验三聚合酶链式反应(PCR)以及琼脂糖凝胶电泳
实验目的
1.掌握PCR反应的原理及各反应成分的作用;
2.熟悉PCR反应程序的设计规则;
3.掌握引物的设计原则及其与PCR其他成分的配制方法;
4.掌握琼脂糖凝胶电泳的原理及其应用范围;
5.熟悉琼脂糖凝胶电泳相关缓冲液的配制方法。
实验原理
一.聚合酶链式反应原理
在已知待扩增模板全部或部分序列的情况下,依据DNA半保留复制的机理,在含有Mg2+的缓冲溶液中,采用耐热的DNA聚合酶(Taq酶)在特异性引物(分为上游和下游引物)的引导下,通过dNTP为原料,以cDNA或DNA等为模板,在人为控制DNA合成系统(PCR仪)温度调节下,通过变性(95℃)、退火(50-60℃ )及延伸( 72℃ )等3个步骤的循环进行(30-35循环),在体外进行双链DNA变性为单链,单链DNA与特异性引物退火形成局部双链,进而在DNA聚合酶的作用下使引物沿相应模板延伸为特异性引物所限定范围的大量双链DNA的体外合成反应。
本质为体外DNA合成的酶反应。
二.琼脂糖凝胶电泳反应原理
琼脂糖是一种天然聚合长链状分子,可以形成具有刚性的滤孔,凝胶孔径的大小决定于琼脂糖的浓度。在一定电场强度下偏碱性的缓冲液中(TAE pH8.0或TBE pH7.5-7.8),DNA分子带负电,其迁移速度取决于分子筛效应,在电荷效应与分子筛效应作用下,具有不同的相对分子量及构型的DNA片段泳动速度不同。DNA 分子的迁移速度与相对分子质量的对数值成反比关系。
凝胶电泳不仅可分离不同分子量的DNA,也可以分离分子量相同,但构型不同的DNA分子。如质粒的三种构型的泳动速率不同:超螺旋闭合环状质粒最快,线型质粒其次,开环质粒最慢。
实验步骤
(一)PCR 加样术式
在一微量离心管中依次加入下列试剂:
 水煮裂解后的细菌液 4µL
水煮裂解后的细菌液 4µL
10?PCR buffer(含MgCl2) 2 µL
dNTPs (10mM) 1µL
5’引物(10µM) 1µL 20µL
3’引物(10µM) 1µL
Taq DNA pol. (2U/µL) 1 µL
去离子水(补足反应体系) 10µL
轻弹管底混合(用离心机甩一下)
(二)缓冲液组成
10×PCR buffer:
500 mM KCl
100 mM Tris-Cl (pH 8.3)
15 mM MgCl2
有的会加入硫酸铵(ammonium sulfate),化学式(NH4)2SO4 ,通过破坏蛋白质在稳定因素(亲水行),而使蛋白析出。
(三)dNTP
1. dNTP,(脱氧核糖核苷三磷酸)的缩写。N是指含氮碱基,代表变量指代A、T、G、C、U等中的一种。是包括dA/G/T/C/TP等在内的统称,在生物DNA合成中,以及各种PCR中起原料作用。
2. 4种dNTP必须等浓度配合以减少错配误差,dNTP溶于pH为7.0的NaOH贮存液中,通常的贮存液浓度为10mM,分装后存放在-20℃。dNTP使用浓度在0.02-0.2mM之间。
3.在PCR反应中,使用低dNTP浓度,可减少非靶位置启动和延伸时的核苷酸错误掺入。
4.一般可根据靶序列的长度和组成来决定最低dNTP浓度。
(四)引物设计原则
基本原则是最大限度地提高扩增效率和特异性,同时尽可能抑制非特异性扩增。
1.引物长度: 15-30bp,常用20bp左右;
2.扩增跨度:以500bp为宜;
3.引物碱基:G+C含量以40-60%为宜;
4.避免引物内部出现二级结构和引物间互补;
5.引物3’端的碱基要求严格配对(不能做任何修饰);
6.引物5′端可修饰;
7.引物的特异性;
——引物应与核酸序列数据库的其它序列无明显同源性
8.引物量;
——每条引物的浓度0.1 ~ 0.5μM,以最低引物量产生所需要的结果为好;
(五)引物配制
1. 合成引物一般1OD分装成1管;
2.引物贮存液浓度为10μM,需加纯水或TE(pH8.0)
3. 引物工作终浓度在0.1-0.5μM,就可以满足30个循环的反应。
(六)PCR参数设置
1. 94℃预变性5分钟后开始以下循环
 2 . 94℃ 30 秒
2 . 94℃ 30 秒
60℃ 30 秒 30 -35循环
72℃ 40 秒
3. 72℃ 5 分钟
4. 16℃ 保温
实验过程约1小时30分钟
(七)琼脂糖凝胶的制备
1. 根据电泳需要,配制合适浓度的电泳及制胶缓冲液。一般为1× TAE或
0.5×TBE。
注意:用于电泳的缓冲液和用于制胶的缓冲液必须是相同的。
2.同时配制用于加样过程的加样缓冲液,以便于样本进入胶内。
琼脂糖凝胶电泳缓冲液的配制方法

含不同量琼脂糖的凝胶的分离范围
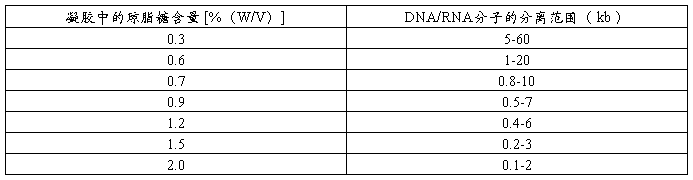
3. 根据制胶量及凝胶浓度,在加有一定量的电泳缓冲液的三角锥瓶中,加入准确称量的琼脂糖粉,充分摇匀。注意:总液体量不宜超过三角锥瓶的50%容量。
4. 在微波炉中加热溶解琼脂糖。
5. 使溶液冷却至60℃左右,如需要可在此时加入溴化乙锭(EB)溶液使其终浓度为0.5μg/mL并充分混匀。
(八)琼脂糖凝胶缓冲液使用方法
1.TBE可以使用10次左右,而TAE用2~3次就要更换。电泳缓冲液多次使用后,离子强度降低,pH值上升,缓冲性能下降,可能使DNA条带模糊或不规则DNA带迁移。
2.电泳缓冲液刚好没过凝胶1mm为好,太多则电流加大,凝胶发热。
(九)琼脂糖凝胶载样缓冲液
1.加样缓冲液是上样时与样品混合后一起加入胶空内。加样缓冲液有三个作用:
增加样品密度以保证DNA沉入加样孔内;
使样品带有颜色便于上样操作;
其中的染料(溴酚蓝和二甲苯氰FF)在电场中以可以预测的泳动速率向阳极迁移。
2.溴酚蓝在琼脂糖凝胶中迁移速率是二甲苯氰FF的2.2倍,这一特性与琼脂糖凝胶的浓度无关;
3.在0.5×TBE琼脂糖凝胶电泳中溴酚蓝的速率约与长约300bp的线性双链DNA相同,而二甲苯氰FF约与长4kb的DNA相同。在0.5%-1.4%浓度的琼脂糖凝胶中基本不会变化。
结果与分析
第二篇:质粒DNA的提取、酶切及其琼脂糖凝胶电泳实验报告

-
琼脂糖凝胶电泳实验
琼脂糖凝胶电泳实验20xx1103094356来源生物秀评论0我要评论实验二琼脂糖凝胶电泳实验实验目的1学习琼脂糖凝胶电泳的基本原…
-
实验七 DNA的琼脂糖凝胶电泳
实验七DNA的琼脂糖凝胶电泳4学时实验目的琼脂糖凝胶电泳是常用的检测核酸的方法具有操作方便经济快速等优点本实验学习DNA琼脂糖凝胶…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告及思考题
1实验目的1通过本次实验学习和掌握碱裂解法提取质粒2通过本次实验学习琼脂糖凝胶电泳检测DNA的方法和技术2实验材料及用品1实验仪器…
-
实验四 DNA的琼脂糖凝胶电泳
龙志敏20xx30220xx109制药一班实验四DNA的琼脂糖凝胶电泳一实验目的1掌握DNA琼脂糖凝胶电泳的原理和方法2学习凝胶成…
-
PCR反应及琼脂糖电泳实验报告
多聚酶链式反应PCR扩增DNA片段及琼脂糖凝胶电泳产物检测一实验目的1了解PCR技术的基本操作2理解PCR的原理3讨论PCR的应用…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告
一实验名称质粒DNA的提取与纯化DNA琼脂糖凝胶电泳二实验原理1质粒DNA的提取质粒是一类存在于几乎所有细菌等微生物中染色体之外细…
-
质粒DNA的提取及其琼脂糖凝胶电泳实验报告及思考题
1实验目的1通过本次实验学习和掌握碱裂解法提取质粒2通过本次实验学习琼脂糖凝胶电泳检测DNA的方法和技术2实验材料及用品1实验仪器…
-
实验七 血清脂蛋白琼脂糖凝胶电泳
实验七血清脂蛋白琼脂糖凝胶电泳一实验目的1进一步掌握电泳的基本原理及凝胶电泳的原理2熟悉琼脂糖凝胶电泳的特点和操作要点3掌握正常人…
-
血清脂蛋白琼脂糖凝胶电泳
血清脂蛋白琼脂糖凝胶电泳原理将血清脂蛋白用脂类染料如苏丹黑或油红O等进行预染再将预染过的血清置于琼脂糖凝胶板上进行电泳分离通电后脂…
-
血清蛋白琼脂糖凝胶电泳
原理琼脂糖agarose是经过挑选以质地较纯的琼脂agar作为原料而制成的琼脂在化学上是由琼脂糖和琼脂胶组成的复合物琼脂胶是一含有…
- 质粒DNA的提取、酶切及其琼脂糖凝胶电泳实验报告