苯甲酸乙酯的制备 完整版内含(实验数据处理、思考题)
 实验四十六 苯甲酸乙酯的制备
实验四十六 苯甲酸乙酯的制备
化工10-4 谭锡森 33
一、摘要:
苯甲酸乙酯(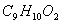 )无色透明液体。能与乙醇、乙醚混溶;不溶于水。用于配制香水香精和人造精油。本实验将用苯甲酸酯化制取苯甲酸乙酯。再取适量样品做鉴定实验。
)无色透明液体。能与乙醇、乙醚混溶;不溶于水。用于配制香水香精和人造精油。本实验将用苯甲酸酯化制取苯甲酸乙酯。再取适量样品做鉴定实验。
关键词:苯甲酸 苯甲酸乙酯 酯化反应 样品鉴定
二、前言:
苯甲酸乙酯(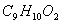 )稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。本实验利用酯化反应法制备,直接从苯甲酸→苯甲酸乙酯,再利用相应的物理、化学、光谱等方法鉴定它的存在!
)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。本实验利用酯化反应法制备,直接从苯甲酸→苯甲酸乙酯,再利用相应的物理、化学、光谱等方法鉴定它的存在!
实验原理:
直接酸催化酯化反应是经典的制备酯的方法,但反应是可逆反应,反应物间建立如下平衡:
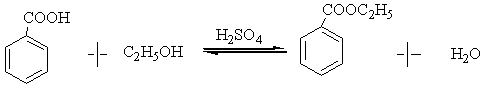
因为这是反应可逆,为提高酯的转化率,使用过量乙醇(价格相对便宜)或将反应生成的水从反应混合物中除去,就可以使平衡向生成酯的方向移动。另外,使用过量的强酸催化剂,水转化成它的共轭酸H3O+, 没有亲核性,也可抑制逆反应的发生。
三、实验仪器及试剂:
苯甲酸8.0 过量无水乙醇20.0ml 浓硫酸 3.0ml Na2CO3 无水硫酸镁 15.0ml环己烷 乙醚
分水回流装置、烧杯、加热套、玻璃棒、分液漏斗等
装置图:
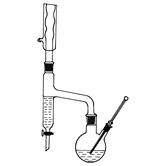
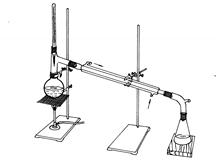
分水回流装置 蒸馏装置
四、实验步骤:
1、 制备样品:于50ml圆底烧瓶中加入:8.0g苯甲酸;20ml乙醇;15ml环己烷;3ml浓硫酸,摇匀,加沸石。水浴上回流约2h,至分水器中层液体约5-6ml停止。记录体积,继续蒸出多余的环己烷和乙醇(从分水器中放出)。移去火源。加水30ml,分批加入固体Na2CO3中和至中性。除2种酸。即硫酸、苯甲酸。分液,水层用20ml石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210-213 oC馏分。
2、 鉴定:
物理方法:取少量样品,用手扇动其,在闻其气味!应该稍有水果气味。
化学方法:酯与羟胺反应生成一种氧 酸。氧 酸与铁离子形成牢固的品红色的络合物。在试管中加入两滴新制备的酯,再加入5滴溴水。有溴水的颜色不变或没有白色沉淀生成,将5滴新制备的酯滴入干燥的试管中,在加入7滴3%的盐酸羟胺的95%酒精溶液和3滴2%的NaOH溶液,摇匀后滴入7滴5%HCl溶液和1滴5% FeCl3溶液,试管内显示品红色,证明酯的存在。
色谱分析:查找相关苯甲酸乙酯的色谱图,在分析产品的色谱与之对照。可以证明苯甲酸乙酯存在与否。
五、结果与分析
苯甲酸乙酯理论值 10.3ml 苯甲酸乙酯实际产量7.0ml 产率68.0%
分析、本组实验在刚开始回流时,没有很好控制温度,造成很快就有恒沸物出来了。后来通过慢慢调整实验温度,最后产率还算理想。
建议、在实验刚开始时,要小火加热,使蒸汽不超过弯曲部位回流半小时后,再升温回流大概两个小时。
思考题:
1、本实验采用何种措施提高酯的产率?
答、①通过增加反应物的浓度,使反应限度加大。②通过分离生成物水,使平衡向右移动。③添加浓硫酸作催化剂,使反应限度加大。
2、为什么采用分水器除水?
答、因为除去生成物水有利于反应向有进行,故要用到分水器。
3、何种原料过量?为什么?为什么要加苯?
答、⑴使用乙醇过量,因为其比较便宜,来源容易。⑵因为在分水回流的过程中,会有由苯、乙醇、水组成的恒沸物带出来,为了使反应物乙醇不随水而带出过多,所以添加苯这个带水剂。
4、浓硫酸的作用是什么?常用酯化反应的催化剂有哪些?
答、浓硫酸是在本实验作为催化剂和干燥剂,常用的酯化反应催化剂有浓硫酸、固体超强酸、苯磺酸,对甲苯磺酸、树脂、路易斯碱、有机锡羧酸酯等
参考文献
- 古风才,肖衍繁,张明杰,刘炳泗《基础化学实验教程》(第二版)科学出版社 20##年
- 茂名学院,《化学实验技能讲义》
- 罗一鸣,唐瑞仁,《有机化学实验与指导》中南大学出版社 20##年
第二篇:实验 苯甲酸乙酯的制备
实验 苯甲酸乙酯的制备
一、实验目的:
1、掌握酯化反应原理,苯甲酸乙酯的制备方法,了解三元共沸除水原理。
2、复习分水器的使用及液体有机化合物的精制方法。
3、进一步练习蒸馏、萃取、干燥和折光率的测定等基本操作。
二、实验原理:
苯甲酸,乙醇在浓硫酸的催化下进行酯化反应,生成苯甲酸乙酯与水。
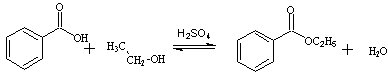
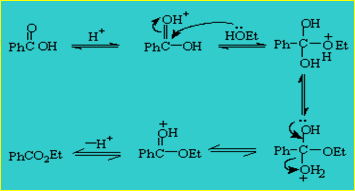 反应机理:
反应机理:
由于苯甲酸乙酯的沸点较高,很难蒸出,所以本实验采用加入环己烷的方法,使环己烷、乙醇和水形成三元共沸物,其沸点为62.1℃。三元共沸物经过冷却形成两相,使环己烷在上层的比例大,再回反应瓶,而水在下层的比例大,放出下层即可除去反应生成的水,使平衡向正方向移动。
三、实验仪器及试剂:
仪器:圆底烧瓶、回流冷凝器、分液漏斗、锥形瓶、烧杯、温度计、球形冷凝管、分水器。
试剂:苯甲酸 4g、无水乙醇10ml、浓硫酸 3ml、Na2CO3、环己烷8ml、乙醚、无水MgSO4、沸石。
装置图:
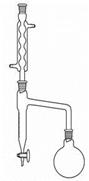 反应装置
反应装置 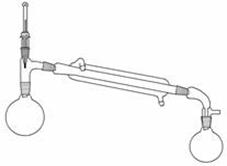 蒸馏装置
蒸馏装置
四、实验步骤:
1、加料:于50ml圆底烧瓶中加入:4g苯甲酸;10ml乙醇;8ml环己烷;3ml浓硫酸,摇匀,加沸石。按照实验仪器左图组装好仪器(安装分水器),加热反应瓶,开始回流。
2、分水回流:开始时回流要慢,随着回流的进行,分水器中出现上下两层。当下层接近分水器支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇和环己烷,至瓶内有白烟或回流下来液体无滴状(约2h),停止加热。
3、中和:将反应液倒入盛有30mL水的烧杯中,分批加入碳酸钠粉末至溶液呈中性(或弱碱性),无二氧化碳逸出,用PH试纸检验。
4、分离萃取、干燥、蒸馏:用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有几层。用无水MgSO4干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,用牛角管直接接收210~213℃的馏分。
5、检验鉴定:
物理方法:取少量样品,用手扇动其,在闻其气味,应该稍有水果气味。
化学方法:酯与羟胺反应生成一种氧酸。氧酸与铁离子形成牢固的品红色的络合物。在试管中加入两滴新制备的酯,再加入5滴溴水。有溴水的颜色不变或没有白色沉淀生成,将5滴新制备的酯滴入干燥的试管中,在加入7滴3%的盐酸羟胺的95%酒精溶液和3滴2%的NaOH溶液,摇匀后滴入7滴5%HCl溶液和1滴5% FeCl3溶液,试管内显示品红色,证明酯的存在。
色谱分析:查找相关苯甲酸乙酯的色谱图,在分析产品的色谱与之对照。可以证明苯甲酸乙酯存在与否。
五、实验记录及处理:
所加试剂的量:
收集到产品的量:
参考:苯甲酸质量m1=4g 摩尔质量 M1=122g/mol
产物苯甲酸乙酯摩尔质量 M2=150g/mol
实验中乙醇原料过量,苯甲酸设为完全反应,则理论苯甲酸乙酯产物量为
m产物=4 x 150/122 g=4.918g ρ产物=1.046g/ml
V理论= m产物÷ρ产物=4.918÷1.046=4.7ml
V实际=2.5ml 产率= V实际÷V理论=2.5÷4.7=53.2%
误差分析:①开始分流是没调节好温度,使蒸汽流至蒸馏烧瓶下端管内。②萃取是不慎将试液流出,使产物减少。
六、思考与讨论:
1、本实验采用何种措施提高酯的产率?
2、为什么采用分水器除水?
3、何种原料过量?为什么?为什么要加苯?
4、浓硫酸的作用是什么?常用酯化反应的催化剂有哪些?
5、为什么用水浴加热回流?
6、在萃取和分液时,两相之间有时出现絮状物或乳浊液,难以分层,如何解决?
七、注意事项:
1、注意浓硫酸的取用安全。加入浓硫酸应慢加且混合均匀,防止炭化。
2、回流时温度和时间的控制(反应初期小火加热、反应终点的正确判断)。
3、分水回流开始要控制温度,控制先前一个小时保持回流蒸汽在分水器接圆底烧瓶内管处。
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备班级姓名学号摘要苯甲酸乙酯C9H10O2为无色透明液体其能与乙醇乙醚环己烷混溶不溶于水用于配制香水香精和人造精油等…
-
苯甲酸乙酯的制备 完整版内含(实验数据处理、思考题)
实验苯甲酸乙酯的制备化工104谭锡森33一摘要苯甲酸乙酯C9H10O2无色透明液体能与乙醇乙醚混溶不溶于水用于配制香水香精和人造精…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备高分子11309苯甲酸乙酯C9H10O2稍有水果气味用于配制香水香精和人造精油也大量用于食品中也可用作有机合成中间…
-
苯甲酸乙酯的合成_实验报告
有机化学实验报告20##年11月8日第一部分:实验预习部分一、实验目的(要求)1.学习苯甲酸乙酯的制备原理及操作方法。2.了解共沸…
-
对氨基苯甲酸乙酯的制备大实验报告
前言对氨基苯甲酸乙酯别名苯佐卡因白色晶体状粉末无嗅无味分子量16519熔点9192易溶于醇醚氯仿能溶于杏仁油橄榄油稀酸难溶于水其作…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备班级姓名学号摘要苯甲酸乙酯C9H10O2为无色透明液体其能与乙醇乙醚环己烷混溶不溶于水用于配制香水香精和人造精油等…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备高分子11309苯甲酸乙酯C9H10O2稍有水果气味用于配制香水香精和人造精油也大量用于食品中也可用作有机合成中间…
-
苯甲酸乙酯的合成_实验报告
有机化学实验报告20##年11月8日第一部分:实验预习部分一、实验目的(要求)1.学习苯甲酸乙酯的制备原理及操作方法。2.了解共沸…
-
实验 苯甲酸乙酯的制备
实验苯甲酸乙酯的制备一实验目的1掌握酯化反应原理苯甲酸乙酯的制备方法了解三元共沸除水原理2复习分水器的使用及液体有机化合物的精制方…
-
苯甲酸乙酯的制备
苯甲酸乙酯的制备化工104班李德昌23号摘要苯甲酸乙酯C9H10O2无色透明液体能与乙醇乙醚混溶不溶于水用于配制香水香精和人造精油…
-
分析实验报告 红外光谱测定苯甲酸 - 最终版
华南师范大学实验报告学号专业年级班级实验时间实验指导老师郭长娟老师实验评分红外光谱法测定苯甲酸一实验目的1了解苯甲酸的红外光谱特征…