苯甲酸乙酯的制备
苯甲酸乙酯的制备
化工10-4班 李 德 昌 23 号
摘要:
苯甲酸乙酯(C9H10O2)无色透明液体。能与乙醇、乙醚混溶;不溶于水。用于配制香水香精和人造精油。本实验将用苯甲酸酯化制取苯甲酸乙酯。再取适量样品做鉴定实验。
关键词:苯甲酸 苯甲酸乙酯 酯化反应 样品鉴定
前言:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油;也大量用于食品中,也可用作有机合成中间体、溶剂如纤维素酯、纤维素醚、树脂等。本实验利用酯化反应法制备,直接从苯甲酸→苯甲酸乙酯,再利用相应的物理、化学、光谱等方法鉴定它的存在。 实验原理:
直接酸催化酯化反应是经典的制备酯的方法,但反应是可逆反应,反应物间建立如下平衡:


C2H5OH2H5H2O
因为这是反应可逆,为提高酯的转化率,使用过量乙醇(价格相对便宜)或将反应生成的水从反应混合物中除去,就可以使平衡向生成酯的方向移动。另外,使用过量的强酸催化剂,水转化成它的共轭酸H3O, 没有亲核性,也可抑制逆反应的发生。
+
实验仪器及试剂:
苯甲酸 无水乙醇 浓硫酸 Na2CO3 无水MgSO4, 石油醚 环己烷
分水回流装置 烧杯 电热套 玻璃棒 分液漏斗 饱和NaCl溶液
实验装置图:
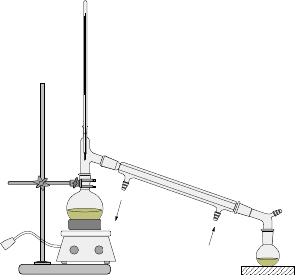
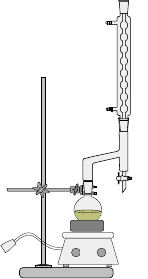
分水回流装置 蒸馏装置
实验步骤
⑴加料:于100ml圆底烧瓶中加入:8g苯甲酸;20ml乙醇;15ml环己烷;3ml浓硫酸(慢慢加),摇匀,加少量沸石。
⑵、分水回流:回流约2h,至瓶内有白烟或回流下来液体无滴状,继续蒸出多余的环己烷和乙醇(从分水器中放出)移去火源。
⑶、分离萃取:加入10ml饱和食盐水,分液,水层用石油醚萃取。合并有机层。
⑷、中和、干燥:加Na2CO3中和至中性,用PH试纸检验,然后加水洗涤,最后用无水
硫酸镁干燥。
⑸、蒸馏:回收石油醚(80℃左右)。加热精馏,收集210-213 oC馏分。即为苯甲酸已酯。
结果与讨论
1、实验数据记录及处理
苯甲酸质量m1=8g 摩尔质量 M1=122g/mol
产物苯甲酸乙酯摩尔质量 M2=150g/mol
实得产物苯甲酸乙酯7.0 ml 产物为无色透明液体,有芳香气味。
实验中乙醇原料过量,苯甲酸设为完全反应,则理论苯甲酸乙酯产物量为
m产物=8 x 150/122 g=9.836g ρ产物=1.046g/ml
V理论= m产物÷ρ产物=9.836÷1.046=9.4ml
V实际=7.0ml 产率= V实际÷V理论=7.0÷9.4=74.5%
结果分析:本次实验产率算比较高。
2、造成产率降低的原因分析:
①开始分流时温度没调节好,温度过高使没反应的乙醇和水蒸汽带出了烧瓶落 分水器无法返回参与反应,使产物减少。
②萃取是不慎造成长物流失,使产物减少。
3、实验成败关键:
(1)加入浓硫酸应缓慢加入且混合均匀,防止炭化。
(2)要控制好开始回流时候的温度和时间。
(3)中和酸要恰好在中性最好,溶液呈碱性会使产物苯甲酸乙酯部分水解,造成 产 率降低。
4、 鉴定:
物理方法:取少量样品,用手扇动其,在闻其气味,应该稍有水果气味。
化学方法:酯与羟胺反应生成一种氧 酸。氧 酸与铁离子形成牢固的品红色的络合物。在试管中加入两滴新制备的酯,再加入5滴溴水。有溴水的颜色不变或没有白色沉淀生成,将5滴新制备的酯滴入干燥的试管中,在加入7滴3%的盐酸羟胺的95%酒精溶液和3滴2%的NaOH溶液,摇匀后滴入7滴5%HCl溶液和1滴5% FeCl3溶液,试管内显示品红色,证明酯的存在。
色谱分析:查找相关苯甲酸乙酯的色谱图,在分析产品的色谱与之对照。可以证明苯甲酸乙酯存在与否。
参考文献
1. 古风才,肖衍繁,张明杰,刘炳泗《基础化学实验教程》(第二版)科学出版社 20xx年
2. 罗一鸣,唐瑞仁,《有机化学实验与指导》中南大学出版社 20xx年
第二篇:领悟·迁移·创新——从乙酸乙酯到苯甲酸甲酯
领悟·迁移·创新
——从乙酸乙酯到苯甲酸甲酯
无锡市堰桥中学 陈 美 (214174)
高三化学实验复习中,如何避免盲目重复练习、激发学生的探究精神、提高教学质量?本人认为 引导学生以教材为本 、充分挖掘教材的丰富内涵是提高实验复习效率的基本途径。本文以“苯甲酸甲酯制备的方案设计”为例,与同仁们共商。
乙酸乙酯的制备实验是中学化学实验中的重点内容之一,它在高二册P168上作为演示实验、又在P234上安排学生实验。高三教材第六单元 P81设置了课后讨论题“以苯甲酸为原料,设计制取苯甲酸甲酯的实验方案”,该题既是巩固新知识《制备实验方案的设计》,同时又是对高二酯化反应原理和实验操作的拓展与延伸。
一、 领悟:
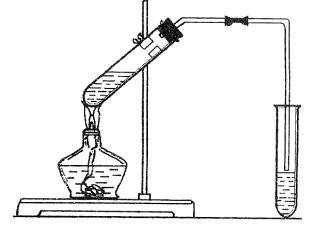
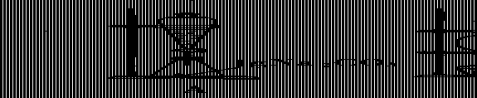
首先按高二册P234《学生实验八》让学生重新体验实验操
作过程,观察实验现象,让学生充分感知“乙酸乙酯制取实验”
的反应原理、反应条件、实验装置(装置如右图),在此基础上
设置导读自学提纲,引导学生仔细阅读课本,思考议论,各抒己
见。导读提纲:
1、本实验的反应原理是 (用方程式表示,注明反应条件),反应的特点是 ,如何提高乙酸乙酯的产量?
2、实验过程中碎瓷片的作用是 ,浓硫酸的作用是 饱和碳酸钠的作用是① ② ③
3、实验操作中,向容器中添加试剂的顺序是 ,为什么这样操作? 。
4、本实验中制得的乙酸乙酯是否纯净?如果要得到纯净的乙酸乙酯,需要怎样操
作?
5、通过实验,你觉得该装置有何优、缺点?实验过程中还需要注意哪些问题?怎样
改进? 在学生阅读、实验、讨论的基础上,老师重点对酯化反应原理、反应特点(可逆反应)、反应条件、反应装置的选择、物质的分离提纯等作出精心指导,使学生领悟到酯
1
化反应的意义和制取方法,理解酯化反应的实质和反应历程,掌握实验室制取酯类物质的操作步骤。
二、 迁移
思考讨论:1、本实验的目的、涉及的反应原理、反应有何特点?
2、选择哪些仪器药品?是否需要碎瓷片?
3、使用冷凝回流装置时,选择长直导管好还是用冷凝管好?为什么?如果
选择冷凝管,进、出水的方向要怎样处理?为什么?
4、怎样将苯甲酸甲酯粗产品从混合物中分离出来?
5、怎样进一步除去混在苯甲酸甲酯中的硫酸和苯甲酸杂杂质?
6、怎样除去剩余的碳酸钠和生成的硫酸钠?
启发学生运用知识的类比迁移,完成以上讨论问题的前提下,得到最佳的苯甲酸甲酯制备的实验方案。
第一步:明确实验目的
1.加深对酯化反应原理、平衡移动原理的认识与运用。
2.分析并评价苯甲酸甲酯在浓硫酸催化条件下,加热可制得苯甲酸甲酯的粗产品,
经冷却、分液、除杂、过滤、蒸馏即可得到苯甲酸甲酯。
第二步:理解反应原理和特点:
反应原理 :C6H5COOH + CH3OH C6H5COOCH3 +H2O
( 羧酸 ) + ( 醇酯) + (水)
反应特点:①固体 + 液体液体 + 水 (选择反应装置的依据)
②可逆反应根据化学平衡移动原理,增大反应物浓度,可以使
平衡向有利于苯甲酸甲酯生成的方向移动,由于甲醇相对易得、价格低、易回收,采用甲醇过量的方法提高苯甲酸甲酯的产量。
反应的条件:加热、浓硫酸做催化剂
第三步:查找有关资料
2
第四步: 选择实验用品:
与实验室制乙酸乙酯相比,作如下改进:①在加热过程中所盛液体的体积不能超过试管容积的1/3,因此采用圆底烧瓶代替大试管;②为了有利于产物收集 ,增加冷凝管使用;③为了得到较纯净的苯甲酸甲酯,增加了分液、过滤、蒸馏等装置。 第五步:设计装置及操作方案(详见下图所示):
实验步骤:
1、在圆底烧瓶中放入少量碎瓷片,15g苯甲酸,20mL甲醇,混合均匀后,小心加入3mL浓硫酸,将球形冷凝管安装在 圆底烧瓶上,按图示方向接好冷凝
管的进、出水口,加热反应容器。
2、冷凝后向圆底烧瓶中加入25mL蒸馏水,将其移到分液漏斗中,振荡、静置、分液,将下层液体移入盛有1gNa2CO3固体的干燥锥形瓶中。
3、准备过滤装置:将一小片棉花平铺、放入普通漏斗中,再将此过滤器置于蒸馏烧瓶口上,将第二步操作所得到的生成物过滤。
4、将所得滤液蒸馏,收集199℃时的馏分,得到苯甲酸甲酯。
第五步:写出完整的实验报告(略)。
第六步:拓展延伸——有机物制备实验方案中,一般应考虑哪些问题?
1.选用适当的催化剂。
2.一般反应是可逆的,考虑平衡移动的原理的应用。
3.冷凝回流,提高原料的利用率

3
4.液态有机物混合物的分离往往根据沸点的不同采用蒸馏。
5.分液筛取。分离提纯。
三、创新提高
例1 20xx年《江苏省高考模拟试卷》(第17题)苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应和水解反应的原理,可以进行苯甲酸甲酯的合成和皂化反应。有关物质的物理性质见下表所示:
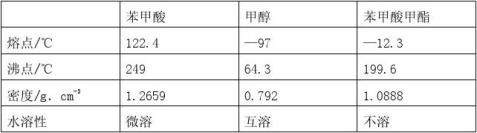
Ⅰ 苯甲酸甲酯的合成与提纯
相关的实验步骤为:
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应
第二步::水洗提纯
第三步::蒸馏提纯
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)
(2)C装置中除了装有15g苯甲酸和20mL过量的甲醇外还需要 , 。作用分别是- , 。
(3)C装置中冷凝管的作用是 ,A装置中固体Na2CO3作用是
Ⅱ 苯甲酸甲酯的皂化反应
4
(4)能说明G装置中反应完全的现象是 。
(5)在Ⅱ中得到白色固体的质量为5g。假设反应Ⅰ和反应Ⅱ中:蒸馏提纯的效率为
66.7%,加浓盐酸苯甲酸钠生成固体的装化率为80%,酯化反应中苯甲酸的转化率为X。
其他步骤的转化率为100%,则X=- 。
例2 20xx年《全国高中学生化学竞赛(江苏赛区)预赛试题》(第17题,题略)已知
苯甲酸乙酯的沸点为213℃,水---乙醇---环己烷三元共非物的共沸点为62.1℃(即在
此温度下水、乙醇、环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出)。请回答就下
述实验室制备苯甲酸乙酯提出的问题:
(1)①在圆底烧瓶中加入苯甲酸、浓硫酸、过量的乙醇、沸石。②再向烧瓶中加入环
己烷,装上分水器和回流冷凝管。( ②的目的
是 );
(2)缓慢加热回流,至分水器下层液体不再增多,停止加热;放出分水器中液体(液
体的三种主要成分是 );继续加热,使多余的 蒸至分水器中;至分水器中液体不再增加,停止加热;
(3)将圆底烧瓶中残液倒入盛有冷水的烧杯中,用 溶液
中和至弱碱性;用 进行 操作,分出粗产品;水
层用乙醚 ,醚层与粗产品合并;用纯水洗有机物2次,
将醚层与水尽量分净,醚层从上口倒入一个干燥的锥形瓶;
(4)加入适量豆粒大小的无水氯化钙干燥剂,摇动锥形瓶,至
醚层澄清透明;醚层过滤入一个干燥的圆底烧瓶;进行 ,先蒸出 ;
后蒸出苯甲酸乙酯。
(参考答案:例1(1)CFEADB (2)浓硫酸 沸石 催化剂 防止暴沸
(3)冷凝回流 洗去苯甲酸甲酯中过量的酸
(4)不分层 (5)62.5%
例2 (1)通过形成水—乙醇---环己烷三元共沸物分离反应过程中生成的
水,促进酯化反应向正反应方向进行。
(2)水、乙醇、环己烷 乙醇、环己烷
(3)碳酸钠 分液漏斗 分液 萃取
(4)蒸馏 乙醚
四、反思总结

5
化学是建立在实验基础之上的自然科学,实验在高考中所占的比例也逐年上升,近几年基本稳定在20%。分析近几年化学实验试题,主要有以下几个特点:(1)直接以教材的演示实验、学生实验为情景,形成实验试题。如 全国卷2002(29)题、2004(28)题;江苏卷2005(15)、2006(4)等,这些题目都直接源于教材,都是考查学生的基础知识和实验操作能力。(2)以教材实验为主干,创设实验情景,形成实验试题。如理综全国卷2005(28) ;江苏卷2004(20)、2005(19)等。这类实验以教材实验为主要实验情景,或部分改动,或将多个实验相连,或增加少量实验内容,考查学生的各项实验能力,真正体现“源于教材而高于教材”的命题原则。(3)基于教材中学生熟知的化学反应或原理,创设实验情景,形成实验试题。如20xx年两广、河南19题;全国理综2005(27)等。这些试题仍源于教材,涉及的基本原理均来自教材的元素化合物基本知识和选修教材的化学实验设计方案的基本要求,依然是考查学生的“双基”,当然也考查了学生的设计能力、分析能力与思维能力。由此可见,回归教材是化学高考的命题趋势,也是进行化学复习的根本原则。 在平时的教学中,只要我们多动脑子,多思考些问题,多总结一些规律,对教材实验进行改进、延伸与挖掘比搞题海战术,效果要好得多。
6
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备班级姓名学号摘要苯甲酸乙酯C9H10O2为无色透明液体其能与乙醇乙醚环己烷混溶不溶于水用于配制香水香精和人造精油等…
-
苯甲酸乙酯的制备 完整版内含(实验数据处理、思考题)
实验苯甲酸乙酯的制备化工104谭锡森33一摘要苯甲酸乙酯C9H10O2无色透明液体能与乙醇乙醚混溶不溶于水用于配制香水香精和人造精…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备高分子11309苯甲酸乙酯C9H10O2稍有水果气味用于配制香水香精和人造精油也大量用于食品中也可用作有机合成中间…
-
实验 苯甲酸乙酯的制备
实验苯甲酸乙酯的制备一实验目的1掌握酯化反应原理苯甲酸乙酯的制备方法了解三元共沸除水原理2复习分水器的使用及液体有机化合物的精制方…
-
苯甲酸乙酯的合成_实验报告
有机化学实验报告20##年11月8日第一部分:实验预习部分一、实验目的(要求)1.学习苯甲酸乙酯的制备原理及操作方法。2.了解共沸…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备班级姓名学号摘要苯甲酸乙酯C9H10O2为无色透明液体其能与乙醇乙醚环己烷混溶不溶于水用于配制香水香精和人造精油等…
-
苯甲酸乙酯的制备实验报告
苯甲酸乙酯的制备高分子11309苯甲酸乙酯C9H10O2稍有水果气味用于配制香水香精和人造精油也大量用于食品中也可用作有机合成中间…
-
苯甲酸乙酯的合成_实验报告
有机化学实验报告20##年11月8日第一部分:实验预习部分一、实验目的(要求)1.学习苯甲酸乙酯的制备原理及操作方法。2.了解共沸…
-
苯甲酸乙酯的制备 完整版内含(实验数据处理、思考题)
实验苯甲酸乙酯的制备化工104谭锡森33一摘要苯甲酸乙酯C9H10O2无色透明液体能与乙醇乙醚混溶不溶于水用于配制香水香精和人造精…
-
实验 苯甲酸乙酯的制备
实验苯甲酸乙酯的制备一实验目的1掌握酯化反应原理苯甲酸乙酯的制备方法了解三元共沸除水原理2复习分水器的使用及液体有机化合物的精制方…