化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定
(实验报告及数据处理)
实验目的
1.了解浓度、温度及催化剂对化学反应速率的影响。
2.测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
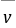 = -
= - 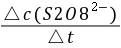 =
= 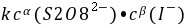 式中:
式中: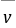 ── 反应的平均反应速率;
── 反应的平均反应速率;
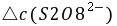 ──
── 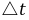 时间内
时间内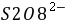 的浓度变化;
的浓度变化;
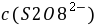 ,
,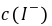 ──
── 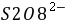 ,
,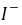 的起始浓度;
的起始浓度;
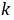 ── 该反应的速率系数;
── 该反应的速率系数;
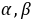 ──反应物
──反应物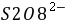 ,
,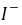 的反应级数,
的反应级数,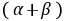 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(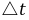 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq) ══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
由反应(1)和(2)的关系可以看出,每消耗1mol S2O82- 就要消耗2 mol 的S2O32-,即
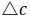 (S2O82-)=
(S2O82-)= 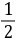
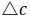 (S2O32-)
(S2O32-)
由于在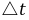 时间内,S2O32-已全部耗尽,所以
时间内,S2O32-已全部耗尽,所以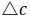 (S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
(S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
-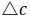 (S2O32-)=
(S2O32-)= 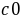 (S2O32-)
(S2O32-)
这里的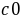 (S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而
(S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而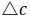 (S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(
(S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(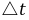 ),就可以算出一定温度下该反应的平均反应速率:
),就可以算出一定温度下该反应的平均反应速率:
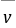 =
=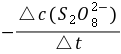 =
=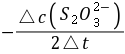 =
=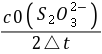 按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由
按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由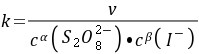 求出反应的速率系数
求出反应的速率系数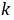 。
。
由Arrhenius方程得
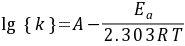 式中:
式中: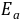 ── 反应的活化能;
── 反应的活化能;
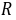 ── 摩尔气体常数,
── 摩尔气体常数,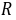 = 8.314 J·mol-1·K-1 ;
= 8.314 J·mol-1·K-1 ;
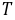 ── 热力学温度
── 热力学温度
求出不同温度时的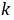 值后,以
值后,以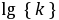 对
对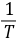 作图,可得一直线,由直线的斜率
作图,可得一直线,由直线的斜率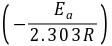 可求得反应的活化能
可求得反应的活化能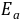 。
。
Cu2+可以加快(NH4)2S2O8与KI反应的速率,Cu2+的加入量不同,加快的反应速率也不同。
仪器、药品及材料
仪器:恒温水浴一台,烧杯(50ml)5个(标上1、2、3、4、5),量筒[10ml4个,分别贴上0.2mol·L-1(NH4)2S2O8,0.2mol·L-1KI,0.2mol·L-1KNO3,0.2mol·L-1(NH4)2SO4;5ml 2个,分别贴上0.05 mol·L-1Na2S2O3,0.2%淀粉],秒表1块,玻璃棒或电磁搅拌器。
药品:(NH4)2S2O8(0.2mol·L-1),KI(0.2mol·L-1),Na2S2O3(0.05mol·L-1), KNO3(0.2mol·L-1), (NH4)2SO4(0.2mol·L-1),淀粉溶液(0.2%),Cu(NO3)2(0.02mol·L-1)。
实验步骤
1.浓度对反应速率的影响,求反应级数、速率系数
在室温下,按表1所列各反应物用量,用量筒准确量取各各试剂,除0.2mol·L-1(NH4)2S2O8溶液外,其余各试剂均可按用量混合在各编号烧杯中,当加入0.2mol·L-1(NH4)2S2O8溶液时,立即计时,并把溶液混合均匀(用玻璃棒搅拌或把烧杯放在电磁搅拌器上搅拌),等溶液变蓝时停止计时,记下时间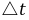 和室温。
和室温。
计算每次实验的反应速率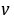 ,并填入表1中。
,并填入表1中。
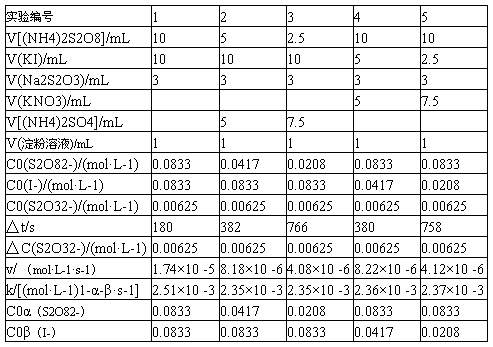
表1 浓度对反应速率的影响 室温:15℃
用表1中实验1、2、3的数据,依据初始速率法求α;用实验1、4、5的数据,求出β,再求出(α+β);再由公式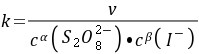 求出各实验的
求出各实验的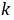 ,填表。
,填表。
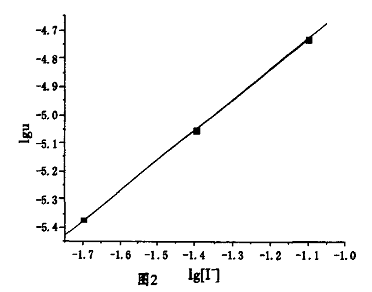
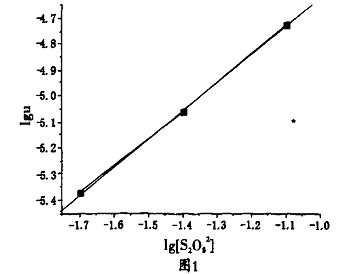
由图可知直线斜率分别为α≈1 β≈1 ,所求反应级数为α+β=2
2.温度对反应速率的影响,求活化能
按表1中实验1的试剂用量分别在高于室温5℃、10℃和15℃的温度下进行实验。这样就可测得这三个温度下的反应时间,并计算三个温度下的反应速率及速率系数,把数据和实验结果填入表2中。
表2 温度对反应速率的影响

利用表2中各次实验的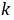 和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能
和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能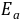
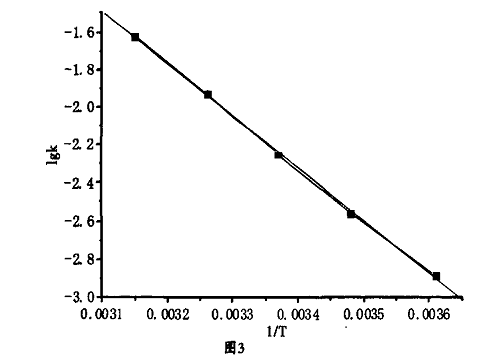
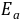 =直线斜率×-2.303R 由图可求K=2.879 进而求的
=直线斜率×-2.303R 由图可求K=2.879 进而求的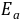 =55.12
=55.12
3.催化剂对反应速率的影响
在室温下,按表1中实验1的试剂用量,再分别加入1滴、5滴、10滴0.02mol·L-1Cu(NO3)2溶液[为使总体积和离子强度一致,不足10滴的用0.2mol·L-1(NH4)2SO4溶液补充]。
表3 催化剂对反应速率的影响

将表3中的反应速率与表1中的进行比较,你能得出什么结论?
思考题
1.若用I-(或I3-)的浓度变化来表示该反应的速率,则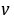 和
和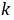 是否和用S2O82-的浓度变化表示的一样?
是否和用S2O82-的浓度变化表示的一样?
2.实验中当蓝色出现后,反应是否就终止了?
洛阳理工学院作业
B110602
第二篇:化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告
姓名_______ 班级_______ 试验时间_______
第__室__号位 指导教师_______
实验目的
1.了解浓度、温度及催化剂对化学反应速率的影响。
2.测定(NH4)2S2O8与KI反应的速率、反应级数、速率系数和反应的活化能。
实验原理
(NH4)2S2O8和KI在水溶液中发生如下反应:
S2O82-(aq)+ 3I-(aq) = 2SO42- (aq)+ I3-(aq) (1)
这个反应的平均反应速率为
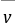 = -
= - 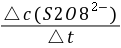 =
= 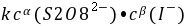 式中:
式中: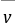 ── 反应的平均反应速率;
── 反应的平均反应速率;
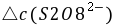 ──
── 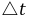 时间内
时间内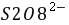 的浓度变化;
的浓度变化;
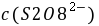 ,
,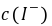 ──
── 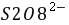 ,
,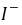 的起始浓度;
的起始浓度;
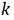 ── 该反应的速率系数;
── 该反应的速率系数;
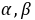 ──反应物
──反应物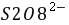 ,
,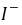 的反应级数,
的反应级数,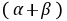 为该反应的总级数。
为该反应的总级数。
为了测出在一定时间(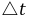 )内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
)内S2O82-的浓度变化,在混合(NH4)2S2O8和KI溶液的同时,加入一定体积的已知浓度的Na2S2O3溶液和淀粉,这样在反应(1)进行的同时,还有以下反应发生:
2S2O32- (aq) + I3-(aq) ══ S4O62-(aq) + 3I-(aq) (2)
由于反应(2)的速率比反应(1)的大得多,由反应(1)生成的I3-会立即与S2O32-反应生成无色的S4O62-和I-。这就是说,在反应开始的一段时间内,溶液呈无色,但当Na2S2O3一旦耗尽,由反应(1)生成的微量I3-就会立即与淀粉作用,使溶液呈蓝色。
由反应(1)和(2)的关系可以看出,每消耗1mol S2O82- 就要消耗2 mol 的S2O32-,即
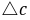 (S2O82-)=
(S2O82-)= 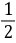
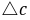 (S2O32-)
(S2O32-)
由于在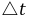 时间内,S2O32-已全部耗尽,所以
时间内,S2O32-已全部耗尽,所以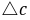 (S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
(S2O32-)实际上就是反应开始时Na2S2O3的浓度,即
-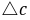 (S2O32-)=
(S2O32-)= 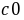 (S2O32-)
(S2O32-)
这里的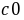 (S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而
(S2O32-)为Na2S2O3的起始浓度。在本实验中,由于每份混合液中Na2S2O3的起始浓度都相同,因而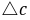 (S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(
(S2O32-)也是相同的,这样,只要记下从反应开始到出现蓝色所需要的时间(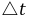 ),就可以算出一定温度下该反应的平均反应速率:
),就可以算出一定温度下该反应的平均反应速率:
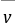 =
=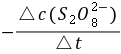 =
=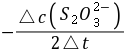 =
=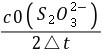 按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由
按照初始速率法,从不同浓度下测得的反应速率,即可求出该反应的反应级数α和β,进而求得反应的总级数(α+β),再由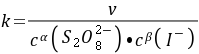 求出反应的速率系数
求出反应的速率系数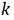 。
。
由Arrhenius方程得
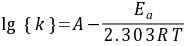 式中:
式中: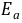 ── 反应的活化能;
── 反应的活化能;
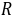 ── 摩尔气体常数,
── 摩尔气体常数,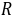 = 8.314 J·mol-1·K-1 ;
= 8.314 J·mol-1·K-1 ;
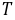 ── 热力学温度
── 热力学温度
求出不同温度时的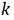 值后,以
值后,以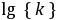 对
对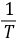 作图,可得一直线,由直线的斜率
作图,可得一直线,由直线的斜率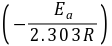 可求得反应的活化能
可求得反应的活化能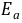 。
。
Cu2+可以加快(NH4)2S2O8与KI反应的速率,Cu2+的加入量不同,加快的反应速率也不同。
仪器、药品及材料
仪器:恒温水浴一台,烧杯(50ml)5个(标上1、2、3、4、5),量筒[10ml4个,分别贴上0.2mol·L-1(NH4)2S2O8,0.2mol·L-1KI,0.2mol·L-1KNO3,0.2mol·L-1(NH4)2SO4;5ml 2个,分别贴上0.05 mol·L-1Na2S2O3,0.2%淀粉],秒表1块,玻璃棒或电磁搅拌器。
药品:(NH4)2S2O8(0.2mol·L-1),KI(0.2mol·L-1),Na2S2O3(0.05mol·L-1), KNO3(0.2mol·L-1), (NH4)2SO4(0.2mol·L-1),淀粉溶液(0.2%),Cu(NO3)2(0.02mol·L-1)。
实验步骤
1.浓度对反应速率的影响,求反应级数、速率系数
在室温下,按表1所列各反应物用量,用量筒准确量取各各试剂,除0.2mol·L-1(NH4)2S2O8溶液外,其余各试剂均可按用量混合在各编号烧杯中,当加入0.2mol·L-1(NH4)2S2O8溶液时,立即计时,并把溶液混合均匀(用玻璃棒搅拌或把烧杯放在电磁搅拌器上搅拌),等溶液变蓝时停止计时,记下时间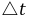 和室温。
和室温。
计算每次实验的反应速率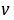 ,并填入表1中。
,并填入表1中。
表1 浓度对反应速率的影响 室温:15℃
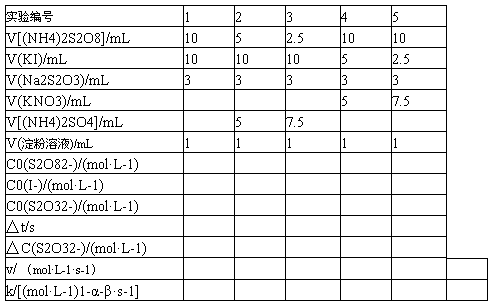
用表1中实验1、2、3的数据,依据初始速率法求α;用实验1、4、5的数据,求出β,再求出(α+β);再由公式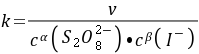 求出各实验的
求出各实验的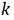 ,填表。
,填表。
2.温度对反应速率的影响,求活化能
按表1中实验1的试剂用量分别在高于室温5℃、10℃和15℃的温度下进行实验。这样就可测得这三个温度下的反应时间,并计算三个温度下的反应速率及速率系数,把数据和实验结果填入表2中。
表2 温度对反应速率的影响

利用表2中各次实验的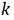 和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能
和T,作lg{k}-T-1图,求出直线的斜率,进而求出反应(1)的活化能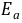 3.催化剂对反应速率的影响
3.催化剂对反应速率的影响
在室温下,按表1中实验1的试剂用量,再分别加入1滴、5滴、10滴0.02mol·L-1Cu(NO3)2溶液[为使总体积和离子强度一致,不足10滴的用0.2mol·L-1(NH4)2SO4溶液补充]。
表3 催化剂对反应速率的影响
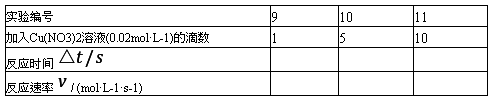
将表3中的反应速率与表1中的进行比较,你能得出什么结论?
思考题
1.若用I-(或I3-)的浓度变化来表示该反应的速率,则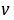 和
和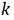 是否和用S2O82-的浓度变化表示的一样?
是否和用S2O82-的浓度变化表示的一样?
2.实验中当蓝色出现后,反应是否就终止了?
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告及数据处理实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42S2O8与KI反应的速…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
物化实验报告_乙酸乙酯皂化反应速率
实验9乙酸乙酯皂化反应速率系数测定丛乐20xx011007生51实验日期20xx年12月8日星期六提交报告日期20xx年12月22…
-
化学反应速率与活化能的测定实验报告
化学反应速率与活化能的测定实验报告姓名班级试验时间第室号位指导教师实验目的1了解浓度温度及催化剂对化学反应速率的影响2测定NH42…
-
化学反应速率及活化能的测定实验报告
化学反应速率及活化能的测定实验报告1概述化学反应速率用符号J或表示其定义为Jddt31为反应进度单位是molt为时间单位是s所以单…
-
实验六 化学反应速率和活化能的测定
实验六化学反应速率和活化能的测定Chemlab软件模拟一实验目的1了解虚拟化学实验室CorelChemlab软件的功能和使用2模拟…
-
实验7 化学反应速率与活化能
实验7化学反应速率与活化能一实验目的1了解实验原理测定过二硫酸铵与碘化钾反应的反应速率计算反应级数反应速率常数及反应的活化能2掌握…
-
大学物理化学实验报告-燃烧热的测定
物理化学实验报告院系:化学化工学院班级:化学061学号:13姓名:实验名称:燃烧热的测定日期:20XX.5.20同组者姓名:室温气…